根癌农杆菌介导BDN1基因转化马铃薯的研究
潘映雪 张丽莉* 石 瑛 卢翠华 林忠平
(1东北农业大学农学院,黑龙江哈尔滨 150030;2北京大学生命科学学院,北京 100 871)
马铃 薯(Solanum tuberosumL.)是茄科、茄属双子叶植物,世界上重要的粮菜兼用作物和工业加工原料作物。据联合国粮农组织统计,2009年我国马铃薯种植面积达到508.30 万hm2,占全球马铃薯面积的1/4,总产量达7 328.19万t,占全球总产量的1/5,种植面积和总产量均居世界第1位。据预测,今后20 a我国粮食还需要增加1亿t才能基本满足人口增长和社会发展的需要,其中50%将来自马铃薯(贾晶霞 等,2011;柳俊,2011;邱彩玲 等,2011)。但是,多种因素制约着马铃薯的产量,其中干旱胁迫的影响尤为突出,会引起马铃薯体内代谢和生长的可逆性抑制,严重时甚至会引起不可逆伤害导致整个植株死亡,干旱胁迫导致的马铃薯产量减少超过了其他因素所造成的减产的总和。我国现有马铃薯主产区多为土地贫瘠、水资源缺乏、农业生产条件差的地区,60%以上马铃薯种植在无灌溉条件的干旱和半干旱地区(FAOSTAT,2009)。对于解决干旱问题主要采取两种措施,一是采用节水灌溉技术,如滴灌、微喷等;二是通过生物技术培育耐旱作物品种。前者耗资巨大,极少应用于大田作物,因此培育耐旱的作物品种就日益重要。
本试验用的脱水蛋白基因BDN1是由北京大学生命科学学院赵恢武等(2000)根据植物脱水素基因的保守区域设计引物,从耐旱植物厚叶旋蒴苣苔总cDNA中扩增出来的,与干旱、低温、盐碱胁迫应答密切相关。目前,该基因能够在一定程度上增强烟草(ZHAO et al.,2000)、矮牵牛(王君丹 等,2004)对干旱胁迫的耐受性。将此基因导入马铃薯品种东农303中,研究转BDN1基因马铃薯对干旱胁迫的反应能力,期望获得耐旱马铃薯材料,为马铃薯抗逆育种提供新资源。
1 材料与方法
1.1 试验材料

图1 pCAMBIA2301-BDN1植物表达质粒结构示意图
1.2 遗传体系的优化
1.2.1 不同激素浓度配比培养基对薯块再生的影响 以MS培养基作为基础添加玉米素(ZT)和吲哚乙酸(IAA)两种激素,设计9种组合(表1),研究激素不同浓度配比对薯块出芽率的影响,筛选出最佳激素浓度配比培养基。
1.2.2 菌液浓度和侵染时间对遗传转化效率的影响 调整工程菌液的OD600值分别达到0.5、0.7、0.9,侵染马铃薯薯块,侵染时间分别为3、5、7 min(表2),培养20 d后统计薯块出芽率和污染率。

表1 薯块再生培养基的激素配比

表2 不同菌液浓度和侵染时间处理组合
1.2.3 共培养时间对遗传转化的影响 将侵染后的薯块共培养1、2、3、4 d后转入分化培养基中培养,20 d后统计薯块出芽率和污染率,确定最佳共培养时间。
1.2.4 脱菌剂浓度对遗传转化的影响 将对数期的农杆菌菌液的OD600调整为0.7,分别接种在含有进口头孢噻肟钠、羧苄青霉素两种抗生素的固体YEB培养基上,设0、150、200、250、300、350 mg·L-16种浓度,接种4 d后观察抗生素的抑菌效果。在有效的最小抑菌浓度下进一步做薯块外植体敏感性试验。共培养后接种到含有抗生素的薯块分化培养基上,20 d后调查薯块出芽率和污染率。
1.2.5 选择压力在芽诱导阶段的影响 将薯块接种到卡那霉素(Kan)浓度分别为0、50、75、100、125、150 mg·L-1的筛选培养基上,20 d后统计薯块出芽率。
1.3 转基因植株的获得
取打破休眠的马铃薯品种东农303的脱毒微型薯,表面消毒,去皮切成大小1 cm2、厚度1~2 mm的薄片,用工程菌液(OD600=0.7)侵染薯块5 min(卢翠华 等,2009),期间轻轻震荡使菌液与薯块充分接触,吸干薯块表层多余菌液后接种到培养基上共培养2 d。共培养结束后转接到含脱菌抗生素的培养基上,7d后将薯块转接到分化培养基上诱导薯块出芽,待不定芽长到1 cm以上时,切下并转入生根培养基上进行生根扩繁。
1.4 转基因植株的检测
1.4.1 转基因植株的PCR检测 采用植物基因组DNA小量快速试剂盒提取马铃薯植株的总DNA,以转基因植株的总DNA为模板,以未转基因植株的总DNA 作阴性对照,pCAMBIA2301质粒作阳性对照。根据BDN1基因序列,设计特异性引物,扩增目的基因。
引物序列:上游引物PⅠ:5'-CCGATTACCAACATCACGAGC-3'下游引物PⅡ:5'-TTGGGATGGTAGCCTGGAAG-3'
使用COMSOL软件进行多物理场耦合计算。采用四面体网格和边界层网格进行网格划分。网格独立性检验如下:对三分支微通道热沉的参数最大热应力σ进行检验,粗化网格、标准网格、细化网格的网格数量分别为105564、265365、422340,粗化网格与标准网格计算下的相对误差为0.42%,细化网格与标准网格计算下的相对误差为0.27%。综合考虑计算精度和计算时间,采用标准网格划分,如图3所示。
1.4.2 转基因植株的Southern-blot检测 质粒DNA的纯化与回收采用小量胶回收试剂盒;探针标记采用随机引物法;用EcoR I酶切经PCR扩增呈阳性的转基因植株的总DNA,将酶切产物在0.8%琼脂糖凝胶上电泳,经变性、中和后用高盐转移法将胶上的样品转移到尼龙膜上,以目的基因BDN1为探针,采用地高辛试剂盒进行杂交、洗膜、显影。
1.4.3 转基因植株的半定量RT-PCR检测 采用通用植物总RNA快速提取试剂盒提取抗性转基因植株的总RNA,反转录所用试剂盒为TaKaRa公司的RNA PCR Kit(AMV)Ver.3.0。以RNA反转录成的cDNA为模板,用BDN1引物进行PCR扩增反应。
1.4.4 转基因植株的生理检测 将Southern-blot杂交阳性植株及对照未转基因植株移栽入网室,转基因植株和对照未转基因植株分别种植2行,行长3 m,行距50 cm,待苗长至15~16片叶时浇足水,取植株倒数第4片叶进行各生理指标的测定,3次重复;然后遮盖防雨棚对其进行干旱处理,持续控水15 d后再取样测定相应生理指标。叶片相对含水量(Leaf Relative Water Content,RWC)参照李合生等(2000)的方法测定;脯氨酸含量、丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性的测定参照张永成和田丰(2007)的方法测定。
2 结果与分析
2.1 遗传转化体系的优化
2.1.1 不同激素浓度配比培养基对薯块再生的影响 由表3可见,当ZT和IAA浓度分别为4.0 mg·L-1和1.0 mg·L-1时,愈伤的诱导率最高,达86.36%,且愈伤组织的质量和状态最好,因此确定薯块再生培养基为M5,即:MS+4.0 mg·L-1ZT+1.0 mg·L-1IAA。
2.1.2 菌液浓度和侵染时间的确定 农杆菌浓度和侵染时间对遗传转化效率影响明显(表4)。当菌液浓度OD600=0.7,侵染时间为5 min时,东农303薯块出芽率为90.91%,污染率为9.09%,因此,确定农杆菌菌株LBA4404侵染薯块的最佳浓度为OD600=0.7,侵染时间为5 min。

表3 不同再生培养基对薯块出芽率的影响
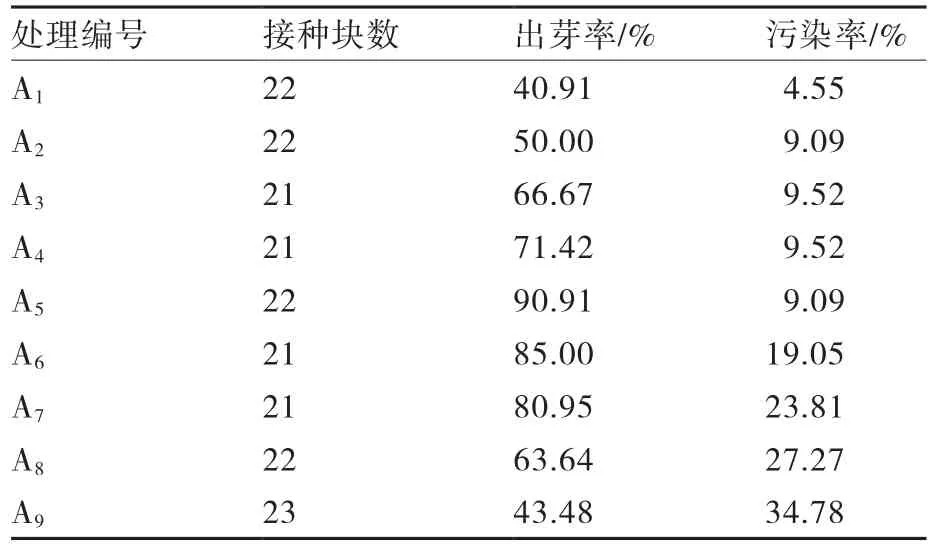
表4 不同侵染条件对遗传转化效率的影响
2.1.3 共培养时间对遗传转化效率的影响薯块与农杆菌共培养的时间对马铃薯遗传转化的影响很大,时间过长或过短都会影响转化效率。共培养2 d,东农303薯块出芽率最高能达到85%,污染率较低仅为10%(图2)。
2.1.4 脱菌剂浓度的确定 在薯块外植体敏感性试验中,分别将2种抗生素以其相应的最小抑菌浓度接种于薯块分化培养基中。由表5可见,羧苄青霉素浓度为300 mg·L-1时,东农303薯块出芽率较低,污染率高;进口头孢噻肟钠浓度为150 mg·L-1时,薯块出芽率为92%,没有污染。因此本试验选用进口头孢噻肟钠作为脱菌剂,浓度为150 mg·L-1。
2.1.5 筛选剂浓度对薯块再生的影响 将薯块接种到 Kan浓度为 0、50、75、100、125和150 mg·L-1的筛选培养基上,20 d后统计出芽率。如表6所示,东农303在Kan浓度为100 mg·L-1时,只有少数薯块分化出芽,出芽率为35.00%。当Kan浓度继续提高时,愈伤组织的诱导被完全抑制,接种的薯块也完全坏死。因此,确定芽诱导阶段Kan浓度为100 mg·L-1。
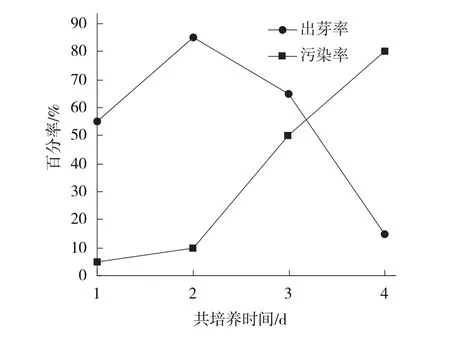
图2 共培养时间对薯块遗传转化效率的影响

表5 不同种类抗生素对薯块遗传转化的影响
2.2 再生植株的分子检测
经过20 d分化培养,共获得35株Kan抗性植株。图3显示了马铃薯薯块遗传转化各阶段的生长情况。经PCR检测27株呈阳性(图4),特异条带长度为700 bp,与目的基因大小一致。进一步的Southern-blot杂交检测4株有杂交信号(图5),初步表明BDN1基因已经整合到马铃薯基因组中。对Southern-blot杂交有杂交信号的4株转基因植株进行总RNA的提取(图6),以RNA反转录成的cDNA为模板用BDN1基因引物进行PCR扩增,结果如图7所示,通过半定量RT-PCR扩增出的目的条带为700 bp,与目的基因大小相吻合,说明BDN1基因能够正常转录表达。

表6 Kan浓度对薯块出芽率及生长状态的影响

图3 马铃薯薯块遗传转化及抗性植株的获得

图4 抗性植株PCR检测

图5 抗性植株Southern-blot检测

图6 抗性植株总RNA电泳

图7 抗性植株BDN1基因表达结果
2.3 再生植株的生理检测
对获得的转基因植株进行了干旱胁迫处理,图8为干旱胁迫下转基因植株和对照的生长及结薯情况。采用SPSS统计分析软件对4项生理指标进行差异显著性分析,由表7可以看出,正常给水条件下,对照和转基因植株的相对含水量、脯氨酸含量、MDA含量和SOD活性差异均不大,在受到干旱胁迫后,转基因植株相对含水量、脯氨酸含量、丙二醛含量和SOD活性均与对照未转基因植株差异显著,这表明在受到干旱胁迫时转BDN1基因植株能够迅速做出反应,具有一定的抗旱能力。

图8 干旱胁迫下转基因植株与对照生长及结薯情况

表7 干旱胁迫下转基因植株生理指标变化情况
3 结论与讨论
由于马铃薯的转化具有很强的基因依赖性,所以即使同一材料的遗传转化,不同的激素配比和其他转化条件也不尽相同。一般认为马铃薯的遗传转化效率受植物的基因型、外植体、激素配比、共培养时间等因素的影响。在进行农杆菌侵染前,茎段和叶片需要进行一定时间的预培养,微型薯则不需要,可直接用于侵染,且微型薯营养物质丰富,农杆菌侵染后易于转化,不经愈伤分化直接由胚性细胞诱导再生植株,因而采用微型薯作为遗传转化的受体材料已成为一种趋势。再生培养基中的激素配比浓度是影响植株再生的关键因素,本试验设计了9种ZT和IAA的不同配比浓度组合,当ZT浓度为4.0 mg·L-1,IAA浓度为1.0 mg·L-1时,薯块再生情况最好。共培养时间是马铃薯遗传转化成功的关键,农杆菌只有在创伤部位生存16 h以上转移过程才能完成。如果共培养时间过长,农杆菌在培养基及受体表面上会过分生长,不利于薯块的存活以及随后抗性愈伤筛选时对农杆菌的抑制。共培养2 d时,薯块出芽率最高达到85%,污染率较低;本试验选用进口头孢噻肟钠作为脱菌剂,用于共培养后抑制农杆菌的生长,在浓度为150 mg·L-1时抑菌效果好,薯块出芽率为92%。在外植体与农杆菌共培养后,如果立即添加Kan进行筛选,则使得大量植物受体细胞在外源基因还未整合到基因组中就受到Kan的毒害,薯块褐化严重甚至死亡。本试验采用延迟7 d的筛选方式,有利于转化细胞的生长,出芽率比较高,但假转化体增多,生根的35株抗性植株中只有4株Southern-blot检测为阳性,经半定量RTPCR检测BDN1基因在马铃薯植株内能够正常表达。
脱水素(dehydrin)是LEA蛋白中的一类,广泛存在于植物的各个组织器官及植物胚胎发育后期。脱水素是植物在受低温、干旱和高盐等非生物逆境胁迫时合成的一类高亲水性保护蛋白,具有保护核酸、胞内蛋白和膜结构免受损害的功能。许多研究已经证实在非生物胁迫下,植物脱水素的表达与积累和植物抗逆性之间存在着紧密的联系。本试验中将脱水素蛋白基因BDN1导入马铃薯中,对获得的马铃薯抗性转基因植株进行干旱胁迫,测定其生理生化指标,综合评定了转基因植株与对照未转基因植株间的抗旱性差异;试验结果表明BDN1基因在马铃薯中有较强的表达,转基因植株的叶片保水能力强,渗透调节物质含量增幅较大,膜脂过氧化程度相对较小,能维持较高水平的酶活性,从而能忍耐一定程度的干旱胁迫。然而对于转基因马铃薯在抗寒、耐盐方面的能力及其后代稳定性等诸多方面的研究还有待于进一步深入。本试验希望将BDN1基因转入马铃薯,培育抗旱马铃薯新品种,从而为提高马铃薯的产量打下基础。
贾晶霞,杨德秋,李建东,李洋.2011.中国与世界马铃薯生产概况对比分析与研究.农业工程,1(2):84-86.
李合生,孙群,赵世杰.2000.植物生理生化实验原理和技术.北京:高等教育出版社:105-109.
柳俊.2011.我国马铃薯产业技术研究现状及展望.中国农业科技导报,13(5):13-18.
卢翠华,邸宏,石瑛,张丽莉,林忠平,胡鸢雷.2009.马铃薯微型薯外植体遗传转化体系的优化.作物杂志,(1):31-34.
邱彩玲,吕典秋,董学志,魏琪,刘尚武,王绍鹏,宿飞飞,李勇,白艳菊.2011.我国在防治马铃薯类病毒病中存在的问题及防治对策.东北农业大学学报,42(10):140-144.
王君丹,胡鸢雷,魏晓,王鹏之,车代弟,林忠平.2004.脱水素基因转化的矮牵牛对干旱胁迫的反应.分子植物育种,2(3):369-374.
张永成,田丰.2007.马铃薯试验研究方法.北京:中国农业科技出版社:232-238.
赵恢武,刘晗,于海源,胡鸢雷,高音,林忠平,李振宇.2000.耐旱植物厚叶旋蒴苣苔BDN1脱水素基因的克隆及表达特性分析.科学通报,45(15):1648-1654.
FAOSTAT.2009.http://faostat.Fao.org/site/567/default.Aspx.
ZHAO Huiwu,LIU Han,YU Haiyuan,HU Yuanlei,GAO Yin,LI Zhengyu,LIN Zhongping.2000.Cloning and expression pattern of a dehydrin-likeBDN1gene from drought-tolerantBoea crassifoliaHemsl.Chinese Science Bulletin,45(22):2072-2077.

