2 种蛋白水平的饲料循环投喂对奥尼罗非鱼幼鱼生长、体成分和血清生化指标的影响
刘 伟,文 华,蒋 明,吴 凡,田 娟,杨长庚
(中国水产科学研究院 长江水产研究所,农业部淡水生物多样性保护与利用重点开放实验室,湖北 武汉 430223)
饲料中的蛋白质是影响鱼类生长和饲料成本的主要因素[1].在满足鱼类生长的同时,为降低饲料中的蛋白使用量,节约饲料成本,不仅需要考虑鱼类的营养需求,饲料的配方技术、加工工艺等因素,还需要利用科学合理的投喂技术.在鲤鱼Cyprinus carpio[2-3],苏氏芒鲶Pangasius hypophthalmus[4-5],虹鳟Oncorhynchus mykiss[6]的养殖过程中,利用不同蛋白水平的饲料循环投喂的方式,可以有效地降低饲料蛋白的用量,节省养殖费用.Ali 等[4]认为这与鱼类对饲料的消化吸收存在一种表观的周期性变化(Apparent cyclic pattern)有关,如尼罗罗非鱼Oreochromis niloticus 对饲料存在1~2 d 高消化率接着1 d 低消化率的周期变化[7].在对罗非鱼的研究中发现,采用投喂与饥饿循环的方式,罗非鱼的生长受阻[8-10].而采用合适的循环投喂高、低蛋白水平饲料的方式,罗非鱼的生长可以与持续投喂高蛋白水平饲料的表现类似,甚至更优,并使得饲料利用率增加,蛋白的用量减少,养殖成本降低[11-13],但这些研究的对象主要为尼罗罗非鱼,且饲料中鱼粉的用量较高(>10%),在实际生产中,因鱼粉的价格相对较高,罗非鱼饲料中主要使用植物蛋白.饲料中使用适量的植物蛋白可以使鱼类处于相对较好的生理状态,使用过多会对罗非鱼的生长及饲料利用产生拮抗作用[14-15],影响其健康状况[16].奥尼罗非鱼Oreochromis niloticus× O.aureus♀是以奥利亚罗非鱼Oreochromis aureus 为父本与尼罗罗非鱼为母本进行杂交,获得的杂交子一代.它在雄性率,生长、产量、抗寒、起捕率等主要经济性状方面具有明显的杂种优势[17],是我国罗非鱼的主养品系之一.本试验以植物蛋白源为主配制了2 种蛋白水平的饲料,采用循环投喂的方式,研究对奥尼罗非鱼幼鱼生长性能、饲料利用效率、体组成和血清指标的影响,旨在为奥尼罗非鱼养殖过程中的投喂技术提供参考.
1 材料与方法
1.1 试验鱼
奥尼罗非鱼幼鱼源自广东省罗非鱼原良种场.试验用鱼运回后先暂养于养殖池中,药浴消毒,并用商品饲料驯养2 周,使其适应试验条件.挑选大小均匀的试验鱼,随机放至21 个直径1 m,高0.5 m 的圆柱形玻璃钢桶内(有效体积为300 L),每桶30 尾.试验开始时鱼的初始体质量(3.10±0.05)g.
1.2 试验饲料
以大豆粕、花生粕、菜粕、棉粕、鱼粉、次粉、米糠等为原料,配制2 组蛋白水平分别为27.49%(以下简称a)和20.55%(以下简称b)的饲料,配方见表1.将各种原料粉碎,过60 目筛,称质量后充分混匀,利用小型绞肉机制成直径为2 mm 的成品饲料,自然风干,破碎后,置于-20℃冰箱中储藏备用.
1.3 试验设计和饲养管理
试验共设7 种投喂方式:(1)连续投喂a(A组);(2)连续投喂b(B 组);(3)1 d 投喂a 接着1 d投喂b(1A/1B 组);(4)2 d 投喂a 接着2 d 投喂b(2A/2B 组);(5)2 d 投喂a 接着3 d 投喂b(2A/3B组);(6)3 d 投喂a 接着2 d 投喂b(3A/2B 组);(7)3 d 投喂a 接着3 d 投喂b(3A/3B 组).每种投喂方式设3 个平行试验组.试验持续60 d.日投喂量为体质量的5%~6%,每天于8:00、12:00 和17:00 投喂3 次.每2 周称鱼体质量1 次,以调整投喂量.水源为沉淀过滤后的湖水,水量保持在1~2 L·min-1,增氧泵连续充气增氧.试验期间水温为(28.6±0.7)℃,pH 值为7.3±0.3,溶解氧为(6.20±0.60)mg·L-1,氨氮为(0.060±0.007)mg·L-1.

表1 饲料配方及营养组成Tab.1 Formulation and nutrient composition of the diets
1.4 样品制备、分析和指标计算
试验结束后,禁食24 h,麻醉(MS-222,150 mg·L-1)后,对每桶试验鱼进行记数和称体质量.每桶随机取鱼6 尾,于尾静脉取血,4℃冰箱内静置2 h,以3 000 r·min-1离心15 min,得到空腹血清,保存于-20℃冰箱中;每桶随机取鱼3 尾,测量体长和体质量,取肝脏、内脏称质量;每桶随机取鱼3 尾,保存于-20℃冰箱中,用于测定营养成分.
采用直接干燥法测定水分含量(GB/T 5009.3—2003),凯氏定氮法测定粗蛋白质含量(GB/T 5009.5—2003),索氏抽提法测定粗脂肪含量(GB/T 5009.6—2003),灼烧称重法测定灰分含量(GB/T 5009.4—2003),过滤法测定粗纤维含量(GB/T 6434—2006).使用日本希森美康(CHEMIX-800)全自动生化分析仪测定血清指标.其余各指标的计算公式如下:
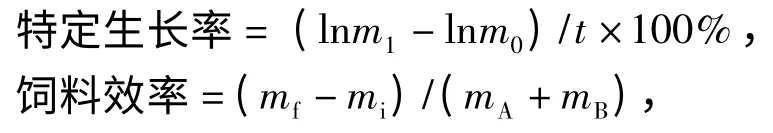

其中,t 为试验时间(d),m0和m1分别为试验鱼的初、末均体质量(g),mi和mf分别为试验鱼的初、末总体质量(g),mA和mB分别为投喂饲料a、饲料b总质量(g),wPA、wPB、wPf和wPi分别为为饲料a、饲料b、初始、终末鱼体的粗蛋白质量分数(%),Ni和Nf分别为试验结束后和开始时鱼的尾数;mH、mV和m分别为肝胰脏、内脏质量和体质量(g),CA和CB为饲料a 和b 的成本(元·kg-1).
1.5 统计方法
试验结果用平均数± 标准差表示,经One-way ANOVA 方差分析,Duncan's 多重比较法分析试验结果的差异显著性.所有统计分析均采用STATISTICA 6.0 软件.
2 结果
2.1 生长性能和饲料利用
循环投喂对奥尼罗非鱼幼鱼生长性能和饲料利用的影响见表2.其中,B 组的末均体质量和特定生长率显著低于其他组(P<0.05);1A/1B、2A/3B、3A/2B 组的末均体质量和特定生长率与A 组差异不显著(P>0.05).其他各组较A 组饲料效率无显著差异(P>0.05);除2A/2B 组外,各组的蛋白质效率均高于A 组(P<0.05);除2A/2B、3A/3B 组外,各组的蛋白质沉积率均高于A 组(P<0.05).2A/2B 组的肝体比与1A/1B 组差异不显著(P>0.05),但显著高于其他组(P<0.05);A、3A/2B 和3A/3B 组的脏体比显著低于其他组(P<0.05).除1A/1B 外,各组间成活率差异不显著(P>0.05).1A/1B、2A/3B、3A/2B 和3A/3B组的养殖成本显著低于A 组(P<0.05).
2.2 全鱼成分
各组全鱼的营养成分见表3.A 组全鱼的水分与2A/2B、3A/3B 的差异不显著(P>0.05),显著高于其他组(P<0.05).B 组全鱼的粗蛋白含量最低,显著低于A、2A/2B 和3A/2B 组(P>0.05).B 组的粗脂肪含量最高,各组均显著高于A 组(P<0.05).各组间全鱼的粗灰分含量无显著差异(P>0.05).

表2 循环投喂对奥尼罗非鱼幼鱼生长性能和饲料利用的影响1)Tab.2 Effects of mixed feeding schedules on growth performances and feed ultilization of juvenile hybrid tilapia

表3 循环投喂对奥尼罗非鱼幼鱼全鱼成分的影响1)Tab.3 Effects of mixed feeding schedules on whole body composition of juvenile hybrid tilapia %
2.3 血清指标
由表4 可见,与A 组相比,循环投喂组的血清谷草转氨酶(AST)和谷丙转氨酶(ALT)活性降低,白蛋白、球蛋白和总蛋白水平升高,总胆固醇、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDLC)含量增加.其中,A 组的AST 活性与3A/3B 组差异不显著(P>0.05),但显著高于其他组(P<0.05);3A/2B、3A/3B 和1A/1B 组的ALT 活性显著低于A 组(P<0.05);3A/2B、3A/3B 组的白蛋白、球蛋白、总蛋白与A 组差异不显著(P>0.05),而1A/1B、2A/2B 和2A/3B 组显著高于A、B 组(P ﹤0.05).B、2A/3B 和3A/2B 组的胆固醇含量显著高于A 组(P<0.05);A 和3A/3B 组的HDL-C 含量显著低于其他组(P<0.05),而B、1A/1B 和2A/2B 组的HDL-C 显著低于2A/3B、3A/2B 组(P<0.05);1A/1B 和2A/3B 组的LDL-C 含量显著高于A、B 和3A/3B 组(P<0.05),1A/1B,2A/2B 的三酰甘油含量显著高于其他组(P<0.05).

表4 循环投喂对奥尼罗非鱼幼鱼血清生化指标的影响1)Tab.4 Effects of mixed feeding schedules on serum biochemical indexes of juvenile hybrid tilapia
3 讨论与结论
3.1 循环投喂对奥尼罗非鱼幼鱼生长性能和饲料利用的影响
研究表明,奥尼罗非鱼幼鱼对饲料蛋白质的需要量为24%~32%[18-20].因此,a 饲料的粗蛋白含量(27.49%)是适合奥尼罗非鱼生长的.本试验的结果发现,1A/1B、2A/3B 和3A/2B 3 组的特定生长率与A 组无显著差别,蛋白质效率、蛋白沉积率显著提高,养殖成本显著降低,表明不同蛋白水平饲料循环投喂的方式对于减少奥尼罗非鱼养殖过程中的蛋白使用量,降低养殖成本是有效的.但也发现,1A/1B组的成活率较低,这可能是频繁更换饲料引起了罗非鱼的应激反应,导致免疫力降低[21],造成死亡率偏高;2A/3B 组鱼的脏体比显著高于A 组,表明此种投喂方式使营养物质在内脏中过多地积累,同时内脏比例的升高,也会造成可食部分的减少.而3A/2B 组鱼的以上指标均表现出相对良好的结果,说明3A/2B组的投喂方式在本试验中是最佳的.
Silva 等[11]研究指出,投喂粗蛋白质量分数为30%的饲料2 d,随后投喂粗蛋白质量分数为18%的饲料3 d(2 d 30%/3 d 18%),尼罗罗非鱼(190~595 mg 和1.043~4.068 g)获得的生长性能和饲料利用效率最佳;在半精养池塘的试验中,也发现采用2 d 33%/3 d 22%的方式投喂尼罗罗非鱼(33~153 g),其生长表现最佳[13].而Santiago 等[12]发现以粗蛋白质量分数为25%和18%的饲料循环投喂尼罗罗非鱼,仅影响到雌性(20~233 g)的生长,对雄性(20~266 g)则无显著影响,若以饲料利用效率来评价,则3 d 25%/2 d 18%和1 d 25%/1 d 18%的投喂方式较好,对于莫尼罗非鱼(17~250 g)的研究则认为3 d 35%/3 d 25%的投喂方式最优[22].在对鲤鱼的研究中发现,1 d 30%/1 d 20%和3 d 30%/3 d 20%的投喂方式与持续投喂粗蛋白质量分数为30%的饲料相比,生长表现类似[3],而Nandeesha 等[2]利用2 d 30.9%/2 d 25.8%的投喂方式,得出鲤鱼的生长性能和饲料利用效率要优于持续投喂30.9%的.造成这些差异的原因可能与饲料配方、饲养条件、鱼的种类及生长阶段等因素不同有关.
3.2 循环投喂对奥尼罗非鱼幼鱼的体成分和血清指标的影响
在本试验中,B 组全鱼的粗蛋白含量最低,这可能与低蛋白饲料不利于罗非鱼合成体蛋白[23]有关;其余各组全鱼粗蛋白含量无显著差异,表明循环投喂没有影响到鱼体蛋白合成.鱼类可以利用饲料中的脂肪、碳水化合物和蛋白合成脂肪[24],在本试验中各组投喂饲料的脂肪和蛋白含量均低于A 组,而碳水化合物含量均高于A 组,结果发现全鱼粗脂肪含量均显著高于A 组,这与对尼罗罗非鱼[11]和奥尼罗非鱼[25]的研究结果类似,说明鱼体粗脂肪的增加可能主要是由饲料碳水化合物水平升高引起的.
肝脏是鱼类的重要器官.一般认为,血清中转氨酶的活性很低,其活性的升高是肝脏受损的表现[26-27],但本试验中发现循环投喂组中鱼的血清转氨酶活性相对于A 组均有不同程度的降低,表明鱼的肝脏是正常的,而血清白蛋白、球蛋白和总蛋白的升高,表明奥尼罗非鱼加强了蛋白质的合成与运转,从而在血清蛋白中出现了较多的蛋白质组分[28].血脂包括三酰甘油和胆固醇,它们的来源有外源性的,即从饲料中摄取并经过消化道进入血液中;还有内源性的,即由肝脏、脂肪组织和其他组织合成而来[29].鱼类可以利用碳水化合物合成脂肪[30],且三酰甘油和胆固醇的主要合成部位为肝脏[31-32],并经血液转运至全身各处[30].本试验的结果发现,循环投喂组的血脂水平较高,也间接地表明鱼类利用碳水化合物合成脂类的能力增强.
在本试验条件下,采用3A/2B 组的投喂方式,并未影响奥尼罗非鱼幼鱼肝脏的正常生理机能,同时对碳水化合物的利用能力增强,可以取得最佳的生长性能、最优的饲料利用效率和最低的饲料成本.
[1]AI Qinghui,MAI Kangsen,LI Huitao,et al.Effects of dietary protein to energy ratios on growth and body composition of juvenile Japanese seabass,Lateolabrax japonicus[J].Aquaculture,2004,230(1):507-516.
[2]NANDEESHA M C,GANGADHARA B,MANISSERY J K.Further studies on the use of mixed feeding schedules with plant-and animal-based diets for common carp Cyprinus carpio (Linnaeus)[J].Aquac Res,2002,33(14):1157-1162.
[3]SARDAR P,SINHA A,DATTA S.Effect of mixed feeding schedules with varying dietary protein levels on the growth performances of common carp (Cyprinus carpio Linn.)[J].Indian J Anim Sci,2011,81(5):537-542.
[4]ALI M Z,HOSSAIN M A,ABDUL M M.Effect of mixed feeding schedules with varying dietary protein levels on the growth of sutchi catfish,Pangasius hypophthalmus (Sauvage)with silver carp,Hypophthalmichthys molitrix (Valenciennes)in ponds[J].Aquac Res,2005,36(7):627-634.
[5]HOSSAIN M A,ALI M Z,ABDUL M M,et al.Evaluation of mixed-feeding schedules with varying dietary protein content on the growth performance and reduction of cost of production for sutchi catfish,Pangasius hypophthalmus (Sauvage)with silver carp,Hypophthalmichthys molitrix (Valenciennes)[J].J Appl Aquac,2006,18(1):63-78.
[6]SEVGILI H,EMRE Y,KANYILMAZ M,et al.Effects of mixed feeding schedules on growth performance,body composition,and nitrogen-and phosphorus balance in rainbow trout,Oncorhynchus mykiss[J].Acta Ichthyol Piscat,2006,36(1):49-55.
[7]DE SILVA S S,PERERA M K.Digestibility in Sarotherodon niloticus fry:Effect of dietary protein level and salinity with further observations on variability in daily digestibility[J].Aquaculture,1984,38(4):293-306.
[8]WANG Yan,LI Cui,QIN J G,et al.Cyclical feed deprivation and refeeding fails to enhance compensatory growth in Nile tilapia,Oreochromis niloticus L.[J].Aquac Res,2009,40(2):204-210.
[9]CHRISTENSEN S M,MCLEAN E.Compensatory growth in Mozambique tilapia (Oreochromis mossambicus),fed a sub-optimal diet[J].Croat J Fisheries,1998.56(1):3-19.
[10]李程琼,冯健,刘永坚,等.奥尼罗非鱼多重周期饥饿后的补偿生长[J].中山大学学报:自然科学版,2005,44(4):99-102.
[11]DE SILVA S S.Performance of Oreochromis niloticus(L.)fry maintained on mixed feeding schedules of differing protein content [J].Aquac Res,1985,16(4):331-340.
[12]SANTIAGO C B,LARON M A.Growth and fry production of Nile tilapia,Oreochromis niloticus (L.),on different feeding schedules[J].Aquac Res,2002,33(2):129-136.
[13]PATEL A B,AMARARATNE Y.Mixed feeding schedules in semi-intensive pond culture of Nile tilapia,Oreochromis niloticus,L.:Is it necessary to have two diets of differing protein contents?[J].Aquac Res,2003,34 (14):1343-1352.
[14]刘勇,冷向军,李小勤,等.豆粕替代鱼粉对奥尼罗非鱼生长,表观消化率及血清非特异性免疫的影响[J].中国粮油学报,2009,24(12):95-100.
[15]EL-SAIDY D M S D,GABER M M A.Replacement of fish meal with a mixture of different plant protein sources in juvenile Nile tilapia,Oreochromis niloticus (L.)diets[J].Aquac Res,2003.34(13):1119-1127.
[16]艾庆辉,谢小军.水生动物对植物蛋白源利用的研究进展[J].中国海洋大学学报:自然科学版,2005,35(6):929-935.
[17]王楚松,夏德全,胡玫,等.奥尼鱼(Oreochromis niloticus♀× O.aureus)杂种优势利用的研究[J].淡水渔业,1989(6):14-15.
[18]TWIBELL R G,BROWN P B.Optimal dietary protein concentration for hybrid tilapia Oreochromis niloticus× O.aureus fed all-plant diets [J].J World Aquacult Soc,1998,29(1):9-16.
[19]SHIAU S Y,HUANG S L.Optimal dietary protein level for hybrid tilapia (Oreochromis niloticus× O.aureus)reared in seawater [J].Aquaculture,1989,81(2):119-127.
[20]LUQUET P.Practical considerations on the protein nutrition and feeding of tilapia [J].Aquat Living Resour,1989,2:99-101.
[21]ENDO M,KUMAHARA C,YOSHIDA T,et al.Reduced stress and increased immune responses in Nile tilapia kept under self-feeding conditions [J].Fisheries Sci,2002,68(2):253-257.
[22]FATAN N A,HASHIMA R,CHONG A S C,et al.Enhancement of monosex hybrid red tilapia,Oreochromis mossambicus× O.niloticus production in portable canvas tanks through mixed-feeding strategies [J].J Appl Aquac,2005,17(4):99-111.
[23]BAHNASAWY M H.Effect of dietary protein levels on growth performance and body composition of monosex nile tilapia,Oreochromis niloticus L.reared in fertilized tanks[J].Pakistan J Nutr,2009,8(5):674-678.
[24]梁洪,钱云霞.食物对养殖鱼类脂肪代谢的影响[J].水产科学,2007,26(9):521-524.
[25]吴凡,文华,蒋明,等.饲料碳水化合物水平对奥尼罗非鱼幼鱼生长,体成分和血清生化指标的影响[J].华南农业大学学报,2011,32(4):91-95.
[26]OLUAH N S.Plasma aspartate aminotransferase activity in the catfish Clarias albopunctatus exposed to sublethal zinc and mercury[J].B Environ Contam Tox,1999,63(3):343-349.
[27]CHIEN Yewhu,PAN Chihhu,HUNTER B.The resistance to physical stresses by Penaeus monodon juveniles fed diets supplemented with astaxanthin [J].Aquaculture,2003,216(1/4):177-191.
[28]RAO V Y,DAS B K,JYOTYRMAYEE P,et al.Effect of Achyranthes aspera on the immunity and survival of Labeo rohita infected with Aeromonas hydrophila[J].Fish Shellfish Immun,2006,20(3):263-273.
[29]周顺武.动物生物化学[M].北京:中国农业出版社,1999:117-146.
[30]SHERIDAN M A.Lipid dynamics in fish:Aspects of absorption,transportation,deposition and mobilization[J].Comp Biochem Phys:B,1988,90 (4):679-690.
[31]GREENE D H,SELIVONCHICK D P.Lipid metabolism in fish[J].Prog Lipid Res,1987,26(1):53-85.
[32]王镜岩,朱圣庚,徐长法.生物化学:下册[M].3 版.北京:高等教育出版社,2002:257-298.

