低温胁迫下脱落酸及合成抑制剂对甘蔗幼苗抗氧化系统的影响
黄 杏 ,梁勇生 ,杨丽涛 ,陈荣发,李杨瑞
(1 中国农业科学院 甘蔗研究中心,广西农业科学院 甘蔗研究所,农业部广西甘蔗生物技术与遗传改良重点实验室,广西甘蔗遗传改良重点实验室,广西 南宁 530007;2 广西大学 农学院,亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004;3 南宁市蔬菜研究所,广西 南宁 530021)

1 材料与方法
1.1 材料
甘蔗品种为桂糖28 号,由广西农业科学院甘蔗研究所提供.
1.2 甘蔗培养及取样
试验于2011年6—12月在广西大学农学院甘蔗智能温室大棚进行.将桂糖28 号单芽种茎脱毒处理后放进沙盘中进行沙培.培养3 周后,选取长势一致植株移栽至Hoagland 营养液中(pH6.0),水培桶规格为25 cm×30 cm(直径×高),每桶5 株,每桶装营养液5 L,每3 d 换1 次营养液,为防止根系缺氧,使用充气泵每隔1 h 充气1 次,每次10 min.在智能温室大棚中(20~30℃)水培1 个月,待甘蔗苗长至5~6 叶时分组进行低温处理.处理如下:①低温处理(对照)组;②低温+100 μmol/L ABA 处理组;③低温+5 mmol/L 钨酸钠处理组.ABA 及钨酸钠喷施在低温胁迫前12 h 进行,低温处理组喷清水作对照,喷施程度以叶面喷施欲滴为度.低温胁迫时,温度为0℃,光强为250~300 μmol·m-2·s-1,12 h 光周期,相对湿度60%~70%.分别于低温处理后0、24、48、72 h 采集甘蔗幼苗叶样(+1 叶)及幼嫩根系分装速冻于液氮中,后存于-80℃冰箱中,供测定相关生理指标用.
1.3 测定项目与方法

1.4 数据分析
采用SPSS 15.0 软件进行数据方差分析,采用LSD 法进行显著性检验,用Excel 2007 进行数据计算和作图.
2 结果与分析
2.1 低温胁迫下ABA 及合成抑制剂对甘蔗幼苗ABA 和MDA 含量的影响
由图1A 和1B 可知,低温胁迫下,甘蔗叶片中ABA 含量呈上升趋势,根系ABA 含量先升高后降低,叶片ABA 含量高于根系.与低温处理相比,低温+ABA 处理显著提高了甘蔗叶片和根系中ABA的含量,处理0~72 h 叶片中分别提高了11.9%、23.0%、24.4%、20.4%,根系中分别提高了16.3%、19.3%、20.8%、28.3%;低温+ 钨酸钠处理则显著降低了甘蔗叶片和根系中ABA 含量,在处理72 h后,根系和叶片中降幅分别为18.0%和15.3%.说明外喷ABA 促进了低温胁迫下ABA 含量的提高,而外喷钨酸钠则抑制了内源ABA 的合成.

图1 低温胁迫下ABA 和钨酸钠对甘蔗幼苗ABA 和MDA 含量的影响Fig.1 Effects of ABA and sodium tungstate on ABA and MDA content in sugarcane seedlings under cold stress
MDA 是膜脂过氧化作用的最终产物,能够影响细胞膜结构的稳定,干扰正常生理代谢.从图1C 和1D 可以看出,低温胁迫下,甘蔗叶片和根系中MDA含量呈上升趋势,同一处理下叶片中MDA 含量高于根系.与低温处理相比,低温+ABA 处理降低了甘蔗叶片和根系中的MDA 含量,处理0~72 h 叶片中降幅分别为2.6%、13.7%、14.7%、15.8%,根系中降幅分别为21.6%、10.4%、13.2%、16.7%;低温+钨酸钠处理与对照相比,则明显提高了甘蔗叶片和根系中MDA 含量;在处理0~72 h,叶片中增幅分别为10.8%、10.3%、9.5%、6.7%,根系中增幅分别为9.2%、10.9%、11.7%、12.8%.说明外喷ABA 处理减少了低温胁迫下膜脂过氧化程度,外喷钨酸钠处理则加剧了膜脂过氧化程度.
2.2 低温胁迫下ABA 及合成抑制剂对甘蔗幼苗产生速率的影响
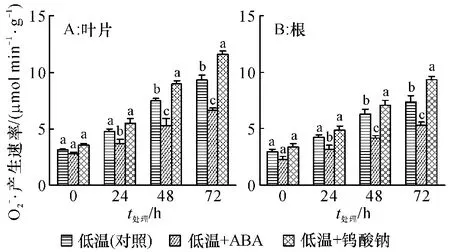
图2 低温胁迫下ABA 和钨酸钠对甘蔗幼苗产生速率的影响Fig.2 Effects of ABA and sodium tungstate on production rate of in sugarcane seedlings under cold stress
2.3 低温胁迫下ABA 及合成抑制剂对甘蔗幼苗H2O2含量的影响
H2O2是ROS 自由基之一,具有很强的氧化作用,它的积累会造成植物毒害.图3 显示,低温胁迫下,甘蔗叶片和根系中H2O2含量均呈上升趋势,但叶片的上升幅度较为平缓.与低温(对照)相比,低温+ABA 处理显著降低了甘蔗叶片和根系中H2O2含量,处理72 h 时,叶片和根系中的降幅分别为16.4%和19.7%;低温+钨酸钠处理提高了甘蔗叶片和根系中H2O2含量,处理72 h 时,叶片和根系中的增幅分别为20.2%和35.9%,差异显著.说明随着低温胁迫时间的延长,甘蔗体内积累了大量H2O2且未能及时被清除,甘蔗受到毒害,正常生理代谢被干扰.

图3 低温胁迫下ABA 和钨酸钠对甘蔗幼苗H2O2含量的影响Fig.3 Effects of ABA and sodium tungstate on H2O2content in sugarcane seedlings under cold stress
2.4 低温胁迫下ABA 及合成抑制剂对甘蔗幼苗酶活性的影响
2.4.1 CAT 活性 CAT 是植物体内分解、清除H2O2的重要保护酶类.由图4A 和4B 可知,低温胁迫下,甘蔗幼苗叶片中CAT 活性呈先升高后降低的趋势,低温处理48 h 达到最高;甘蔗根系中的CAT活性也呈逐渐上升趋势,同一处理下,叶片中的CAT活性要高于根系.与低温处理相比,低温+ABA 处理明显提高了甘蔗叶片和根系中的CAT 活性,处理48 h 时,叶片中CAT 活性提高了18.7%,根系中CAT活性提高了7.4%.低温+钨酸钠处理与对照比则显著降低了甘蔗叶片和根系中CAT 的活性,低温胁迫48 h 叶片和根系中CAT 活性分别降低了14.8%和16.9%.
2.4.2 POD 活性 从图4C 和4D 可看出,低温胁迫下,甘蔗叶片和根系中POD 活性均呈先升高后降低的趋势,并在低温胁迫48 h 达到最大;根系中的POD活性要高于叶片.与低温处理相比,低温+ABA 处理明显提高了甘蔗叶片和根系中的POD 活性,低温胁迫48 h 叶片和根系中POD 活性增幅分别为15.4%和15.5%,差异显著;低温+钨酸钠处理显著降低了甘蔗叶片和根系中POD 活性,在低温胁迫48 h,叶片和根系中POD 活性降幅分别为5.3%和18.6%.
2.4.3 SOD 活性 SOD 是植物体内最重要的防御活性氧伤害的酶类之一,它可以缓解逆境对植株造成的伤害.低温胁迫下,甘蔗叶片和根系中SOD 活性呈先升高后下降的趋势,并在低温处理24 h 时,达到最大(图4E 和4F).与低温处理相比,低温+ABA 处理显著提高了甘蔗叶片和根系中的SOD 活性,处理0~72 h 叶片中SOD 活性分别提高了21.3%、52.3%、36.8%、44.9%,根系中SOD 活性分别提高了19.2%、43.2%、74.6%、33.9%.低温+钨酸钠处理较对照显著降低了甘蔗叶片和根系中SOD 活性,处理0~72 h 叶片中分别降低了25.3%、23.7%、32.3%、18.4%,根系中分别降低了14.0%、24.8%、20.2%、25.6%.
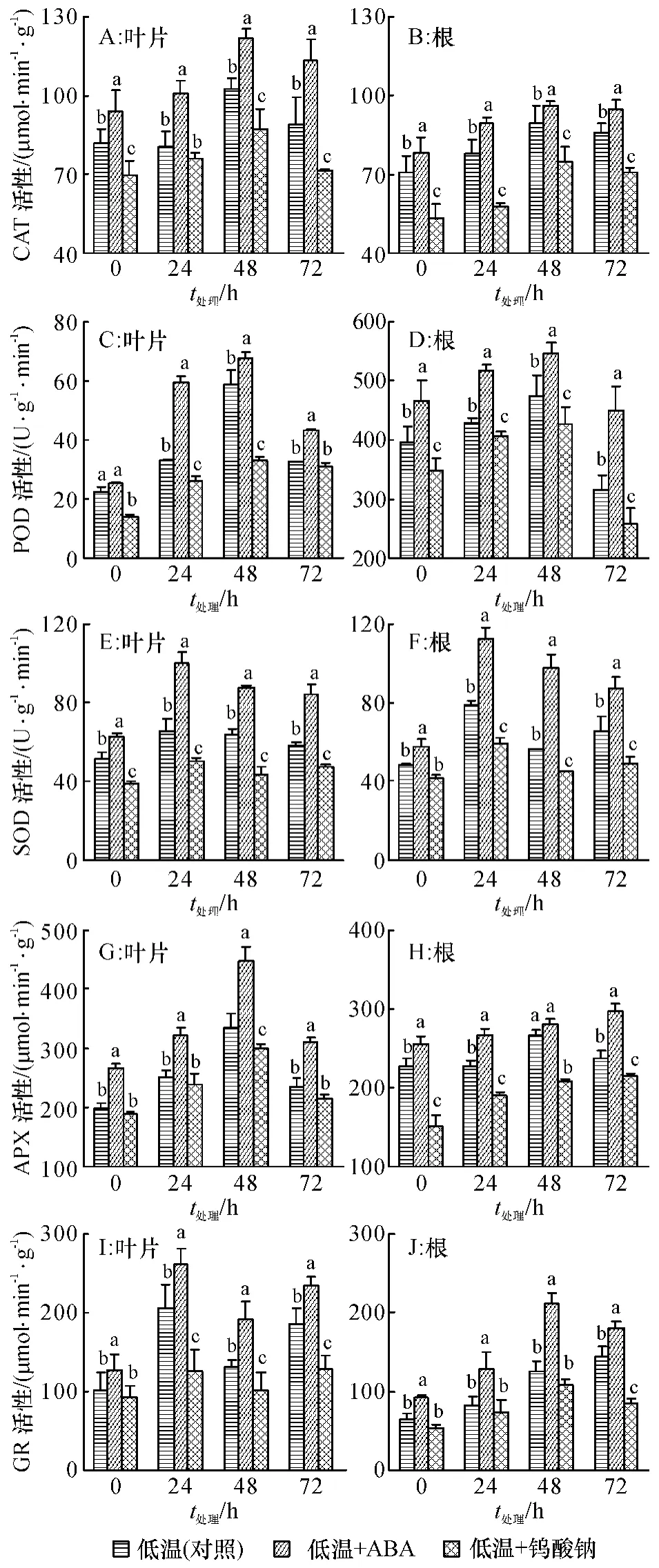
图4 低温胁迫下ABA 和钨酸钠对甘蔗幼苗酶活性的影响Fig.4 Effects of ABA and sodium tungstate on activity of enzymes in sugarcane seedlings under cold stress
2.4.4 APX 活性 APX 是植物中尤其是叶绿体中清除H2O2的关键酶.图4G 和4H 表明,低温胁迫下,甘蔗叶片中APX 活性呈先升高后下降的趋势,在低温胁迫48 h 达到最大;根系中4 个处理时间的APX 活性变化不大一致,低温+ABA 和低温+钨酸钠处理表现为逐渐上升趋势,低温处理则呈降-升-降趋势.相比之下,根系中APX 活性要低于叶片.与低温处理相比,低温加ABA 处理明显提高了甘蔗叶片和根系中APX 活性,处理48 h 叶片和根系中的增幅分别为33.9%和7.3%.与对照组相比低温+钨酸钠处理降低了甘蔗根系和叶片中的APX 活性,在低温处理48 h 时,降幅分别为7.8%和20.2%.
2.4.5 GR 活性 由图4I 和4J 可知,低温+ ABA处理,甘蔗叶片中GR 活性呈升-降-升变化;根系中的GR 活性则是先升高后降低,在处理48 h 时达到最高.与低温(对照)相比,低温+ABA 处理后显著提高了甘蔗叶片和根系中GR 活性,在低温胁迫48 h 时,叶片和根系中GR 活性分别提高了46.3%和69.8%.低温+钨酸钠处理与对照比则降低了叶片和根系中GR 活性,处理0~72 h 叶片中分别降低了13.5%、39.0%、22.4%、30.5%,根系中分别降低了18.2%、8.7%、13.2%、40.2%.
3 讨论
ABA 作为一种胁迫激素,在植物抵御低温胁迫中起着重要的作用.逆境胁迫下植物体内的ABA 含量增加,而外施ABA 处理能进一步促进其在植株内的合成,使其含量处于更高水平[20-21].本研究中,甘蔗幼苗经低温胁迫后,内源ABA 含量比胁迫前明显提高,外施ABA 后也进一步增加了甘蔗幼苗叶片和根系中的ABA 含量.钨酸钠是一种ABA 合成抑制剂,它可以抑制ABA 合成过程中的醛氧化酶(AO),使ABA 醛不能转化为ABA,从而抑制ABA 的生物合成[7].周碧燕等[22]在对柱花草的抗冷性研究中发现,低温胁迫下,同时喷施ABA 和钨酸钠处理后,柱花草体内ABA 含量下降;只喷钨酸钠处理时,低温引起的ABA 积累效应被消除,与本试验结果相一致.说明外喷钨酸钠处理通过抑制ABA 的生物合成,降低了植物体内的ABA 水平.

[1]THOMASHOW M F.Plant cold accliamtion:Freezing tolerance genes and regulatory mechanisms[J].Annu Rev Plant Physiol Plant Mol Biol,1999,50:571-599.
[2]李素丽,李志刚,杨丽涛,等.低温对不同冷敏感甘蔗品种根系一些处理指标的影响[J].华南农业大学学报,2012,33(2):178-182.
[3]ANDERSON M D,PRASAD T K,MARTIN B A,et al.Differential gene expression in chilling-acclimated maize seedlings and evidence for the involvement of abscisic acid in chilling tolerance[J].Plant Physiol,1994,105:331-339.
[4]HU X,JIANG M,ZHANG J,et al.Calcium-calmodulin is required for abscisic acid-induced antioxidant defense and functions both upstream and downstream of H2O2production in leaves of maize (Zea mays)plants[J].New phytol,2007,173(1):27-38.
[5]JIANG M Y,ZHANG J H.Involvement of plasma-membrane NADPH oxidase in abscisic acid-and water stressinduced antioxidant defense in leaves of maize seedlings[J].Planta,2002,215(6):1022-1030.
[6]许树成,丁海东,鲁锐,等.ABA 在植物细胞抗氧化防护过程中的作用[J].中国农业大学学报,2008,13(2):11-19.
[7]HANSEN H,GROSSMANN K.Auxin-induced ethylene triggers abscisic acid biosynthesis and growth inhibition[J].Plant Physiol,2000,124(3):1437-1448.
[8]JIANG Mingyi,ZHANG Jianhua.Role of abscisic acid in water stress-induced antioxidant defense in leaves of maize seedlings[J].Free Rad Res,2002,36(9):1001-1015.
[9]BELLAIRE B A,CARMODY J,BRAUD J,et al.Involvement of abscisic acid-dependent and independent pathways in the upregulation of antioxidant enzyme activity during NaCl stress in cotton callus tissue[J].Free Rad Res,2000,33(5):531-545.
[10]李宗霆,周燮.植物激素及其免疫检测技术[M].南京:江苏科学技术出版社,1996.
[11]LI Q,LI P,SUN L,et al.Expression analysis of β-glucosidase genes that regulate abscisic acid homeostasis during watermelon (Citrullus lanatus)development and under stress conditions[J].Plant Physiol,2012,169(1):78-85.
[12]赵世杰,刘华山,董新纯.植物生理学实验指导[M].北京:中国农业科学技术出版社,1998:120-164.
[13]郝建军,刘延吉.植物生理学实验技术[M].2 版.沈阳:辽宁科学技术出版社,2001:187-189.
[14]BRENNAN T,FRENKEL C.Involvement of hydrogen peroxide in the regulation of senescence in pear[J].Plant Physiol,1977,59:411-416.
[15]CHANCE B,MAEHLY A C.Assay of catalase and peroxidase[J].Methods Enzymol,1955,12:764-775.
[16]陈建勋,王晓峰.植物生理学实验指导[M].2 版.广州:华南理工大学出版社,2006:72-73.
[17]张以顺,黄霞,陈云凤.植物生理学实验教程[M].北京:高等教育出版社,2009:141-142.
[18]NAKANA Y,ASADA K.Hydrogen peroxide is scavenged by ascorbate specific peroxidase in spinach chloroplasts[J].Plant Cell Physiol,1981,22:867-880.
[19]SCHAEDLE M,BASSHAM J A.Chloroplast glutathione reductase[J].Plant Physiol,1977,59:1011-1012.
[20]LIU Jun,JIANG Mingyi,ZHOU Yifeng,et al.Production of polyamines is enhanced by endogenous abscisic acid in maize seedlings subjected to salt stress[J].J Integr Plant Biol,2005,47(11):1326-1334.
[21]IQBAL M,ASHRAF M,REHMAN S,et al.Does polyamine seed pretreatment modulate growth and levels of some plant growth regulators in hexaploid wheat (Triticum aestivum L.)plants under salt stress[J].Bot Studies,2006,47:239-250.
[22]周碧燕,郭振飞.ABA 及其合成抑制剂对柱花草抗冷性及抗氧化酶活性的影响[J].草业学报,2005,14(6):94-96.
[23]邓化冰,史建成,肖应辉,等.开花期低温胁迫对水稻剑叶保护酶活性和膜透性的影响[J].湖南农业大学学报,2011,37(6):581-585.
[24]徐田军,董志强,兰宏亮,等.低温胁迫下聚糖萘合剂对玉米幼苗光合作用和抗氧化酶活性的影响[J].作物学报,2012,38(2):352-359.
[25]张蕊,高志明,吕俊,等.外源水杨酸对水稻幼苗耐寒性的影响[J].江苏农业科学,2012,40(6):62-65.
[26]谷会,弓德强,朱世江,等.冷激处理对辣椒冷害及抗氧化防御体系的影响[J].中国农业科学,2011,44(12):2523-2530.
[27]YANG Quanhai,LU Wei,HU Maolong,et al.QTL and epistatic interaction underlying leaf chlorophyll and H2O2content variation in rice (Oryza sativa L.)[J].Acta Genetica Sinica,2003,30(3):245-250.
[28]李潮海,尹飞,王群.不同耐旱性玉米杂交种及其亲本叶片活性氧代谢对水分胁迫的响应[J].生态学报,2006,26(6):1912-1919.

