香蕉枯萎病菌2 种细胞壁降解酶酶活性平板检测方法
施金秀,林先丰,姜乃月,凌金锋,李敏慧,姜子德
(华南农业大学 资源环境学院,广东广州 510642)
细胞壁降解酶(Cell wall degrading enzymes,CWDEs)是植物病原真菌在侵染寄主植物的过程中最先分泌的致病工具之一.它能够降解寄主植物细胞壁的各种成分,破坏植物细胞壁,使细胞分离、组织溃散,进一步促进病原真菌侵入植物体内并在植物的组织间和细胞间生长繁殖[1-2].根据酶作用的底物种类,可将细胞壁降解酶分为角质酶、果胶酶、纤维素酶、半纤维素酶和其他酶类如蛋白酶、淀粉酶、脂肪酶和磷脂酶等[2-3].多聚半乳糖醛酸酶通过水解作用切断糖苷键降解果胶,是病原真菌侵入植物过程中最先分泌的一类果胶酶.果胶类物质被降解后,其他的细胞壁组成物质才有可能被其他酶如纤维素酶、半纤维素酶、木质素酶等降解.病原真菌正是通过一步步降解植物细胞壁成分,达到其致病的目的[4].因此,作为重要的致病因子,多聚半乳糖醛酸酶和纤维素酶酶活性的检测对于进一步了解和探索病原真菌的致病机制具有重要的意义.
由尖镰孢菌古巴专化型[Fusarium oxysporum f.sp.cubense (E.F.Smith)Snyder et Hansen,FOC],侵染引起的香蕉枯萎病,是香蕉生产中为害最严重的病害[5].尽管该病害具有典型的细胞壁降解症状[6],但病原菌与细胞壁降解相关的致病机制尚未明确,建立针对多聚半乳糖醛酸酶和纤维素酶的酶活性检测体系是非常必要的.而目前细胞壁降解酶的检测方法包括紫外-可见光分光光度计法[7]、滤纸法[8]、平板透明圈法[9]、等电聚焦电泳分析法[10]等,这些都存在着不同程度的步骤繁琐、检测成本高、不能定量检测等缺点.本研究通过摸索香蕉枯萎病菌4 号生理小种在不同条件下多聚半乳糖醛酸酶和纤维素酶产量及酶活性检测方法,以期建立一种省时省力的细胞壁降解酶酶活性平板的检测方法,并通过这种方法筛选外源T-DNA 随机插入的致病突变体[11],以期得到细胞壁降解酶酶活性降低的致病突变体,为阐明香蕉枯萎病菌与细胞壁降解相关的致病机制提供材料,也为研究其他病原真菌的致病机制提供方法上的参考.
1 材料与方法
1.1 供试菌株
香蕉枯萎病菌4 号生理小种野生型菌株(Wild type,WT):XJZ2,为华南农业大学资源环境学院植物病理学系真菌研究室分离、鉴定和保存[5];致病力减弱突变体为通过致病性检测筛选获得的外源TDNA 随机插入的突变体[11].
1.2 孢子悬浮液的制备
于PDA(马铃薯200 g,葡萄糖20 g,琼脂20 g,加双蒸水定容至1 000 mL)平板上活化低温保存的XJZ2 菌株,25℃黑暗条件培养至长出新鲜菌丝后,挑取菌落边缘菌丝至一新PDA 平板,相同培养条件下培养5 d;用灭菌接种环挑取5 mm 菌碟接种于装有10 mL YPD(酵母浸出粉10 g,蛋白胨20 g,葡萄糖20 g,加双蒸水定容至1 000 mL)培养液的50 mL 离心管中,200 r/min、25℃条件下培养2 d 后,用一层擦镜纸过滤除去菌丝块,4 000 r/min 离心5 min,收集小孢子并以灭菌水制成孢子悬浮液,血球计数板计算孢子浓度,用灭菌水配成不同浓度的孢子悬浮液备用.
1.3 产酶培养基及粗酶液的制备
产酶培养基采用合成培养基加1%诱导底物[果胶(Pectin)、多聚半乳糖醛酸(Polygalacturonic acid,PGA)和羧甲基纤维素(Carboxymethyl cellulose,CMC)]配制而成(以上化学试剂均购自Sigma 公司).合成培养基[12]配方为:0.2 g MgSO4·7H2O,0.4 g KH2PO4,0.2 g KCl,1 g NH4NO3,0.01 g FeSO4,0.01 g ZnSO4,0.01 g MnSO4,用双蒸水补足至1 000 mL .
粗酶液的制备:在100 mL 三角瓶中加25 mL 产酶培养基,用已经配制好的孢子悬浮液接种,使最终接种密度为1×101~1×106mL-1,28℃、200 r/min条件下,培养1~5 d,分别收集培养液,4 000 r/min 离心10 min 后,取上清并用孔径0.22 μm 的细菌过滤器过滤,得到的滤液为粗酶液,置于4℃保存备用.
1.4 酶活性检测培养基的配制及酶活性平板检测
参照Chatterjee 等[13]提出的酶活性检测培养基配方,稍作修改.多聚半乳糖醛酸酶检测培养基:10 g/L PGA,10 g/L 酵母浸出粉,2.2 mmol/L EDTA,110 mmol/L 醋酸钠(pH 5.5),20 g/L 琼脂糖;纤维素酶检测培养基:1 g/L CMC,25 mmol/L 磷酸钠(pH 7.0),20 g/L 琼脂糖.
将配制好的酶活性检测培养基以每皿12 mL 的量倒入直径为9 cm 的培养皿中,待稍凝固后,置孔径7 mm 的灭菌牛津杯于培养基上,待全部凝固后,即制成检测平板.
取上述制备的粗酶液每孔100 μL 加入牛津杯中,分别于28、30 和37℃温度下放置16~18 h 后,进行显色处理,观察并测量酶解圈的直径.其中,多聚半乳糖醛酸酶酶活性平板检测用4 mol/L 盐酸浸洗显色15 min;纤维素酶酶活性平板检测先用1 g/L的刚果红染色30 min,再用1 mol/L 氯化钠脱色2次,每次15 min.
本试验根据影响产酶量和酶活性检测的主要因子,逐一进行单因子条件试验.其中,后续因子最优条件的确定是在前面因子已确定的条件下进行的.每个处理设3 个重复,用SAS 软件进行差异显著性分析.
1.5 致病力减弱突变体的酶活性平板检测
将筛选的致病力减弱的突变体与野生型菌株XJZ2(作为内参照)复壮后,配成相同浓度的孢子悬浮液,接种到产酶培养基中,按上述的最佳检测参数进行这2 种细胞壁降解酶的酶活检测,观察并测量酶解圈大小,每个处理设3 个重复,用SAS 软件进行差异显著性分析.
2 结果与分析
2.1 多聚半乳糖醛酸酶酶活性平板检测
在对多聚半乳糖醛酸酶进行酶活性平板检测时,不同的诱导底物、接种XJZ2 孢子浓度、培养时间及检测温度都对酶解圈的直径有影响.如图1A 所示,诱导底物为果胶时,得到的多聚半乳糖醛酸酶的酶解圈最大,说明果胶适合诱导该酶的产生;用果胶诱导产酶,培养3 d,当接种终浓度为1×104mL-1时,酶解透明圈的直径达到最大(图1B);确定用果胶诱导产酶,接种孢子浓度为1×104mL-1时,培养3 d 即可检测到最大的酶解圈,随着培养时间的增加,酶解圈反而减小(图1C),说明以果胶诱导,接种终浓度为1×104mL-1孢子时,培养3 d 所产生的酶量最大.当确定前3 个影响因子后,不同的温度下,酶活性检测得到的酶解圈大小不同,在37℃时,所得的酶解圈最大(图1D),说明37℃为多聚半乳糖醛酸酶酶活性平板的最佳检测温度.

图1 不同影响因子对多聚半乳糖醛酸酶检测的影响Fig.1 Effects of different factors on polygalacturonase measurement
2.2 纤维素酶酶活性平板检测
不同的产酶诱导底物、接种XJZ2 孢子终浓度、培养时间及酶活性平板检测温度得到的纤维素酶的酶解透明圈大小不同.如图2A 所示,诱导底物为羧甲基纤维素时,得到的酶解圈最大,说明羧甲基纤维素适合诱导纤维素酶的产生;以其诱导产酶,当接种孢子终浓度为1×105mL-1,培养3 d 时,酶解透明圈的直径达到最大,增加接种孢子浓度到1× 106mL-1,酶解透明圈大小并没有相应增加,而是有所减少,因而确定最适接种孢子浓度为1×105mL-1(图2B);确定用羧甲基纤维素诱导产酶,接种孢子浓密为1×105mL-1时,培养3 d 后即可检测到最大的酶解圈,培养时间增加,酶解圈反而减小,因此最适的培养时间为3 d(图2C);在确定前3 个影响因子后,不同的酶活性检测温度下,得到的酶解圈大小不同,37℃时所得的酶解圈最大(图2D),说明纤维素酶酶活平板检测时37℃为最适的酶反应温度.因而,确认纤维素酶酶活性平板检测的最佳条件为以羧甲基纤维素为诱导底物,接种香蕉枯萎病菌的孢子终浓度为1×105mL-1、培养3 d,37℃下进行检测.
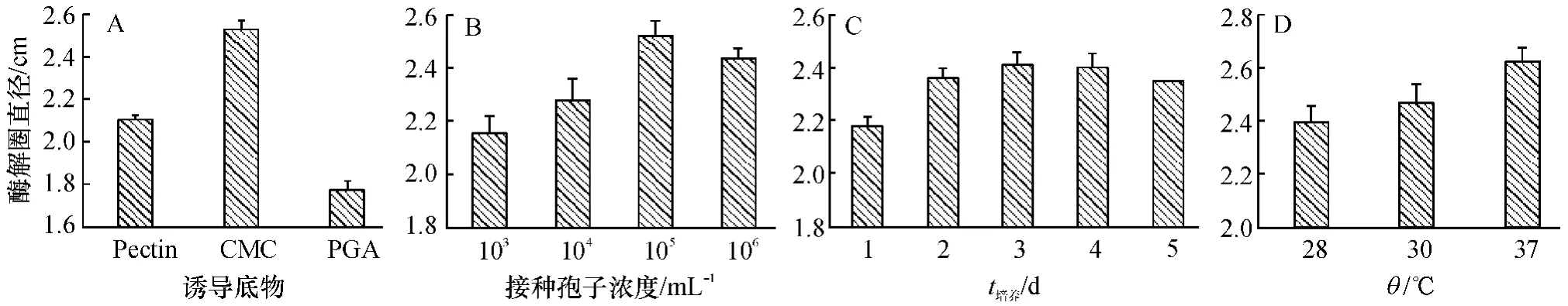
图2 不同影响因子对纤维素酶检测的影响Fig.2 Effects of different factors on cellulase measurement
2.3 香蕉枯萎病菌致病力减弱突变体2 种细胞壁降解酶酶活性检测
按上述最佳检测参数,以香蕉枯萎病菌4 号生理小种的野生型(WT)菌株为对照,对已经筛选到的该病原菌致病力减弱突变体进行多聚半乳糖醛酸酶和纤维素酶的酶活性平板检测,结果发现了2 株细胞壁降解酶酶活性下降的致病突变体L248 和L1012(图3).与WT 相比,突变体L248的多聚半乳糖醛酸酶和纤维素酶的酶解圈都明显变小,差异显著性分析表明它们与WT 之间存在极显著差异(P<0.01).突变体L1012 的多聚半乳糖醛酸酶酶解圈明显小于WT 的,且存在极显著性差异(P<0.01),而纤维素酶酶解圈与WT相比没有明显的变化.该结果表明:2 个致病性减弱的突变体的纤维素酶和多聚半乳糖醛酸酶酶活性上都表现为不同程度地降低,暗示这2 种细胞壁降解酶可能在香蕉枯萎病菌的致病过程中起重要的作用.

图3 致病力减弱突变体多聚半乳糖醛酸酶和纤维素酶酶活性平板检测结果Fig.3 Polygalacturonase and cellulase activity of the pathogenicity-attenuated mutants
3 讨论与结论
为了能够快速地从外源T-DNA 随机插入的香蕉枯萎病菌4 号生理小种致病突变体中找到与细胞壁降解酶有关的致病突变体,本研究建立了多聚半乳糖醛酸酶和纤维素酶2 种细胞壁降解酶酶活性平板检测方法.该方法是基于平板透明圈法[9]和滤纸法[8]的一种省时省力的酶活检测方法.与常规的紫外-可见光分光光度计法[7]相比,该方法不用制作标准曲线,也不需要借助仪器,可以在短时间内,通过观察酶解圈的大小,非常直观地观察到目标酶的活性;与马桂珍等[9]采用的平板透明圈法相比,2 种方法都比较直观,但本研究以酶液取代了菌饼,不仅可以定性而且在设有内参(WT)的条件下,通过固定接种孢子密度、培养时间等与产酶量相关的参数,在一定范围内可定量地检测酶活性,同时也避免了随着酶解时间的延长透明圈会被菌落所覆盖而不能准确反映酶活性的缺点;与等电聚焦电泳分析法[10]相比,本研究具有检测成本低、操作简单及不需要借助仪器的优点.因此本研究所建立的方法所需时间短,检测方法直观可靠,检测成本低,特别适合短时间内大量地筛选酶活性有变化的突变体.此外,本研究所确定的最佳检测参数,也可为镰孢菌属内其他种真菌的细胞壁降解酶酶活性检测提供方法参考.
多聚半乳糖醛酸酶和纤维素酶是植物病原真菌侵入寄主植物初期分泌的最重要的2 种细胞壁降解酶,被认为是植物病原真菌的重要致病因子,在其致病过程中特别是侵入与定殖阶段起着重要作用[14-16].本研究筛选到致病力下降的突变体L248,其多聚半乳糖醛酸酶及纤维素酶活性与WT 相比显著下降;而突变体L1012 的多聚半乳糖醛酸酶活性也有比较明显地下降.该结果验证了这一类细胞壁降解酶酶活性降低与病原菌致病力下降之间的正相关关系.但是,Pietro 等[12,17-18]的研究也表明,敲除单一细胞壁降解酶基因不一定影响尖孢镰刀菌的致病力.Michielse 等[19]认为,这可能与该病原菌中存在着其他冗余基因编码的细胞壁降解酶有关,突变1个基因,其他冗余基因就会表达并合成同样功能的酶,而表现为不影响病原菌的致病力.Ospina-Giraldo等[20]从尖孢镰刀菌番茄专化型(F.oxysporum f.sp.lycopersici)上分离到1 个受蔗糖抑制的多种细胞壁降解酶调控基因SNF1,敲除该基因,多种细胞壁降解酶的表达受到抑制,突变菌株也表现为致病力显著下降.该基因在其他的植物病原真菌中也被证明具有同样的细胞壁降解酶表达调控功能,并最终影响其病原菌的致病力[21-22].因此,研究一类细胞壁降解酶基因表达的调控因子,对于揭示病原菌与此相关的致病机制具有重要的意义.本研究筛选的突变体L248 和L1012 均不同程度地影响着细胞壁降解酶多聚半乳糖醛酸酶和纤维素酶的酶活性水平,而对其突变基因的序列分析表明这2 个基因均不是细胞壁降解酶的合成基因(结果另述),由此推断该基因极有可能通过调控细胞壁降解酶基因的表达,并最终影响香蕉枯萎病菌的致病力,但如何影响以及通过哪种信号传导途径进行调控,仍需进一步的研究.
本研究通过多聚半乳糖醛酸酶和纤维素酶的平板检测方法,快速地筛选和检测了香蕉枯萎病菌致病突变体,并找到2 株多聚半乳糖醛酸酶和纤维素酶酶活性下降的突变体L248 和L1012,为研究香蕉枯萎病菌与细胞壁降解相关的致病机制提供了材料,并奠定了科学的基础.
[1]ARO N,PAKULA T,PENTTILA M.Transcriptional regulation of plant cell wall degradation by filamentous fungi[J].FEMS Microbiol Rev,2005,29(4):719-739.
[2]KIKOT G E,HOURS R A,ALCONADA T M.Contribution of cell wall degrading enzymes to pathogenesis of Fusarium graminearum:A review[J].J Basic Microbiol,2009,49(3):231-241.
[3]DOI R H,KOSUGI A.Cellulosomes:Plant-cell-wall-degrading enzyme complexes[J].Nat Rev Microbiol,2004,2(7):541-551.
[4]REIGNAULT P,VALETTE-COLLET O,BOCCARA M.The importance of fungal pectinolytic enzymes in plant invasion,host adaptability and symptom type[J].Eur J Plant Pathol,2008,120(1):1-11.
[5]李敏慧,习平根,姜子德,等.广东香蕉枯萎病菌生理小种的鉴定[J].华南农业大学学报,2007,28(2):38-41.
[6]董章勇,王琪,秦世雯,等.香蕉枯萎病菌1 号和4 号生理小种细胞壁降解酶的比较[J].植物病理学报,2010,40(5):463-468.
[7]SOMOGYI M.Notes on sugar determination[J].J Biol Chem,1952,195(1):19-23.
[8]GHOSE T K.Measurement of cellulose activities[J].Pure Appl Chem,1987,59(2):257-268.
[9]马桂珍,高会兰,张拥华,等.粘帚霉对核盘菌菌核的寄生作用及其细胞壁降解酶活性分析[J].吉林农业大学学报,2007,29(6):628-632.
[10]CABANNE C,DONECHE B.Purification and characterization of two isozymes of polygalacturonase from Botrytis cinerea:Effect of calcium ions on polygalacturonase activity[J].Microbiol Res,2002,157(3):183-189.
[11]李敏慧,张荣,姜大刚,等.根癌农杆菌介导的香蕉枯萎病菌4 号生理小种的转化[J].植物病理学报,2009,39(4):405-412.
[12]DI PIETRO A,RONCERO M I G.Endopolygalacturonase from Fusarium oxysporum f.sp.lycopersici:Purification,characterization,and production during infection of tomato plants[J].Phytopathology,1996,86(12):1324-1330.
[13]CHATTERJEE A,CUI Yaya,LIU Yang,et al.Inactivation of rsmA leads to over production of extracellular pectinases,cellulases,and proteases in Erwinia carotovora sub sp.carotovora in the absence of the starvation/cell density-sensing signal,N-(3-Oxohexanoyl)-L-homoserine lactone[J].Appl Environ Microbiol,1995,61(5):1959-1967.
[14]EVELEIGH D E,MANDELS M,ANDREOTTI R,et al.Measurement of saccharifying cellulose[J].Biotechnol Biofuels,2009(2):21.
[15]NITURE S K.Comparative biochemical and structural characterizations of fungal polygalacturonases[J].Biologia,2008,63(1):1-19.
[16]HAVE A,MULDER W,VISSER J,et al.The endopolygalacturonase gene Bcpgl is required for full virulence of Botrytis cinerea[J].Mol Plant Microbe Interact,1998,11(10):1009-1016.
[17]DI PIETRO A,RONCERO M I G.Cloning,expression,and role in pathogenicity of pg1 encoding the major extracellular endopolygalacturonase of the vascular wilt pathogen Fusarium oxysporum[J].Mol Plant Microbe Interact,1998,11(2):91-98.
[18]DI PIETRO A,MADRID M P,CARACUEL Z,et al.Fusarium oxysporum:exploring the molecular arsenal of a vascular wilt fungus[J].Mol plant pathol,2003,4(5):315-325.
[19]MICHIELSE C B,REP M.Pathogen profile update:Fusarium oxysporum[J].Mol Plant Pathol,2009,10(3):311-324.
[20]OSPINA-GIRALDO M D,MULLINS E,KANG S.Loss of function of the Fusarium oxysporum SNF1 gene reduces virulence on cabbage and Arabidopsis[J].Curr Genet,2003,44(1):49-57.
[21]TONUKARI N J,SCOTT-CRAIG J S,WALTON J D.The Cochliobolus carbonum SNF1 gene is required for cell walldegrading enzyme expression and virulence on maize[J].Plant Cell,2000,12(2):237-248.
[22]TZIMA A K,PAPLOMATAS E J,RAUYAREE P,et al.VdSNF1,the sucrose nonfermenting protein kinase gene of Verticillium dahliae,is required for virulence and expression of genes involved in cell-wall degradation[J].Mol Plant Microbe Interact,2011,24(1):129-142.
——α-葡萄糖醛酸酶的研究进展*

