不同厂家奥美拉唑肠溶胶囊释放曲线评价
王震红,杨永刚,薛 娇,王新意
奥美拉唑是一种质子泵抑制剂,口服后在十二指肠吸收,选择性地聚集在胃壁细胞的酸性环境中,通过特异性地抑制胃壁细胞的H+-K+-ATP酶,减少胃酸分泌,促进溃疡愈合,作用持久。释放度是评价一种药物制剂不同剂型、不同生产企业产品、不同批次间质量的重要数据。体外释放度在某种程度上与体内生物利用度呈现一定的相关性,从体外释放度数据可估计其药动学和生物利用度的特性。本文通过对52个奥美拉唑肠溶胶囊生产企业69批次样品进行批内释放度考察,对5家生产企业进行批间释放度考察,用以评价不同生产企业制剂工艺的成熟性和稳定程度。
1 仪器与试药
1.1 仪器 美国Agilent 1200高效液相色谱仪;RCZ-8B药物溶出度测定仪(天大天发科技有限公司)。
1.2 试药 奥美拉唑对照品(中国药品生物制品检定所,批号:100367-200702),奥美拉唑肠溶胶囊(来源于 52家生产企业,总计 300批,规格:20 mg),乙腈为色谱纯,其他试剂均为分析纯。
2 色谱条件与方法
2.1 色谱条件 色谱柱:Agela C8(200 mm×4.6 mm,5 μm);流动相:0.01 mol/L 磷酸氢二钠溶液(用磷酸调pH值至7.6)-乙腈(75∶25);检测波长:302 nm;柱温:室温;进样量:20 μL;流速:1.0 mL/min。
2.2 对照品溶液的制备 精密量取奥美拉唑对照品20 mg,加乙醇10 mL溶解后,用混合释放介质[氯化钠的盐酸溶液-0.235 mol/L磷酸氢二钠溶液(5∶4)]定量稀释制成每1 mL中约含20 μg的溶液,精密量取5 mL,加0.25 mol/L氢氧化钠溶液1 mL,摇匀,作为对照品溶液。
2.3 供试品溶液的制备 采用浆法,以氯化钠的盐酸溶液500 mL为溶剂,转速为100 r/min,经2 h,在操作容器中加预热至37℃的0.235 mol/L磷酸氢二钠溶液 400 mL,分别于 5、10、20、30、45、60 min取溶液滤过,精密量取续滤液5 mL,加0.25 mol/L氢氧化钠溶液1 mL,摇匀,作为供试品溶液。
3 释放度评价
3.1 批内均一性评价
3.1.1 评价标准 以每个生产企业一个批号一次试验6片在各点释放量的精密度为指标,比较批内均一性。第1个取样点释放量的RSD应在20%以内,其他各取样点释放量的RSD应在10%以内。
3.1.2 考察样品52家生产企业各1批样品。
3.1.3 结果 20批样品中符合“3.1.1”项评价标准占总数的38.5%,32批样品不符合“3.1.1”项评价标准占总数的61.5%。代表图谱见图1、图2。

图1 批内均一性标准曲线(符合评价标准)

图2 批内均一性标准曲线(不符合评价标准)
3.1.4 结论 大部分生产企业的产品批内均一性较差,主要体现在释放曲线前两点重复性差,RSD较大。通过观察外观性状,发现肠溶小丸大小的均匀程度会影响批内均一性。如果肠溶小丸大小差异较大,比表面积呈几何级数增大,释放速度差异也会增大,直接影响批内均一性。
3.2 批间均一性评价
3.2.1 评价标准 选取5个生产企业各3~5批样品进行试验。用相似等效限法分析同一企业的批间重现性。以同一企业多批产品同一时间点释放量的平均值为释放限度值(Q),概率水平(δ)取5%,按下式分别计算UT(上限)与LT(下限)。如果该企业多批产品释放量测定结果均在LT~UT之间,则认为受试制剂释放均一性良好。

3.2.2 考察样品 根据单批次考察结果,选取抽样批次较多、工艺具有代表性的5家企业3~5批样品。
3.2.3 结果 5家生产企业中3家生产企业达到“3.2.1”项的评价标准,2家生产企业批间均一性不符合评价标准,见表1。
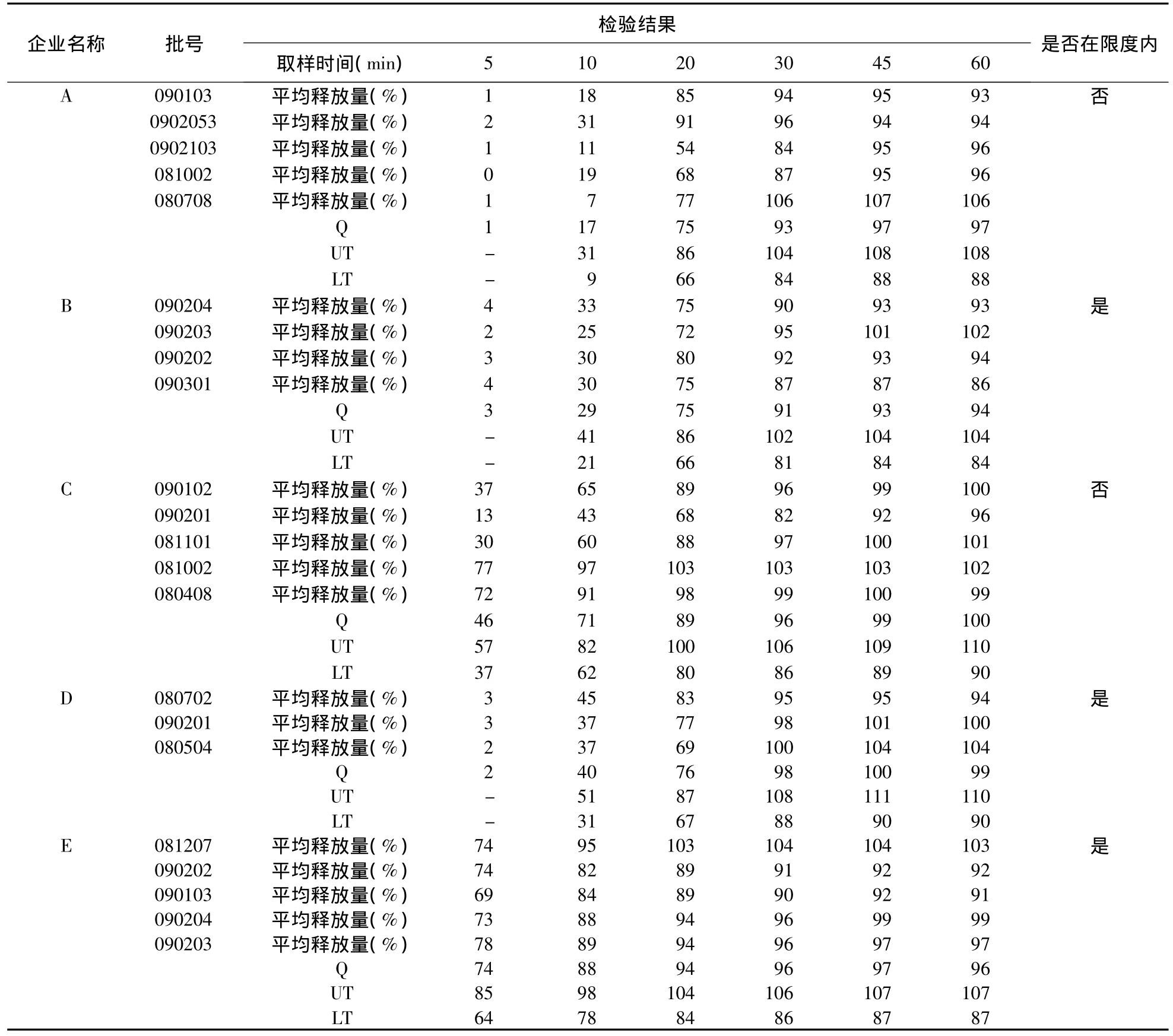
表1 奥美拉唑肠溶胶囊释放度批间均一性考察结果
3.2.4 结论 3家生产企业符合评价标准,说明其生产工艺控制相对较好;2家生产企业批间均一性不符合“3.2.1”项的评价标准,其处方及生产工艺的稳定性有待进一步考察。其中C生产企业生产工艺为直接购买B生产企业生产的奥美拉唑肠溶小丸进行分装。但批号为 090102、090201、081101,与批号为081002、080408的释放曲线明显不同,初步认为该企业购入的肠溶小丸并非同一来源。不同来源的小丸,因其质量不同,可能导致成品释放曲线的不同,即生物利用度的不同。因此,在提高奥美拉唑成品质量标准的同时,应提高小丸的质量标准。
3.3 释放曲线相似性比较 将考察样品的平均释放率与参比制剂的平均释放率进行比较,以评价释放曲线相似性。
3.3.1 评价标准 评价释放曲线相似性目前多采用f2因子法[1]。该方法能够较客观地对相似性给出结论。但该方法对参比制剂与受试制剂均有一定的限度,如:参比制剂与受试制剂含量应一致,含量差异不得超过5%;参比制剂与受试制剂前4个时间点组内释放量RSD小于20%,最后一个时间点组内释放量RSD小于10%,很多企业产品因上述限制无法进行评价。同时该方法要求每个制剂均要对12个单剂的释放情况进行测定。奥美拉唑肠溶胶囊释放度测定全过程需要3.5 h以上(2 h酸液,1 h缓冲液释放,约0.5 h后处理),如按f2因子法对52个胶囊剂生产企业均测定12个单剂的释放情况,工作量过大,无法在规定时间内完成。因此,参照f2因子法,对每批产品测定6个单剂的释放情况,同时,暂不考虑受试制剂与参比制剂含量的差异(参比制剂与受试制剂含量最大未超过10%),模拟f2因子法进行释放过程比较。按下列公式计算类f2值。类f2值≥50,认为受试制剂与参比制剂释放过程一致。参比制剂选择原研单位阿斯利康制药有限公司生产的“洛赛克”。
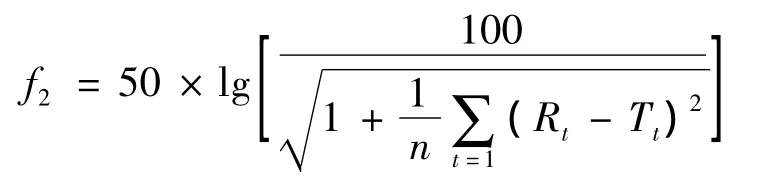
参比制剂与受试制剂释放曲线应符合以下条件:参比制剂与受试制剂前4个时间点组内释放值RSD小于20%,最后一个时间点组内释放值RSD小于10%。
3.3.2 考察样品 52个胶囊剂生产企业各选一批次样品与参比制剂进行比较。
3.3.3 结果 共22批样品类f2值大于50,可认为与参比制剂释放过程一致,占总数的42.3%。20批样品RSD符合要求,其中类f2值大于50的9批,占RSD符合要求总数的45.0%。
3.3.4 结论 在RSD符合要求的样品中,有55.0%的样品与参比制剂释放过程不相似。经与参比制剂比较发现,几乎所有产品在测定时间内均能达到完全释放。而类f2值低的主要原因是样品释放速度较快,其中大部分样品t80≤20 min,即在20 min内释放量已经超过80%,尤其是类f2值最低的3家生产企业,t80≤10 min。而参比制剂的t80=30 min,即30 min时释放量达到80%,可见样品释放速度直接影响与参比制剂释放过程的相似性。
4 讨论
4.1 释放曲线均一性、相似度 多数企业样品释放曲线批内均一性较差,其中2家生产企业的批间重现性亦不符合要求,其他批内均一性较好的生产企业,只有半数释放曲线与原研制剂的释放曲线相似。从工艺角度分析,肠溶小丸制备工艺复杂,小丸大小、均匀程度、胶囊质量均会影响释放曲线。
4.2 胶囊壳的影响 胶囊壳对产品的释放曲线有一定的影响。分析其原因,虽然胶囊壳大部分在氯化钠的盐酸溶液中已经溶解,但仍有部分未完全溶解的囊壳包裹或黏附在小丸上,影响奥美拉唑的释放。
4.3 释放度评价标准 从国内奥美拉唑肠溶胶囊现有生产水平看,仅从一个时间点、一种释放介质、一个限度值已经不能科学地控制产品的质量,应建立严格的释放度评价标准,从而促进生产企业对工艺、处方和原/辅料来源进行深入研究,同时亦可避免低水平仿制药的申报,还可减少人为因素和主观因素对生物等效性试验结果的影响;上市后的产品可采用集中抽验进行释放曲线评价,以促进生产企业把好质量关,严格规范地进行生产,保证国内产品与原研产品质量的一致性和等效性。
:
[1]国家食品药品监督管理局.关于印发药品评价抽验质量分析指导原则的通知[Z].食药监办稽[2009]30号,2009.

