206例非酒精性脂肪性肝炎患者的临床特点分析
常彬霞,霍丹丹,孙颖,滕光菊,赵军,张伟,邹正升,李保森
非酒精性脂肪性肝病(nonalcoholic fat liver disease,NAFLD)是欧美等西方发达国家肝功能酶学异常和慢性肝病最常见的原因,普通成人的患病率达到20%~33%,其中非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)和肝硬化分别占到10%~20%和2%~3%[1-5]。随着肥胖症和代谢综合征在全球的流行,近20年来亚洲国家NAFLD增长迅速且发病呈低龄化趋势,中国的上海﹑广州和香港等发达地区成人NAFLD患病率已达到15%左右[6-7]。NASH是NAFLD的一个亚型,其特征为肝脂肪变性﹑肝损伤和炎症共存。本文对解放军302医院2008年5月-2011年12月住院行肝穿刺术的206例NASH患者的临床特点进行分析,现报告如下。
1 资料与方法
1.1 研究对象 206例NASH患者均为2008年5月-2011年12月解放军302医院收治的经肝组织学检查确诊的病例,其中男性160例(77.7%),女性46例(22.3%),汉族200例(97.1%),蒙古族1例(0.5%),回族2例(1.0%),满族1例(0.5%),朝鲜族1例(0.5%),藏族1例(0.5%),年龄2~62(29.9±14.0)岁,体重5~124(73.2±16.8)kg,身高86~190(166.5±13.9)cm,收缩压125.0±11.2mmHg,舒张压78.4±9.3mmHg。除外病毒性肝炎﹑药物性肝病﹑全胃肠外营养﹑肝豆状核变性﹑自身免疫性肝病等可导致脂肪肝的特定疾病,其中32例(15.5%)有饮酒史,但饮酒折合乙醇量小于140g/周(女性<70g/周)。
1.2 NASH的临床诊断标准 参照非酒精性脂肪性肝病诊疗指南(2010年修订版)[8]。
1.3 实验室检查 血液生化指标采用AU-5400全自动生化分析仪(Olympus,日本)检测,血常规应用XE-2100全血细胞分析仪(希康美森,日本)检测,肝纤维化四项采用发光免疫法(源德生物,GETLIA-962)检测。主要检测指标包括:白蛋白(ALB)﹑球蛋白(GLO)﹑总胆红素(TBIL)﹑直接胆红素(DBIL)﹑丙氨酸转氨酶(ALT)﹑天冬氨酸转氨酶(AST)﹑AST与ALT之比(S/L)﹑碱性磷酸酶(ALP)﹑γ-谷氨酰转肽酶(GGT)﹑总胆酸(TBA)﹑胆碱酯酶(CHE)﹑葡萄糖(GLU)﹑铁(Fe)﹑总胆固醇(TC)﹑甘油三酯(TG)﹑乳酸脱氢酶(LDH)﹑尿酸(UA),凝血酶原时间(PT),凝血酶原活动度(PA),γ-球蛋白电泳(γ-EP),白细胞(WBC),红细胞(RBC),血红蛋白(HGB),平均红细胞体积(MCV),血小板(PLT),血小板分布宽度(RDW),糖化血红蛋白(HbA1c),高密度脂蛋白(HDLC),低密度脂蛋白(LDLC),脂蛋白a(LPa),载脂蛋白A(ApoA),载脂蛋白B(ApoB)。透明质酸(HA),层黏连蛋白(LN),Ⅳ型胶原(IV-COL),Ⅲ型前胶原(PCⅢ)。
1.4 肝组织学检查 采用1s快速肝穿活检术或超声引导下肝穿刺活检术取得肝组织。肝穿组织经4%中性甲醛液固定,石蜡包埋,连续切片,片厚4μm,行HE染色﹑Gordon-Sweet 法网状纤维染色﹑Masson三色染色以及免疫组化染色,由富有经验的病理科医生于光镜下观察评估。病理学诊断参照非酒精性脂肪性肝病诊疗指南(2010年修订版)[8]。
1.5 统计学处理 采用SPSS 18.0软件进行统计分析,计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD法;计数资料以百分率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 合并症及临床症状 206例NASH患者中,10例(4.9%)合并高血压,7例(3.4%)合并糖尿病,121例(58.7%)存在血脂代谢异常。从临床症状上看,42例(20.4%)伴有乏力,2例(1.0%)伴有消化不良,24例(11.7%)伴有肝区隐痛,12例(5.8%)伴有食欲减退,7例(3.4%)伴有恶心,5例(2.4%)伴有皮肤巩膜黄染。
2.2 肝组织病理学结果 206例NASH患者中,13例(6.3%)脂肪变性程度<5%(F0),35例(17.0%)轻度脂肪变性(F1),85例(41.3%)中度脂肪变性(F2),73例(35.4%)重度脂肪变性(F3)。201例进行肝组织炎症分期的患者中,G0为2例(1.0%),G1为165例(82.1%),G2为33例(16.4%),G3为1例(0.5%);201例进行肝组织纤维化分级的患者中,S0为16例(8.0%),S1为118例(58.7%),S2为46例(22.9%),S3为19例(9.5%),S4为2例(1.0%)。大泡性肝细胞脂肪变35例(17.0%),小泡性肝细胞脂肪变4例(1.9%),混合性肝细胞脂肪变129例(62.6%),另38例未描述脂肪变性性状;85例(41.3%)无肝细胞气球样变,108例(52.4%)伴有肝细胞气球样变,13例病理未就此作出描述;100例(48.5%)存在点灶状坏死,94例(45.6%)有凋亡小体,1例(0.5%)有桥接坏死,78例(37.9%)存在局灶性炎症,86例(41.7%)存在窦周炎,71例(34.5%)存在窦周纤维化,141例(68.5%)存在汇管区扩大,49例(23.8%)伴纤维间隔形成,8例(3.9%)存在界面炎。

Item Value Item Value WBC(×109/L) 6.52±1.59 TBIL(μmol/L) 15.32±11.99 RBC(×1012/L) 4.98±0.46 ALB(g/L) 44.56±3.49 HGB(g/L) 148.3±14.8 CHE(U/L) 9027±1972 MCV(fl) 87.73±4.24 rEP(%) 14.66±2.86 PLT(×109/L) 227.5±61.5 TC(mmol/L) 4.80±0.97 PTS(s) 11.13±0.84 TG(mmol/L) 2.15±1.88 PTA(%) 103.4±12.4 GLU(mmol/L) 5.10±0.82 ALT(U/L) 123.7±100.7 HDLC(mmol/L) 1.05±0.34 AST(U/L) 63.9±43.9 LDLC(mmol/L) 3.25±0.73 AST/ALT 0.61±0.31 HA(μg/L) 91.52±51.3 ALP(U/L) 123.3±88.5 PCIII(μg/L) 10.59±15.82 GGT(U/L) 88.12±84.98 IVC(μg/L) 71.23±53.45 DBIL(μmol/L) 5.34±7.14 LN(μg/L) 57.08±81.66
2.3 实验室检查结果 206例患者主要检验指标见表1,在各项指标中,以ALT﹑AST异常最为常见,其中177例(85.9%)ALT异常,133例(64.6%)AST异常。
2.4 体重指数(BMI)及代谢综合征情况 统计完全的152例NASH患者BMI值为25.94±4.38kg/cm2。其中,26例(17.1%)体重正常,29例(19.1%)超重,72例(47.4%)I度肥胖,25例(16.4%)Ⅱ度肥胖。根据2005年国际糖尿病联盟标准[9-10]对统计完全的156例NASH患者判断是否存在代谢综合征,结果表明,38例(24.4%)存在代谢综合征,118例(75.6%)不存在代谢综合征。
2.5 超声与病理符合程度 206例患者中有196例行腹部超声检查,其中172例(87.8%)存在不同程度脂肪肝,24例(12.2%)未提示存在脂肪肝。196例行腹部超声检查的患者中,经肝穿检查提示12例(6.1%)脂肪变性程度<5%,即为F0,其余184例存在不同程度脂肪变性(表2)。χ2检验结果χ2=68.033,P=0.000,即腹部超声与肝穿病理对脂肪变性程度的判断存在统计学差异。
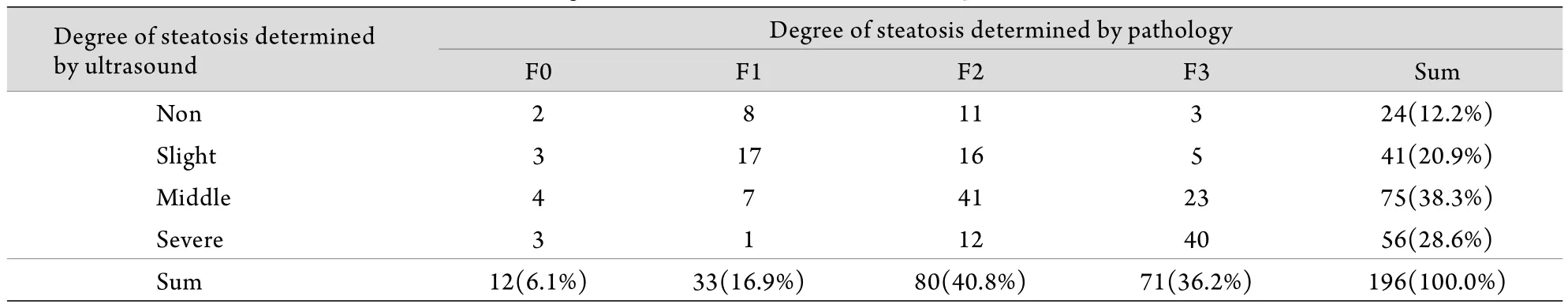
表2 NASH患者肝脏脂肪变性程度的构成情况(例)Tab.2 Degree of steatosis of liver in NASH patients (case)
2.6 NAFLD活动度积分(NAS)对NASH的诊断意义 参照非酒精性脂肪性肝病诊疗指南(2010年修订版)[8],根据肝细胞脂肪变﹑小叶内炎症和肝细胞气球样变行NAS积分计算,NAS<3分可排除NASH,NAS>4分可诊断NASH,介于两者之间者为NASH可能[11]。206例患者中有177例进行NAS评分,其中,NAS<3分者15例,占8.5%;3分≤NAS≤4分者97例,占54.8%;NAS>4分者65例,占36.7%。
2.7 不同纤维化程度NASH患者NAS积分比较纤维化程度S0﹑S1﹑S2﹑S3的NASH患者,其NAS积分分别为3.36±1.34﹑3.76±1.26﹑5.00±1.26﹑5.50±1.15,ANOVA分析表明,不同纤维化程度的NASH患者NAS积分存在统计学差异,即NAS积分越高,纤维化程度越重(P<0.01)。
3 讨 论
NAFLD是伴随转氨酶水平升高的肝细胞脂肪变性的最常见原因,存在于2.8%~5.5%的人群中[12],而NASH是NAFLD的进展期表现,可发展至肝硬化甚至肝癌。但多数NASH患者无临床表现,仅在进行常规实验室或影像学检查时偶然发现,其风险因子包括肥胖﹑糖尿病﹑胰岛素抵抗﹑血脂代谢紊乱和高血压[13-15]。本文对206例NASH患者进行回顾性分析发现,常见的临床症状包括乏力(20.4%),肝区隐痛(11.7%),食欲减退(5.8%),恶心(3.4%),皮肤巩膜黄染(2.4%),消化不良(1.0%),但这些症状并非NASH患者所特有,且与疾病的严重程度不成正比。
本研究结果显示,在NASH患者的各项检验指标中,以ALT﹑AST异常最为常见,其他检验指标基本正常。NASH患者ALT值为123.7±100.7U/L,AST值为63.9±43.9U/L,AST/ALT为0.61±0.31,与文献报道接近。虽然血清转氨酶水平的升高程度与发生NASH的可能性高度相关,但是并非NAFLD或NASH患者都伴有转氨酶升高,因此不能将其作为临床诊断的独立筛选工具[16-17]。
NAFLD被认为是代谢综合征的肝外表现,但并非NAFLD患者都同时存在代谢综合征。Hamaguchi等[18]对11 714名健康日本人进行的调查研究表明,在诊断为NAFLD的个体中,仅21%~33%同时被诊断为代谢综合征,且NAFLD患者代谢综合征发病率低的原因,是代谢综合征的诊断标准不够有效。另外一些研究提示,NAFLD患者代谢综合征的发生率为17%~36%[19-21]。NASH是NAFLD的进展期表现,本文数据表明NASH患者中仅有24.4%存在代谢综合征,17.1%体重正常,与文献报道接近,说明NASH患者中代谢综合征的发生率并未升高。
肝穿被认为是诊断NAFLD或NASH的金标准,但由于其为侵袭性操作,存在潜在的严重并发症,如内出血﹑腹膜炎﹑血肿﹑感染﹑气胸等,使其应用受限,且不宜作为筛选标准。核磁共振可确定非常少量的肝内脂肪聚积[22],但因价格昂贵,且需静脉对照,较难普及。目前应用较为广泛的腹部超声具有费用低﹑安全﹑不需静脉对照等优点,可作为一种初步评估肝脏脂肪变性的选择[23]。对于两个肝叶脂肪变性浸润达30%以上的患者,其敏感性可达60%~95%,特异性可达77%~100%[22]。本文196例行腹部超声检查的NASH患者中,有172例(87.8%)显示存在不同程度的脂肪肝,仅24例(12.2%)未提示存在脂肪肝。统计学分析表明,腹部超声与肝穿病理对脂肪变性程度的判断存在统计学差异。但是肝穿需要对1/50 000的肝脏进行组织学分析[24],抽样变异是其缺点之一。脂肪肝患者脂肪沉积的分布可能多种多样,因此单个的肝脏活检尚不能代表整个肝脏的疾病情况[25]。
NAS积分对NAFLD的病理学诊断参照美国国立卫生研究院NASH临床研究网病理工作组指南常规进行[9-11],其设计目的主要是为了获取治疗引起的组织学变化,但不应用于NASH诊断。本文对177例NASH患者进行了NAS评分,其中8.5%的患者NAS<3分,36.7%的患者NAS>4分,54.8%介于二者之间,NAS积分越高,纤维化程度越重。此外,本研究中纤维化程度达到S3及S4的患者比例为10.2%,应引起临床医生及患者本人的高度重视。
[1] Farrell GC, Larter CZ. Nonalcoholic fatty liver disease: from steatosis to cirrhosis[J]. Hepatology, 2006, 43(2 Suppl 1):S99-S112.
[2] De Alwis NM, Day CP. Nonalcoholic fatty liver disease: the mist gradually clears[J]. J Hepatol, 2008, 48(Suppl 1): S104-S112.
[3] Angulo P. GI epidemiology: nonalcoholic fatty liver disease[J].Aliment Pharmacol Ther, 2007, 25(8): 883-889.
[4] Zhang J, Zhao JM, Zhou GD, et al. Apoptosis of hepatocytes and the expression of Bax and Bcl-2 in nonalcoholic steato-hepatitis in rat[J]. Med J Chin PLA, 2008, 33(5): 521-523. [张静, 赵景民, 周光德, 等. 非酒精性脂肪性肝炎肝细胞凋亡及凋亡相关蛋白的表达[J]. 解放军医学杂志, 2008, 33(5): 521-523.]
[5] Lv CJ, Li H, Yang ZF. Role of lipid metabolism in nonalcoholic fatty hepatopathy[J]. J Logist Univ CAPF (Med Sci), 2013,22(2): 158-160. [吕成娇, 李海, 杨占福. 脂质代谢在非酒精性脂肪性肝病发病机制中的作用研究现状[J]. 武警后勤学院学报(医学版), 2013, 22(2): 158-160.]
[6] Fan JG, Farrell GC. Epidemiology of non-alcoholic fatty liver disease in China [J]. J Hepatol, 2009, 50(1): 204-210.
[7] Gao X. Nonalcoholic fatty liver disease and metabolic syndrome[J]. Chin J Pract Intern Med, 2011, 31(9): 664-667.[高鑫. 非酒精性脂肪性肝病与代谢综合征[J]. 中国实用内科杂志, 2011, 31(9): 664-667.]
[8] The Chinese National Work-shop on Fatty Liver and Alcoholic Liver Disease for the Chinese Liver Disease Association.Guidelines for management of nonalcoholic fatty liver disease:an updated and revised edition[J]. Chin J Gastroenterol Hepatol,2010, 19(6):483-487.[中华医学会肝病学分会脂肪肝和酒精性肝病学组. 非酒精性脂肪性肝病诊疗指南(2010年修订版)[J]. 胃肠病学和肝病学杂志, 2010, 19(6): 483-487.]
[9] Farrell GC, Chitturi S, Lau GK, et al. Guidelines for the assessment and management of non-alcoholic fatty liver disease in the Asia-Pacific region: executive summary[J]. J Gastroenterol Hepatol, 2007, 22(6): 775-777.
[10] Fan JG, Peng YD. Metabolic syndrome and non-alcoholic fatty liver disease: Asian definitions and Asian studies[J].Hepatobiliary Pancreat Dis Int, 2007, 6(6): 572-578.
[11] Kleiner DE, Brunt EM, Van Natta M, et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease[J]. Hepatology, 2005, 41(6): 1313-1321.
[12] Clark JM, Diehl AM. Defining nonalcoholic fatty liver disease:implications for epidemiologic studies[J]. Gastroenterology,2003, 124(1): 248-250.
[13] Angulo P. Nonalcoholic fatty liver disease[J]. N Engl J Med,2002, 346(16): 1221-1231.
[14] Clark JM, Brancati FL, Diehl AM. Nonalcoholic fatty liver disease[J]. Gastroenterology, 2002, 122(6): 1649-1657.
[15] Sanyal AJ. American Gastroenterological Association. AGA technical review on nonalcoholic fatty liver disease[J].Gastroenterology, 2002, 123(5): 1705-1725.
[16] Williams CD, Stengel J, Asike MI, et al. Prevalence of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis among a largely middle-aged population utilizing ultrasound and liver biopsy: a prospective study[J]. Gastroenterology, 2011,140(1): 124-131.
[17] Fracanzani AL, Valenti L, Bugianesi E, et al. Risk of severe liver disease in nonalcoholic fatty liver disease with normal aminotransferase levels: a role for insulin resistance and diabetes[J]. Hepatology, 2008, 48(3): 792-798.
[18] Hamaguchi M, Takeda N, Kojima T, et al. Identification of individuals with non-alcoholic fatty liver disease by the diagnostic criteria for the metabolic syndrome[J]. World J Gastroenterol, 2012, 18(13): 1508-1516.
[19] Hamaguchi M, Kojima T, Takeda N, et al. The metabolic syndrome as a predictor of nonalcoholic fatty liver disease[J].Ann Intern Med, 2005, 143(10): 722-728.
[20] Sung KC, Ryan MC, Wilson AM. The severity of nonalcoholic fatty liver disease is associated with increased cardiovascular risk in a large cohort of non-obese Asian subjects[J]. Atherosclerosis,2009, 203(2): 581-586.
[21] Karnikowski M, Córdova C, Oliveira RJ, et al. Non-alcoholic fatty liver disease and metabolic syndrome in Brazilian middleaged and older adults[J]. Sao Paulo Med J, 2007, 125(6): 333-337.
[22] Schwenzer NF, Springer F, Schraml C, et al. Non-invasive assessment and quantification of liver steatosis by ultrasound,computed tomography and magnetic resonance[J]. J Hepatol,2009, 51(3): 433-445.
[23] Charatcharoenwitthaya P, Lindor KD. Role of radiologic modalities in the management of non-alcoholic steatohepatitis[J]. Clin Liver Dis, 2007, 11(1): 37-54.
[24] Maharaj B, Maharaj RJ, Leary WP, et al. Sampling variability and its influence on the diagnostic yield of percutaneous needle biopsy of the liver[J]. Lancet, 1986, 1(8480): 523-525.
[25] Arun J, Jhala N, Lazenby AJ, et al. Influence of liver biopsy heterogeneity and diagnosis of nonalcoholic steatohepatitis in subjects undergoing gastric bypass[J]. Obes Surg, 2007, 17(2):155-161.

