华氏巨球蛋白血症:循证医学新进展及共识更新
侯健,彭利晖
华氏巨球蛋白血症(Waldenström macroglobulinemia,WM)属于罕见的B细胞淋巴瘤,年发病率为0.3/10万,在所有的B系淋巴瘤中占1%~2%,其主要特征为骨髓淋巴样浆细胞浸润、单克隆IgM血症。WM为惰性淋巴瘤,有临床症状的患者中位生存时间为5~6年。近几年,有关WM的发病机制和治疗研究进展很多,尤其是MYD88 L265P突变的发现将为WM的诊断和治疗带来实质性突破。
1 分子发病机制
2012年,Treon等[1]首次发现90%的WM患者髓样分化因子基因MYD88发生了单碱基突变,使其编码蛋白的265号氨基酸从亮氨酸变为脯氨酸(L265P),而WM患者的正常组织标本、健康人的外周血B细胞、骨髓瘤标本(包括IgM型骨髓瘤)中均未检测到该突变,边缘区淋巴瘤标本中只有少数检测出该突变。此后一系列研究通过Sanger测序、PCR、等位基因特异性PCR均发现在WM和IgM型意义未明的单克隆球蛋白增多症(monoclonal gammopathy of undetermined signi fi cance,MGUS)中,MYD88 L265P突变发生率很高[2-7]。
MYD88是Toll样受体(Toll-like receptor,TLR)和IL-1受体(interleukin-1 receptor,IL-1R)信号通路的调节分子。TLR或IL-1R活化后,募集MYD88使之二聚体化,再与IRAK激酶(IL-1R-associated kinase)4形成活化受体复合物,进一步激活IRAK1。肿瘤坏死因子受体相关因子6(TRAF-6)继之被激活,最终通过IκBα磷酸化导致核因子κB(nuclear factor κB,NF-κB)活化[1]。MYD88基因发生L265P突变后,在没有TLR及IL-1R信号刺激的情况下也能发生二聚体化,从而激活NF-κB,导致B细胞异常增殖。抑制MYD88/IRAK信号通路可以抑制NF-κB信号,并使具有MYD88 L265P突变的WM细胞生长受到抑制。具有L265P 突变的MYD88基因过表达则可促进WM细胞的生存[1,4],还可以促进Bruton酪氨酸激酶(bruton tyrosine kinase,BTK)磷酸化[8]。抑制MYD88可下调具有MYD88 L265P突变的WM细胞内的BTK活性。IRAK和BTK能独立调节下游NF-κB的活化,联合使用IRAK和BTK抑制剂可对有MYD88 L265P突变的WM细胞产生协同杀伤作用。因此,发生MYD88 L265P突变的WM细胞可能通过两条独立的通路即BTK和(或)IRAK1/IRAK4来激活NF-κB[9]。
IgM型MGUS中也存在这种类型的突变,发生率可高达87%[2-3,10]。具有MYD88 L265P突变的IgM型MGUS演变为WM或边缘区淋巴瘤的风险更高[3]。与MYD88为野生型的WM比较,有MYD88 L265P突变的WM患者的治疗反应率、总生存率、无进展生存率并无差异,但具有独特的临床特点,如血清IgM水平更高、外周血淋巴细胞计数更高[10]。MYD88 L265P突变可能是促进WM发生的早期致癌事件。通过全基因组测序可发现其他体细胞突变,这些突变可能促进了IgM型MGUS向WM的演变[1,9]。
2 临床表现
WM的临床表现可分为两类:组织浸润的表现,如贫血、全身症状、器官肿大;单克隆IgM引起的损害,包括高黏滞综合征、冷球蛋白血症、自身免疫损害(如周围神经病变、冷凝集素病),淀粉样变性很少见。少数患者在初诊时没有症状,因为其他一些与WM无关的原因进行检测时才发现单克隆IgM增高[11]。
3 诊断、鉴别诊断
现在临床上仍然广泛沿用2002年第二届WM国际工作组制定的WM诊断标准,即:单克隆IgM血症(IgM浓度不限);骨髓小淋巴细胞、淋巴样浆细胞和浆细胞浸润;骨髓浸润呈弥漫性、间质性或结节性;免疫表型特点为sIgM+、CD19+、CD20+,而CD5、CD10、CD23大多为阴性,但有10%~20%的患者可能为阳性[12]。2008年WHO制定了WM新的诊断标准:淋巴浆细胞性淋巴瘤并骨髓侵犯、单克隆IgM血症(IgM浓度不限)。WM分为两种类型:有症状型和无症状型。
WM需要与其他产生单克隆IgM的淋巴系统肿瘤鉴别(表1)。MYD88 L265P突变的检测将为WM的诊断和鉴别诊断提供全新的依据。IgM型MGUS是需要与WM鉴别的疾病之一。IgM型MGUS与无症状WM的区别在于骨髓活检是否有明确的淋巴样浆细胞侵犯。研究发现:骨髓B细胞比例大于10%的患者在IgM型MGUS患者中占1%,而在无症状WM患者中占34%,在有症状WM患者中占55%;骨髓B细胞为轻链限制型的患者在IgM型MGUS患者中仅占1%,而在无症状WM患者中占19%,在有症状WM患者中占40%[13]。因此,应用流式细胞术对骨髓B细胞比例和抗体免疫表型进行检测有助于区别IgM型MGUS和无症状WM。
4 治 疗
4.1 指南更新 并非所有的WM患者都需要接受治疗。2002年第二届WM国际工作组确定的治疗指征如下:明显的B症状,如反复发热、盗汗、体重减轻;单克隆IgM引起的损害,如高黏滞表现,神经病变,淀粉样变,肾功能不全,冷凝集素病,冷球蛋白血症;肿瘤浸润的表现,如进行性器官肿大,淋巴结显著肿大,骨髓侵犯致全血细胞减少(血红蛋白<100g/L,血小板<100×109/L)[14]。2013年版NCCN指南推荐的治疗包括烷化剂、核苷类似物、硼替佐米、利妥昔单抗[13]。目前尚没有针对WM的特异性药物,对于初诊患者也缺乏标准的一线治疗方案。
4.2 循证医学证据 由于WM病例数少,所以针对WM开展的随机对照试验(randomized controlled trial,RCT)有限。第一个针对初治WM的小样本RCT比较了瘤可宁间断服用[0.3mg/(kg·d),每6周连续服用7d]和持续服用[0.1mg/(kg·d)]的差别,结论是持续服用瘤可宁的患者其总反应率(overall response rate,ORR)更高,为75%,但中位总生存(overall survival,OS)并无差异[15]。2009年Buske等[16]报道,在CHOP方案(环磷酰胺、阿霉素、长春新碱、泼尼松)的基础上加用利妥昔单抗可提高初治WM(n=48)的治疗效果,利妥昔单抗+CHOP方案组的总反应率为91%,而CHOP方案组为60%。前者的至治疗失败中位时间(time to treatment failure,TTTF)更长(63个月 vs 22个月)。
Leblond等[17-18]研究者的两个RCT均显示氟达拉滨治疗WM具有良好疗效。第一个研究比较了氟达拉滨和CAP方案(环磷酰胺、阿霉素、泼尼松)治疗复发难治WM的疗效,氟达拉滨组的部分反应率(partial response,PR)、反应持续时间(duration of response,DR)及无事件生存(event free survival,EFS)更长[17]。第二个研究发表于2013年,是迄今为止最大规模的针对WM的Ⅲ期RCT,比较了口服氟达拉滨与瘤可宁治疗WM的疗效差别。该试验有5个国家的101个中心参与,共纳入339例初治WM患者。通过意向治疗分析,氟达拉滨组和瘤可宁组的ORR没有统计学差异(分别为47.8%、38.6%,P=0.07)。中位随访期为36个月,氟达拉滨组的中位DR、无进展生存(progression free survival,PFS)、OS均明显高于瘤可宁组(中位DR,38.5个月vs 21.3个月,P=0.0024;中位PFS,37.8个月 vs 27.1个月,P=0.015;中位OS,氟达拉滨组未达中位分析,而瘤可宁组为69.8个月,P=0.014)。氟达拉滨组3至4级中性粒细胞减少的比例明显高于瘤可宁组(36% vs 17.8%,P<0.001)。瘤可宁组的6年累积二次肿瘤发生率明显高于氟达拉滨组(20.6% vs 3.7%,P<0.001)。该研究表明,与使用瘤可宁相比,治疗初治WM单用氟达拉滨尽管骨髓抑制更重,但能改善长期生存[18]。
以上RCT结果表明,利妥昔单抗和氟达拉滨治疗WM具有良好疗效,因此这两种药物成为NCCN指南推荐的主要治疗用药。由于氟达拉滨具有潜在的干细胞毒性和导致二次肿瘤的可能,所以需要自体移植或年轻患者不推荐使用。关于利妥昔单抗、核苷类似物、蛋白酶体抑制剂等治疗WM,目前已有许多非对照研究的报道。这些药物均提高了WM的反应率,可改善其长期生存,但缺乏随机对照研究证实。前述氟达拉滨与瘤可宁比较的RCT研究,可供将来的临床研究参考[19]。目前关于抑制MYD88信号通路的药物还在研究中。
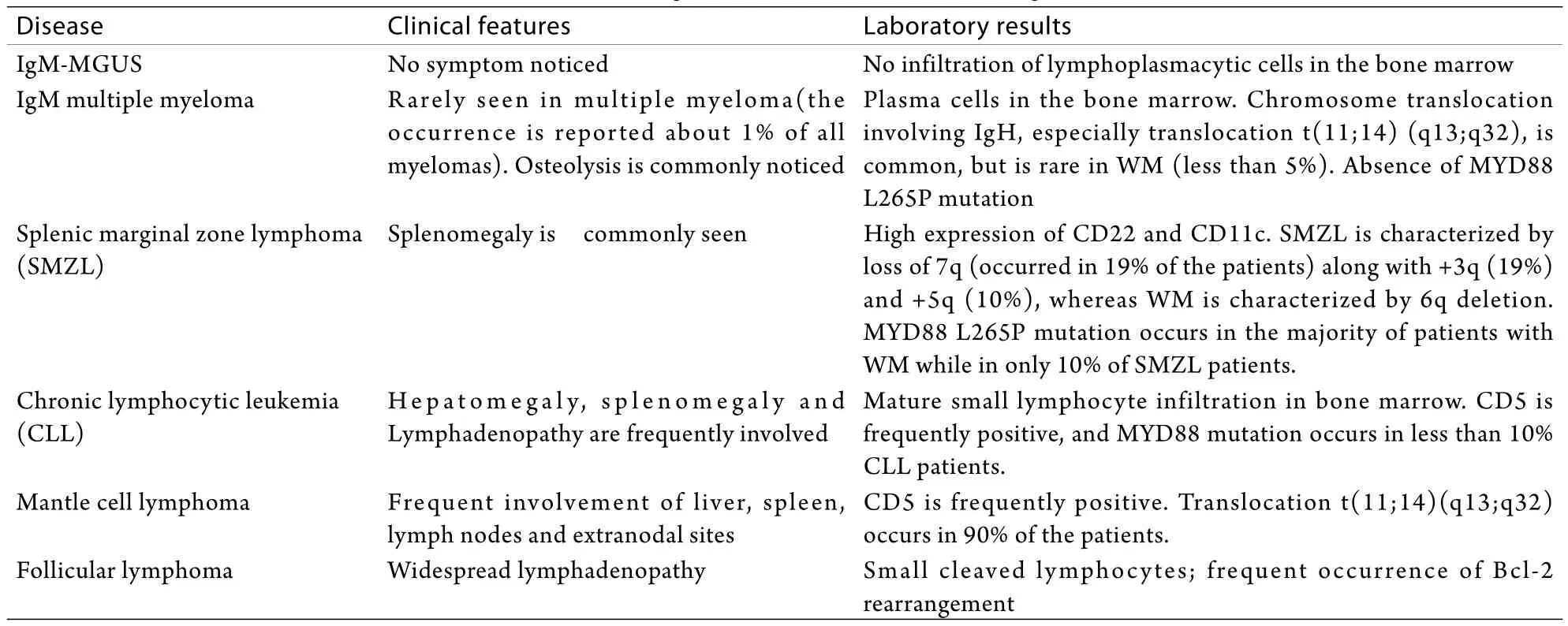
表1 华氏巨球蛋白血症的鉴别诊断Tab. 1 Differential diagnosis for Waldenström macroglobulinemia
5 疗效评估
2010年第6次WM国际工作组制定了最新版WM疗效评估标准[20],新增加了“非常良好的部分反应”(very good partial response,VGPR)这一项评价指标。该标准还有待继续改进。第一,血清游离轻链并未被纳入WM疗效评估中,而研究表明,该指标能更早期地提示WM的治疗反应以及疾病进展[21-22];第二,单克隆IgM相关损害如神经病变、冷球蛋白血症、冷凝集素病等并未纳入疗效评估,可能需要进一步研究特异的评价标准以评估这些并发症的治疗反应;第三,在治疗前和治疗后,通过定量PCR的方法检测患者骨髓或外周血中MYD88 L265P拷贝数的变化,可以为WM疗效监测提供新的敏感指标[9]。
目前尚不清楚让患者获得最大治疗反应是否一定能延长患者的生存期。获得最大反应可能会增加毒性,而不能带来更长期的生存[11]。研究表明,使用利妥昔单抗的患者,即使只是获得微效(minor remission,MR),也能改善长期生存,与达到更高级别反应的患者相比,其OS和PFS并无明显差异[23]。而前述氟达拉滨与瘤可宁比较的RCT研究表明,尽管两者的反应率没有统计学差异,但DR、PFS、OS在氟达拉滨组却得到显著延长[18]。因此,短期的治疗反应并不一定就能预测长期生存率。
6 预后评估
最新的预后分级是2009年发表的WM国际预后分级(International Prognostic Staging System for Waldenström Macroglobulinemia,IPSSWM)。该分级方法基于一项针对587例WM患者的研究,纳入了5个危险因素:年龄>65岁,血红蛋白<115g/L,血小板<100×109/L,血β2-微球蛋白>3mg/L,单克隆IgM>70mg/L。根据上述5个危险因素将WM分为3个预后组:低危组(年龄≤65岁,无或1个危险因素),中危组(年龄>65岁,或2个危险因素),高危组(>2个危险因素)。这三组患者的中位生存时间分别为142.5、98.6、43.5个月[24]。但进入该研究的患者接受的治疗几乎全都是烷化剂、核苷类似物,仅4%的患者接受了利妥昔单抗。而在目前临床实践中,利妥昔单抗和蛋白酶体抑制剂已被广泛使用,用这些药物治疗的WM患者是否仍然能用上述预后分级方法进行分级仍有待研究。值得注意的是,IPSSWM只能用于需要治疗的患者,不能用于判断哪些患者需要治疗,后者仍然需要根据临床情况综合判断。
7 展望
尽管WM的诊断和治疗近年来取得了一些进步,但WM仍然属于诊断较难且无法治愈的慢性淋巴系统肿瘤。在未来的诊断标准中,有望将MYD88基因的L265P突变检测纳入其中,以帮助鉴别其他产生单克隆IgM的淋巴系肿瘤。通过进一步研究,有望找到针对MYD88基因及其下游信号分子的特异靶向治疗药物。由于WM属于少见疾病,多中心的协作研究有助于得出更可靠的结论,从而为该病的诊治提供更多的循证医学证据。
[1] Treon SP, Xu L, Yang G, et al. MYD88 L265P somatic mutation in Waldenström's macroglobulinemia[J]. N Engl J Med, 2012, 367(9): 826-833.
[2] Xu L, Hunter ZR, Yang G, et al. MYD88 L265P in Waldenström macroglobulinemia, immunoglobulin M monoclonal gammopathy, and other B-cell lymphoproliferative disorders using conventional and quantitative allele-specific polymerase chain reaction[J]. Blood, 2013, 121(11):2051-2058.
[3] Varettoni M, Arcaini L, Zibellini S, et al. Prevalence and clinical significance of the MYD88 (L265P) somatic mutation in Waldenström's macroglobulinemia and related lymphoid neoplasms[J]. Blood, 2013, 121(13): 2522-2528.
[4] Poulain S, Roumier C, Decambron A, et al. MYD88 L265P mutation in Waldenström macroglobulinemia[J]. Blood, 2013, 121(22): 4504-4511.
[5] Willenbacher W, Willenbacher E, Brunner A, et al. Improved accuracy of discrimination between IgM multiple myeloma and Waldenström macroglobulinaemia by testing for MYD88 L265P mutations[J]. Br J Haematol, 2013, 161(6): 902-904.
[6] Varettoni M, Zibellini S, Capello D, et al. Clues to the pathogenesis of Waldenström macroglobulinemia and IgM-MGUS provided by the analysis of immunoglobulin heavy chain gene rearrangement and clustering of B-cell receptors[J]. Leuk Lymphoma, 2013, [Epub ahead of print].
[7] Gachard N, Parrens M, Soubeyran I, et al. IGHV gene features and MYD88 L265P mutation separate the three marginal zone lymphoma entities and Waldenström macroglobulinemia/lymphoplasmacytic lymphomas[J]. Leukemia, 2013, 27(1): 183-189.
[8] Yang G, Zhou Y, Liu X, et al. A mutation in MYD88 (L265P) supports the survival of lymphoplasmacytic cells by activation of Bruton tyrosine kinase in Waldenström macroglobulinemia[J]. Blood, 2013, 122(7): 1222-1232.
[9] Treon SP, Hunter ZR. A new era for Waldenström macroglobulinemia: MYD88 L265P[J]. Blood, 2013, 121(22): 4434-4436.
[10] Jimenez C, Sebastian E, Del Carmen Chillon M, et al. MYD88 L265P is a marker highly characteristic of, but not restricted to, Waldenström's macroglobulinemia[J]. Leukemia, 2013, [Epub ahead of print].
[11] Johnson SA, Birchall J, Luckie C, et al. Guidelines on the management of Waldenström macroglobulinaemia[J]. Br J Haematol, 2006, 132(6):683-697.
[12] Owen RG, Treon SP, Al-Katib A, et al. Clinicopathological definition of Waldenström's macroglobulinemia: consensus panel recommendations from the Second International Workshop on Waldenström's Macroglobulinemia[J]. Semin Oncol, 2003, 30(2): 110-115.
[13] Anderson KC, Alsina M, Bensinger W, et al. Waldenström's macroglobulinemia/lymphoplasmacytic lymphoma, version 2.2013[J]. J Natl Compr Canc Netw, 2012, 10(10): 1211-1219.
[14] Kyle RA, Treon SP, Alexanian R, et al. Prognostic markers and criteria to initiate therapy in Waldenström's macroglobulinemia: consensus panel recommendations from the Second International Workshop on Waldenström's Macroglobulinemia[J]. Semin Oncol, 2003, 30(2): 116-120.
[15] Kyle RA, Greipp PR, Gertz MA, et al. Waldenström's macroglobulinaemia: a prospective study comparing daily with intermittent oral chlorambucil[J]. Br J Haematol, 2000, 108(4): 737-742.
[16] Buske C, Hoster E, Dreyling M, et al. The addition of rituximab to front-line therapy with CHOP (R-CHOP) results in a higher response rate and longer time to treatment failure in patients with lymphoplasmacytic lymphoma: results of a randomized trial of the German Low-Grade Lymphoma Study Group (GLSG)[J]. Leukemia, 2009, 23(1): 153-161.
[17] Leblond V, Levy V, Maloisel F, et al. Multicenter, randomized comparative trial of fludarabine and the combination of cyclophosphamidedoxorubicin-prednisone in 92 patients with Waldenström macroglobulinemia in first relapse or with primary refractory disease[J]. Blood,2001, 98(9): 2640-2644.
[18] Leblond V, Johnson S, Chevret S, et al. Results of a randomized trial of chlorambucil versus fludarabine for patients with untreated Waldenström macroglobulinemia, marginal zone lymphoma, or lymphoplasmacytic lymphoma[J]. J Clin Oncol, 2013, 31(3): 301-307.
[19] Ghobrial IM. Choice of therapy for patients with Waldenström macroglobulinemia[J]. J Clin Oncol, 2013, 31(3): 291-293.
[20] Owen RG, Kyle RA, Stone MJ, et al. Response assessment in Waldenström macroglobulinaemia: update from the VIth International Workshop[J]. Br J Haematol, 2013, 160(2): 171-176.
[21] Itzykson R, Le Garff-Tavernier M, Katsahian S, et al. Serum-free light chain elevation is associated with a shorter time to treatment in Waldenström's macroglobulinemia[J]. Haematologica, 2008, 93(5): 793-794.
[22] Leleu X, Moreau AS, Weller E, et al. Serum immunoglobulin free light chain correlates with tumor burden markers in Waldenström macroglobulinemia[J]. Leuk Lymphoma, 2008, 49(6): 1104-1107.
[23] Gertz MA, Abonour R, Heffner LT, et al. Clinical value of minor responses after 4 doses of rituximab in Waldenström macroglobulinaemia: a follow-up of the Eastern Cooperative Oncology Group E3A98 trial[J]. Br J Haematol, 2009, 147(5): 677-680.
[24] Morel P, Duhamel A, Gobbi P, et al. International prognostic scoring system for Waldenström macroglobulinemia[J]. Blood, 2009, 113(18):4163-4170.

