脑必通胶囊对局灶性脑缺血大鼠脑血流量及内皮细胞iNOS表达的影响
秦媛媛, 杨 磊, 张慧灵, 沈夕坤
(1.苏州中医医院,江苏 苏州 215009;2.苏州大学药理学教研室,脑血管病药理研究室,江苏 苏州 215123)
脑中风是一组以脑部缺血及出血性损伤症状为主要临床表现的疾病,又称脑卒中或脑血管意外,主要分为出血性脑中风 (脑出血或蛛网膜下腔出血)和缺血性脑中风(脑梗死、脑血栓形成)两大类,以脑梗死最为常见。目前中医对于缺血性脑中风常用活血化瘀、益气活血等药物进行治疗[1]。脑必通胶囊是由红景天、三七、川芎和银杏叶四味中药组成的复方制剂,每种成分从天然植物的提取物精制而成,有助于促进血气循环、活脑宁神。本实验室前期工作已证明脑必通胶囊对大鼠永久性大脑中动脉阻塞所致的脑中风具有保护作用 (待发表)。但脑必通胶囊对脑血流量及其血管内皮细胞是否有影响,尚未见文献报道。本实验探讨脑必通胶囊对局灶性脑缺血大鼠脑血流量的影响及其诱导内皮细胞诱导型一氧化氮合酶 (iNOS)表达的机制。
1 材料
1.1 实验动物及细胞 SD大鼠,雄性,体质量280~310 g,清洁级。由苏州大学医学院实验动物中心提供[生产许可证 XCYK(苏):2002-2008),使用许可证 SYXK(苏):2002-0037]。人脐静脉内皮细胞 (HUVEC)由ScienCell研究室提供。
1.2 药物及试剂 脑必通胶囊,香港保健协会提供,批号为3GB081001。实验前用0.5% 羧甲基纤维素钠 (CMC)配制。红四氮唑 (TTC),由国药生产,批号:RA1881;水合氯醛,五联化工厂 (中国上海),批号:w20021122;多聚甲醛,天津市化学试剂研究所产品,批号:20020308,iNOS兔多克隆抗体,武汉博士德公司产品。
1.3 仪器 电子天平 (AL104 Mettler-Toledo公司)。动物脑立体定位仪;激光多普勒血流仪 (ML191 ADInstruments公司);缺氧培养气室 (MIC-101,Billups-Rothenberg);电泳仪 (power PAC 2000,Biorad公司);X光自动洗片机(X-OMAT2000,美国KODAK公司);离心机 (5810R,德国Eppendorf公司);基因扩增仪 (MyCycler Thermal Cycler,美国BIORAD公司)。
2 方法
2.1 分组和给药 取60只SD雄性大鼠,体质量 (280±20)g,苏州大学医学院实验动物中心提供。随机分成6组,每组10只。(1)对照组:每天灌以0.5%CMC,假手术后24 h处死。(2)模型组:缺血24 h后处死。(3)脑必通大剂量组:按350 mg/(kg·d)剂量灌胃;脑必通中剂量组:按175 mg/(kg·d)剂量灌胃;脑必通小剂量组:按87.5 mg/(kg·d)剂量灌胃。(4)复方丹参滴丸阳性对照组:按67.5 mg/(kg·d)灌胃。各组均以1 mL/100 g体积灌服,连续7 d,末次给药2 h后进行手术,用于实验。
2.2 对永久性大脑中动脉阻塞 (pMCAO)模型大鼠脑血流量的影响 将麻醉大鼠头部固定于脑立体定位仪上,沿颅骨正中偏右切开皮肤及皮下组织,在大鼠前囟后1.5 mm,中线右侧旁开5 mm处钻一个直径1 mm的小孔,该点为大脑中动脉缺血中心区[2]。沿小孔插光纤探头到大脑皮层表面,用血流仪配套的固定器固定光纤探头,监测脑中动脉缺血 (MCAO)前的基础值 (手术前)、MCAO后脑血流值 (手术后),稳定5 min后开始记录数据。
2.3 含药血清的制备 SD大鼠随机分成4组,每组3只,即 (1)正常对照组;(2)脑必通胶囊0.44 g/kg组 (小剂量);(3)脑必通胶囊0.88 g/kg组 (中剂量);(4)脑必通胶囊1.76 g/kg组 (大剂量)。
每组按1 mL/100 g灌胃,每天2次,连续3 d,第4天灌药后1 h,乙醚麻醉,腹主动脉取血,3 000 r/min离心10 min,取血清,经56℃ 30 min灭活后,过滤灭菌,-80 ℃保存备用[3]。
2.4 氧糖剥夺模型的建立 先将培养HUVEC细胞的培养液换成无糖DMEM培养基,然后转移置缺氧培养气室中,同时打开有白色塑料钳夹的聚丙烯管道的进气口和出气口,将入口处的聚丙烯管道于包含有所需的混合气体的源头相连,向气室内充入95%的N2和5%的CO2气体,将气流自动控制在每分钟20 L,大约4 min气室被完全充满后,切断气体来源,关上白色的塑料钳夹以紧闭气室,最后将这个气室置于37℃温育。氧糖剥夺的时间分别是1、3、6、12、24 h。
2.5 Real-Time PCR HUVEC细胞经氧糖剥夺处理后,利用TRIzol法提取总RNA,紫外分光光度计测定RNA量。本实验采用的引物由宝生物工程 (大连)有限公司设计,上海皓嘉生物科技有限公司合成。引物序列如下:
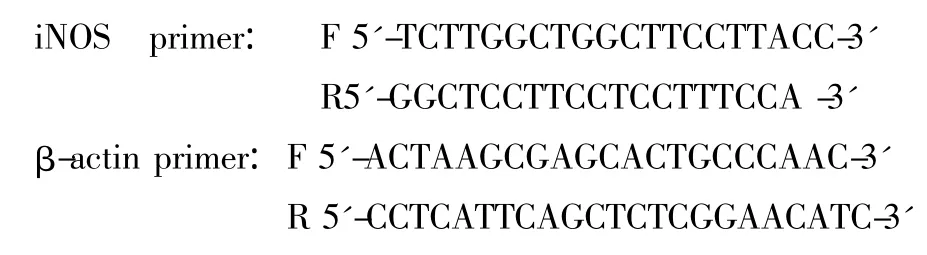
HUVEC细胞经氧糖剥夺处理后3 h,收集置离心管,1 200 r/min离心5 min。弃上清并将其转移至EP管中,加入1 mL trizol室温静置5 min,12 000 r/min 4℃离心5 min。小心吸取上清液,移入新的离心管中 (切勿吸取沉淀)。小心吸取上清液,向EP管中加入三氯甲烷 (RNAiso Reagent的1/5体积量),盖紧离心管盖,用力震荡。待充分乳化溶液呈乳白状后,室温静置5 min。从离心机中小心取出离心管,此时匀浆液分为三层,即无色的上清液、中间的白色蛋白层及带有颜色的下层有机相。吸取上清液转移至另一新的离心管中。向上清中加入等体积的异丙醇,上下颠倒离心管充分混匀后,在15~30℃下静置 10 min,离心。
2.6 Western Blotting HUVEC细胞经氧糖剥夺处理后,用超声波细胞破碎仪在冰浴下超声裂解细胞,-80℃ 保存备用。取1 μL蛋白质溶液,用BCA蛋白定量试剂盒测定以上所提取的蛋白浓度,调整上样量,使各组蛋白总量一致,按次序上样,安排已知分子量的标准物,电泳结束后,用蛋白转移装置将蛋白转到硝酸纤维素膜上,按转移蛋白的常规方法进行。
转移终了,凝胶进行蛋白染色液染色、脱色液脱色,以确定胶中蛋白质的转移情况。膜用TBST漂洗后。转移结束后,以TBST洗膜,室温摇动。将硝酸纤维素膜加入封闭液中置常温摇动。封闭结束后,将硝酸纤维素膜放入一塑料袋中,按每平方厘米膜加0.1 mL一抗溶液 (iNOS稀释度为1∶500,5%脱脂牛奶溶于TBST中),混匀后装入袋中,去除带内所有气泡,用封膜机封上开口,4℃过夜。弃去反应液,TBST洗3次,每次10 min。在膜上加入二抗:IgG-HRP溶液 (1∶5 000,5%脱脂牛奶溶于 TBST中),室温下轻轻振荡1 h取出膜,在PBS中洗膜3次,每次10 min。ECl显色,压片。
2.7 免疫荧光法 HUVEC细胞经氧糖剥夺处理后,用PBS洗涤3次;每孔加入1%BSA,室温下避光摇1 h;每组相应各孔加入相应蛋白的第一抗体iNOS(1∶400),室温下振摇1 h,4℃孵育过夜;用PBS漂洗3次,加第二抗体,室温下振摇1 h,PBS漂洗3次,贴片,封片,荧光显微镜和共聚焦显微镜下观察,摄片。
3 结果
3.1 对pMCAO大鼠局部相对脑血流量的影响 假手术组大鼠脑血流量无明显改变。脑必通胶囊 175 mg/kg、350 mg/kg给药7 d后显著增加大鼠的基础局部相对脑血流量(rCBF)(图A1~A6,1B)。模型组rCBF降低至术前的9.79%,脑必通胶囊 87.5 mg/kg、175 mg/kg、350 mg/kg组rCBF分别降低至术前的13.35%、14.73%、16.66%,与模型组相比,脑必通胶囊中、大剂量组具有显著性差异(图1A,图1C;P<0.05,P<0.01)。脑必通小剂量组pMCAO后与模型组比较亦有增高趋势,但未达到统计学上的显著水平 (图1A1~A6,图1C),提示脑必通胶囊可以增加大鼠基础及pMCAO后脑血流量。见图1。
3.2 HUVEC细胞氧糖剥夺后iNOS mRNA表达时程变化及脑必通胶囊含药血清对iNOS mRNA的表达影响 Real-Time PCR结果显示:对照组HUVEC细胞iNOS mRNA表达较少,HUVEC细胞氧糖剥夺3 h,iNOS mRNA表达显著增加(P<0.01),氧糖剥夺6 h、12 h、24 h iNOS mRNA表达较对照仍有较高表达 (P<0.05)。结果见图2A。
为了证明脑必通胶囊含药血清能否上调HUVEC细胞氧糖剥夺后iNOS mRNA的表达,采用Real-Time PCR观察脑必通胶囊含药血清对HUVEC细胞氧糖剥夺后iNOS mRNA表达的影响。结果证明:对照组HUVEC细胞iNOS mRNA表达较少,HUVEC细胞氧糖剥夺3 h iNOS mRNA表达较对照显著上调 (P<0.05,P<0.01),脑必通胶囊含药血清大、中剂量组iNOS mRNA的表达较模型组显著上调(P<0.01)。结果提示:脑必通胶囊含药血清可上调HU-VEC细胞氧糖剥夺后iNOS mRNA的表达。结果见图2B。
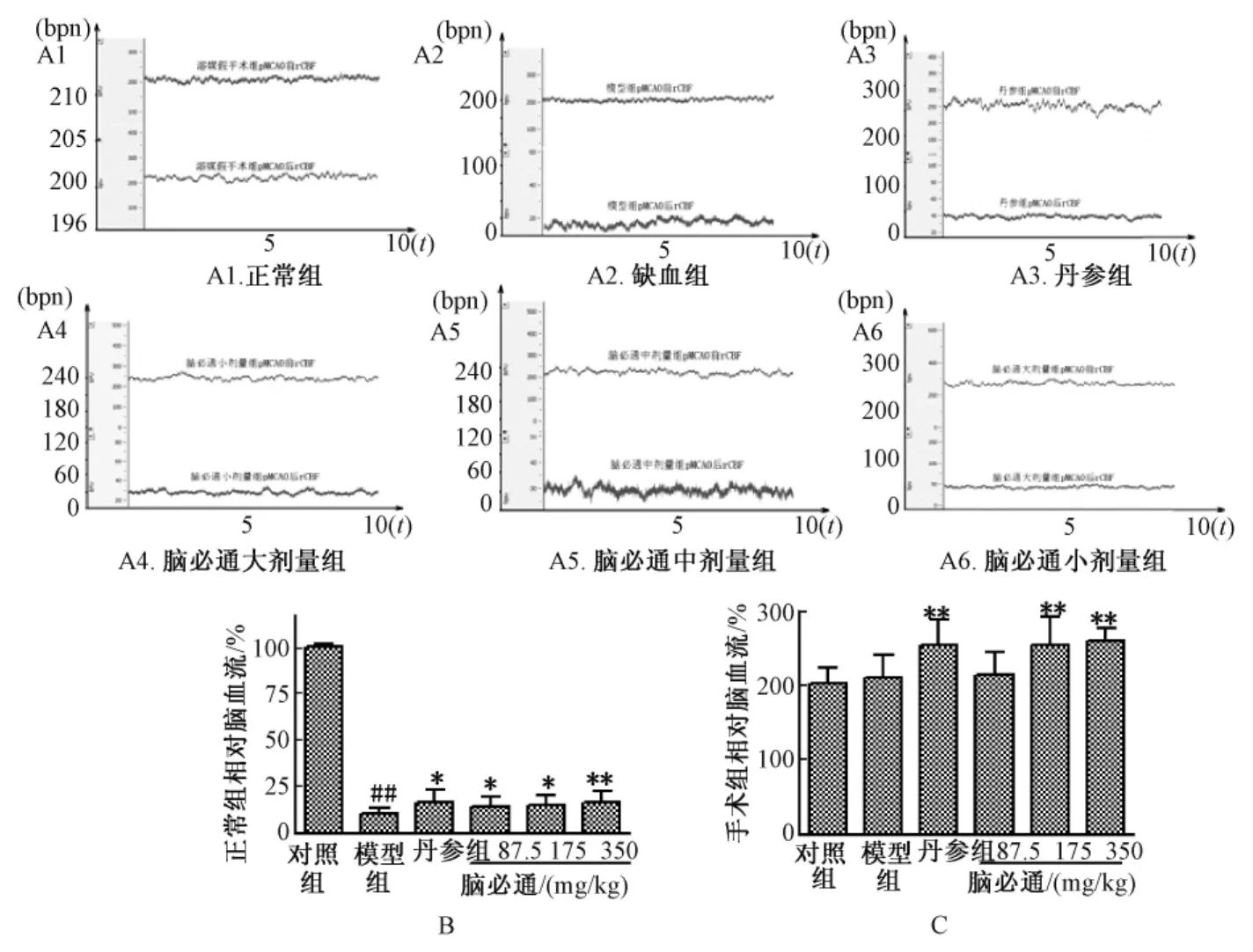
图1 相对脑血流量的变化
3.3 HUVEC细胞氧糖剥夺后iNOS蛋白表达的时程变化以及脑必通胶囊含药血清对iNOS蛋白表达的影响 Western blotting结果显示:对照组HUVEC细胞iNOS的蛋白量较低,氧糖剥夺处理组iNOS的蛋白量显著增加 (P<0.01),氧糖剥夺3 h、6 h、12 h组与对照组比较有显著性差异 (P<0.01),其中氧糖剥夺12 h组,iNOS的蛋白量到达高峰,氧糖剥夺24 h组iNOS蛋白量下降至接近于对照组水平。结果见图3A,3C。
Western blotting结果同样显示:对照组HUVEC细胞iNOS的蛋白量较低;氧糖剥夺3 h、6 h、12 h组iNOS的蛋白量显著增加 (P<0.01);其中氧糖剥夺12 h组iNOS的蛋白量最高,脑必通胶囊含药血清中、大剂量组可显著增加iNOS的蛋白量 (P<0.01),并呈现较好的剂量依赖性。提示脑必通胶囊含药血清可增加HUVEC细胞氧糖剥夺后的iNOS蛋白量。结果见图3B,3D。
免疫荧光结果显示:对照组HUVEC细胞iNOS的表达量少,荧光极弱,主要分布在细胞浆;氧糖剥夺1 h组iNOS胞浆表达明显增强,核内可见少量荧光;氧糖剥夺3 h组iNOS胞浆内荧光强度增加,部分细胞胞核内可见较多荧光颗粒,氧糖剥夺6 h、12 h组,细胞浆内荧光更强,细胞核内可见大量荧光颗粒,以氧糖剥夺12 h组表达最强;氧糖剥夺24 h后荧光变弱,弥散在细胞内,但仍可见细胞核内有荧光颗粒。结果见图4A。
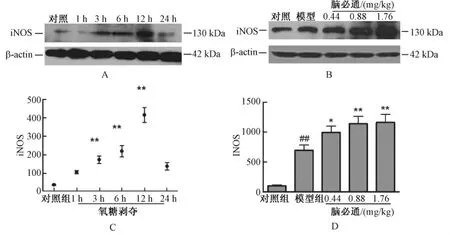
图3 HUVEC细胞氧糖剥夺后iNOS蛋白水平的表达以及脑必通胶囊对iNOS蛋白表达的影响
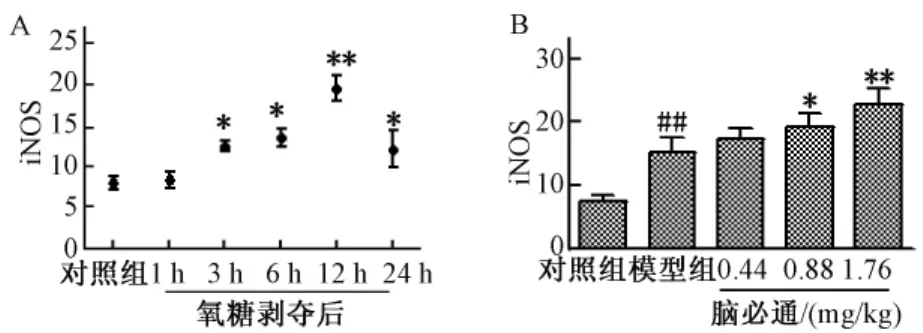
图4 HUVEC细胞氧糖剥夺后iNOS的表达以及脑必通胶囊对iNOS表达的影响
免疫荧光结果显示:对照组HUVEC细胞iNOS的表达量少,荧光极弱,主要分布在细胞浆;氧糖剥夺12 h组,细胞核内可见大量荧光颗粒,细胞浆内荧光强度显著增加,脑必通胶囊含药血清大、中剂量组可显著增加细胞内iNOS的荧光强度,大剂量组荧光颗粒增多明显 (P<0.01,P<0.05)。提示脑必通胶囊含药血清可增强HUVEC细胞氧糖剥夺后所致的iNOS的表达。结果见图4B。
4 讨论
脑必通胶囊是用天然植物川芎、银杏叶等提取物精制而成,其总黄酮量达26.7%,有助于促进血气循环、活脑宁神。虽然对中药防治脑缺血的研究较多,但目前关于脑必通胶囊对局灶性脑缺血大鼠脑血流量的影响及其诱导内皮细胞iNOS的表达的机制,尚未见文献报道。
当脑血流降低到代谢物质的运输不足以满足代谢的需要时,即发生脑缺血损伤。脑缺血的中心问题是氧和能量的耗竭,因此及早增加脑组织氧和血液的供应量是防治缺血性脑损伤的关键。应尽早改善并维持缺血组织局部有效的供血,改善脑微循环障碍,减轻神经元损伤[4]。激光多普勒血流测量 (LDF)可以无损伤性的快速反馈血流量的变化信息,可以连续、实时加监测神经组织微循环血流量,其测量范围小,可以精确的动态反映局部组织的微循环的血流动力学[5]。本实验运用大鼠pMCAO模型研究了脑必通胶囊对脑缺血的影响,发现预先给药350、175、87.5 mg/kg 1周,可显著增加基础及脑缺血后缺血局部脑血流量。脑必通胶囊的组成成分红景天、三七、川芎和银杏叶具有改善血液流变学指标及抑制血小板聚集的作用,这些作用可能是脑必通胶囊增加脑血流量的机制之一。但脑必通胶囊对内皮细胞是否有直接作用?
NO是目前公认的一种信息传递分子,在脑缺血损伤中具有神经保护和神经毒性双重作用[6]:即在脑缺血早期表现出保护作用,但NO浓度持续性增高可导致DNA和线粒体的功能损害,后期表现为神经毒性作用[7]。脑缺血早期产生的NO可通过激活鸟苷酸环化酶使cGMP水平升高,扩张脑血管,从而增加缺血区脑血流,保护脑组织[6]。由于NO化学性质活泼,不易准确定量测定,其生物作用又完全依赖于NOS的活性,因而其合成酶一氧化氮合成酶(NOS)成为近年缺血性脑血管疾病研究的热点。根据组织来源不同,NOS可分为神经元细胞型 (nNOS)、内皮细胞型 (eNOS)、诱导型 (iNOS)。诱导型NOS(iNOS)[6],广泛存在于小胶质细胞、星形胶质细胞、中性细胞、巨噬细胞等多种细胞中。iNOS是一种非Ca2+依赖性的酶,在生理情况下,iNOS并不表达,但在病理情况下,一些细胞可诱导基因转录,启动蛋白质合成,生成iNOS,故诱导数小时后才显示酶活力,且由于iNOS受DNA转录调节,一经诱导,长时间保持酶活力。iNOS基因表达调控区有低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)的结合位点,HIF-1是缺氧调节iNOS基因表达所必需的[2],血管内皮细胞缺氧时iNOS基因表达增加[2]。
本实验应用低糖结合物理性缺氧诱导氧糖剥夺所致内皮细胞损伤模型可模拟脑缺血损伤的具体过程[9]。本实验结果表明:HUVEC细胞氧糖剥夺后早期观察到iNOS mRNA的上调;亦观察了HUVEC细胞氧糖剥夺后,iNOS蛋白的激活及核转位的变化。HUVEC细胞氧糖剥夺后iNOS蛋白量即开始有所增加,并随氧糖剥夺时间推移而逐渐增强,于12 h达高峰,24 h有所下降[2]。本实验观察了预先给予脑必通胶囊含药血清,HUVEC细胞氧糖剥夺后iNOS的表达变化。实验结果表明,脑必通胶囊含药血清可显著上调iNOS mRNA表达;增加HUVEC细胞氧糖剥夺后iNOS的蛋白水平[2,11]。结果提示脑必通胶囊增加大鼠局部脑血流量可能与其增加内皮细胞iNOS的表达,从而扩张脑血管有关[11]。
本课题组最近的实验结果表明 (待发表):脑必通胶囊对脑缺血的保护作用与其激活内皮细胞HIF-1信号通路有关[12]。大量研究表明低氧环境下引起HIF-1α的表达,HIF-1α与其靶基因中的低氧反应元件 (HRE)结合,介导缺氧反应,并产生明显的细胞保护作用[13],从而调节血管舒缩反应,增加缺血区脑血流,改善局部血液供应,使缺氧的组织细胞保持氧稳定,减轻缺血性脑损伤,发挥明显的脑保护作用[13]。iNOS 是HIF-1α 的主要靶基因之一[3,14],因此推测脑必通胶囊可能通过激活内皮细胞HIF-1α,从而增加内皮细胞iNOS的表达。
[1]于 丽,洪燕珠,孙建宁,等.脑络通胶囊对大鼠局灶性脑缺血的影响[J].北京中医药大学学报,2002,25(3):27-30.
[2]Blagoskormy M V,An W G,Romanova L Y,et al.P53 inhibits hypoxia-inducible factor-stimulated transcription[J].J Biol Chem,1998,273(17):11995-11998.
[3]Ema M,Hirota K,Mimura J,et al.Molecular mechanisms of transcription activation by HLF and HIF1α in response to hypoxia:their stabilization and redox signal-induced interaction with CBP/p300[J].EMBO J,1999,18(7):1905-1914.
[4]王东吉,尚改萍,连为民,等.川芎嗪对兔脑缺血再灌注损伤的保护作用[J]。长治医学院学报,2003,17(4):2458.
[5]Fedele A O,Whitelaw M L,Peet D J.Regulation of gene expression by the hypoxia-inducible factors[J].Mol Interv,2002,2(4):229-243.
[6]Pannu R,Singh I.Pharmacological strategies for the regulation of inducible nitric oxide synthase:neurodegenerative versus neuroprotective mechanisms[J].Neurochem Int,2006,49(2):170-182.
[7]Beray-Berthat V,Palmier B,Plotkine M,et al.Neutrophils do not contribute to infarction,oxidative stress,and NO synthase activity in severe brain ischemia[J].Exp Neurol,2003,182(2):446-454.
[8]谭新杰,焦桂萍,任雁京,等.局灶性脑梗死后缺氧诱导因子-1α基因的治疗作用及机制研究[J].贵州医学院,2007,25:77-84.
[9]Bergeron M,Gidday J M,Yu A Y,et al.Role of hypoxia-inducible factor-1 in hypoxia-induced ischemic tolerance in neonatal rat brain[J].Ann Neurol,2000,48(3):285-296.
[10]Baranova O,Miranda L F,Pichiule P,et al.Neuron-specific inactivation of the hypoxia inducible factor 1α increases brain injury in a mouse model of transient focal cerebral ischemia[J].J Neurosci,2007,27(23):6320-6332.
[11]Daneshtalab N,Smeda J S.Alterations in the modulation of cerebrovascular tone and blood flow by nitric oxide synthases in SHR-sp with stroke[J].Cardiovasc Res,2010,86(1):160-168.
[12]Salernol L,Sorrenti V,Di Giacomoc,et al.Progress in the development of selective nitric oxide synthase(NOS)inhibitors[J].Curr Pharm Des,2002,8(3):177-200.
[13]Saha R N,Pahan K.Regulation of inducible nitric oxide synthase gene in glial cells[J].Antioxid Redox Signal,2006,8(5-6):929-947.
[14]Matrone C,Pignataro G,Molinaro P,et al.HIF-1α reveals a binding activity to the promoter of iNOS gene after permanent middle cerebral artery occlusion[J].J Neurochem,2004,90(2):368-378.

