参附注射液对体外循环中红细胞功能的影响观察
田 香
(湖北民族学院附属民大医院麻醉科,湖北恩施 445000)
体外循环是心内直视手术的一种重要手段,随着体外循环技术、心脏外科手术技巧和心肌保护措施的不断完善与提高,心内直视手术疾病本身的并发症逐渐下降,而体外循环术后导致的并发症难免发生[1]。因此,人们对体外循环引起红细胞损伤已经足够重视,认为保护体外循环中的红细胞仅凭改变体外循环器材的性能是远远不够的。在体外循环中,患者红细胞 (RBC)在受到机械损伤的同时机体还释放和产生大量的氧自由基 (OFR)及炎性细胞因子使RBC膜受到脂质过氧化损伤,RBC受损后,其形态严重破坏,可引起微循环灌注不良和RBC免疫功能降低[2]。因此,体外循环中保护红细胞对减少体外循环后的并发症极为重要。参附注射液有抑制脂质过氧化物产生和清除氧自由基的作用,临床应用比较广泛[3],但对体外循环中红细胞功能的保护研究尚未见报道。本研究拟通过测定脂质过氧化产物、红细胞免疫黏附功能等探讨参附注射液在体外循环术中对红细胞功能是否有保护效果,为临床上体外循环中血液保护寻找新的途径。
1 资料与方法
1.1 临床资料 20例患者均为心内直视手术房间隔缺损或者室间隔缺损,其中,男性12例,女性8例,随机分为参附注射液组和对照组,参附注射液组年龄为4~16岁,平均(11.3±5.7)岁,对照组年龄为4~19岁,平均 (10.4±8.9)岁,患者近期肝、肾功能均正常,并且未行过化疗、放疗及应用免疫抑制剂,术前凝血功能正常。参附注射液组房间隔缺损4例,室间隔缺损6例,平均体外循环转流时间 (32.54±9.65)min;对照组房间隔缺损7例,室间隔缺损3例,平均体外循环转流时间 (30.50±6.68)min,手术由同一组医师完成。
1.2 给药方法 参附注射液组在体外循环预充液中加入参附注射液2 mL/kg(参附注射液生产产家为雅安三九药业有限公司,其批准文号:国药准字Z51020664)。对照组给予等量生理盐水。
1.3 麻醉 麻醉诱导:静脉注射咪达唑仑0.1 mg/kg;芬太尼4 mg/kg;罗库溴铵0.5~1 mg/kg;依托咪酯0.15~0.3 mg/kg。麻醉维持:舒芬太尼500 μg+咪达唑仑50 mg+罗库溴铵300 mg。
1.4 体外循环 采用Jostra HL20滚压泵体外循环机、进口膜式氧合器,预充液为乳酸钠林格液和羟乙基淀粉,体外循环时红细胞比容维持在25%左右,常规浅低温28~32℃,灌注量2.0~2.4 L/(min·m2),平均动脉压 (MAP)保持在50~80 mmHg(1 mmHg=0.133 kPa),20例患者均自动复跳。
1.5 观察指标 两组患者分别在麻醉诱导前 (T1)、体外循环30 min(T2)、术后24 h(T3)采集患者中心静脉血5 mL,肝素抗凝,采用酵母菌玫瑰花环法测定红细胞受体花环率 (RBC-C3bRR)、红细胞免疫复合物花环率 (RBCICR);采用钙离子与甲基里香酚蓝结合,生成蓝色络合物,测定红细胞内钙;使用紫光型分光光度计测定血浆丙二醛(MDA)、游离血红蛋白 (FHB)。
1.6 统计学分析 采用SPSS 13.0统计软件进行统计分析,计量资料以±s表示,组间比较采用两独立样本t检验,组内比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
在围手术期中,切皮前、主动脉插管前、体外循环结束时各时点心率 (HR)、MAP、中心静脉压 (CVP)各组间比较差异无统计学意义 (P>0.05)。见表1。
麻醉诱导前两组患者MDA、FHB、红细胞内钙、RBCC3bRR、RBC-ICR组间比较差异无统计学意义 (P>0.05)。组内比较时,体外循环30 min及术后24 h两组患者MDA、FHB、红细胞内钙、RBC-C3bRR、RBC-ICR均较麻醉诱导前高 (P<0.05);而体外循环30 min及术后24 h两组患者MDA、FHB、红细胞内钙、RBC-C3bRR、RBC-ICR比较差异无统计学意义 (P>0.05);组间比较时,参附注射液组MDA、FHB、红细胞内钙、RBC-C3bRR显著低于对照组,RBC-ICR显著高于对照组,两组比较差异有统计学意义(P<0.05)。见表2。
表1 两组患者围手术期血流动力学的变化 (±s)

表1 两组患者围手术期血流动力学的变化 (±s)
注:1 cmH2O=0.1 kPa。
组别 时间 HR/(次·min-1) MAP/mmHg CVP/cmH2O参附注射液组 切皮前83.80±24.18 66.60±26.56 6.00±2.24主动脉插管前 99.40±10.81 83.60±11.99 7.00±2.35体外循环结束时 103.40±11.13 71.20± 7.82 8.00±3.16对照组 切皮前 69.20±12.60 72.40±13.22 3.90±1.60主动脉插管前 85.20±7.17 74.20±12.38 4.90±3.18体外循环结束时101.80±19.62 64.40±14.35 8.00±4.16
表2 两组各时间点MDA、FHB、RBC-C3bRR、RBC-ICR及红细胞内钙比较(±s)
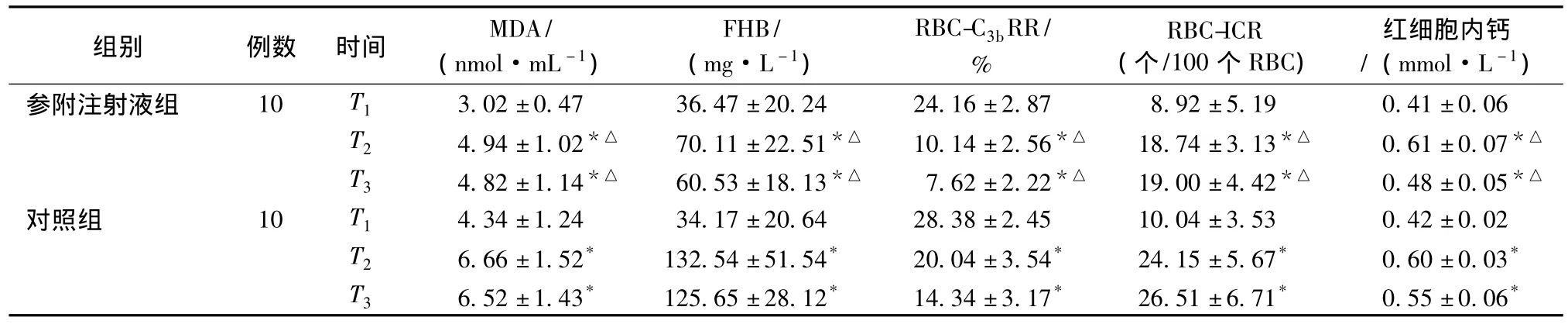
表2 两组各时间点MDA、FHB、RBC-C3bRR、RBC-ICR及红细胞内钙比较(±s)
注:与本组T1时间点比较,*P<0.05;与对照组同期比较,△P<0.05。
组别 例数 时间 MDA/(nmol·mL-1)FHB/(mg·L-1)RBC-C3bRR/%RBC-ICR(个/100个RBC)红细胞内钙/(mmol·L -1)参附注射液组 10 T1 3.02±0.47 36.47±20.24 24.16±2.87 8.92±5.190.41±0.06 T2 4.94±1.02*△ 70.11±22.51*△ 10.14±2.56*△ 18.74±3.13*△ 0.61±0.07*△T3 4.82±1.14*△ 60.53±18.13*△ 7.62±2.22*△ 19.00±4.42*△ 0.48±0.05*△对照组 10 T1 4.34±1.24 34.17±20.64 28.38±2.45 10.04±3.53 0.42±0.02 T2 6.66±1.52* 132.54±51.54* 20.04±3.54* 24.15±5.67* 0.60±0.03*T3 6.52±1.43* 125.65±28.12* 14.34±3.17* 26.51±6.71* 0.55±0.06*
3 讨论
红细胞是机体数量最多的细胞,其重要功能是向全身各类组织细胞运输氧,保障组织细胞的有氧代谢,红细胞膜表面还具有丰富的天然免疫分子如CR1、CD58、CD55、CD59、超氧化物歧化酶 (SOD)等,能识别、浓缩、黏附、杀伤抗原、清除循环免疫复合物 (IC)等功能[4]。有研究证明[5],红细胞与IC的连接主要通过红细胞膜表面上的补体CR1、CR3和IC上相对应的 C3b、iC3b结合而介导的。C3b-IC与免疫活性细胞结合可抑制其免疫功能,C3b-IC在组织中的沉积也是导致许多免疫性疾病的重要因素。因此红细胞膜上的CR1与C3b-IC结合,可消除这种免疫的抑制作用,对稳定机体组织的免疫功能有重要的调节作用。
体外循环转机过程中,血液与体外循环中非生物物质表面接触而激活机体的全身炎性反应,使血液中的氧自由基、细胞因子等大量产生[6]。红细胞是血液中的主要有形成份,红细胞中的血红蛋白属金属络合物,极易受氧自由基、细胞因子等炎性介质的攻击导致红细胞膜产生脂质过氧化反应[7],细胞膜表面的许多免疫分子遭受破坏,引起红细胞功能降低[8]。因此,对体外循环后患者的免疫功能产生严重的影响,导致机体免疫功能低下[9]。红细胞的免疫功能与手术患者术后的康复密切相关。近年来,人们对此方面的研究十分重视,但目前尚未找到有效的防治措施。
参附注射液主要成分是人参皂苷和乌头碱[10]。据文献报道[11],参附注射液可抑制脂质过氧化物产生,清除氧自由基,抑制过量钙离子内流,防止钙超载,抑制或减轻细胞结构的破坏[12]。本研究发现,麻醉诱导前两组患者MDA、FHB、红细胞内钙、RBC-C3bRR、RBC-ICR组内及组间比较无明显差异。组内比较时,体外循环30 min及术后24 h两组患者 MDA、FHB、红细胞内钙、RBC-C3bRR、RBC-ICR均较麻醉诱导前高;而体外循环30 min及术后24 h两组患者MDA、FHB、红细胞内钙、RBC-C3bRR、RBCICR比较无明显差异;组间比较时,参附注射液组MDA、FHB、红细胞内钙、RBC-C3bRR显著低于对照组,RBC-ICR显著高于B组,表明在体外循环过程中有大量炎性细胞因子及氧自由基对红细胞的攻击,使得红细胞免疫功能有继发性损伤,同时红细胞与体外循环中非生物物质表面接触后,钙泵活性下降,钙离子外排减少,使得红细胞内钙超负荷,继而导致红细胞受损,在应用参附注射液后,减轻了炎症介质对红细胞的破坏。因此,在体外循环术中,预充液中应用参附注射液能减轻体外循环手术对机体红细胞功能损伤程度,表明体外循环术中应用参附注射液,可以改善机体的红细胞功能,减轻术后感染发生的风险。
[1]李 刚,芶大明,杜 磊,等.变温式改良超滤改善婴幼儿心脏手术的预后[J].中国体外循环杂志,2008,6(4):193-196.
[2]王良山,张小霓,林财珠.体外循环对红细胞及其免疫功能的影响[J].医学综述,2006,12(21):1296-1298.
[3]朱 玲,周黎明,王正荣.参附注射液的作用及作用机制的研究进展[J].四川生理科学杂志,2004,26(2):77-82.
[4]郭 峰.血液免疫反应路线图[J].深圳中西医结合杂志,2005,15(1):1-4.
[5]宋 毅,李 然,等.体外循环术中自体血洗涤回输对机体红细胞免疫及肾功能影响[J].中华医学杂志,2006,86(32):2293-2296.
[6]韩幼琦.体外循环中的抗炎策略[J].中国体外循环杂志,2005,3(1):123.
[7]Kutner K L,Subramanian V B,Atkinson J P,et al.Conservation in decay accelerating factor structure among primates[J].Dev Comp Immunol,2000,4(8):815-82.
[8]胡志伟,张凯伦,孙宗全.体外循环转流期间红细胞膜流动性的变化[J].现代临床医学生物工程学杂志,2001,7(5):325-326.
[9]郭 峰.红细胞免疫研究概况[J].中华微生物和免疫学杂志,1995,15(3):181.
[10]Ulus A T,Aksoyek A,Ozkan M,et al.Cardiopulmonary bypass as a cause of free radical-induced oxidative stress and enhanced blood-borne isoprostanesin humans[J].Free Radic Biol Med,2003,34(7):911-917.
[11]Pietri S,Sequin J R,Darbigny P,et al.Ascorbyl free radical:a noninva-sive marker of oxidative stress in human open-heart surgery[J].Free Radic Biol Med,1994,16(4):523-528.
[12]詹丽英,夏中元,夏 芳.参附注射液对体外循环期间胃肠灌注及氧合的影响[J].中国现代医学杂志,2005,15(18):2814-2816.

