铁皮石斛快繁及多糖含量测定
黄以平
(福州植物园,福建 福州350012)
铁皮石斛Dendrobium officinale Kimuraet Migo.为兰科石斛属,多年生草本植物,以新鲜或干燥茎入药。为药典收载且单独列为一类的名贵中草药之一,其性甘,微寒,归胃、肾经,功能益胃生津,滋阴清热,用于阴伤津亏,口干烦渴,食少干呕,病后虚热,目暗不明等症。多糖是其主要活性成分[1-2],总多糖含量的高低是目前铁皮石斛质量评价的主要指标[3-4]。本实验对铁皮石斛进行了组织培养,并参照2010年版《中华人民共和国药典》铁皮石斛项下,测定了铁皮石斛组培苗多糖的含量,初步分析铁皮石斛组培苗的药用价值,为铁皮石斛优良种质资源的选育和资源开发奠定了基础。
1 材料与方法
1.1 仪器与试药522AA型旋转蒸发仪(上海亚荣生化仪器厂);TU-1901新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司);PL203型电子分析天平(METTLER TOLEDO上海公司);SG5200 HPT型超声波清洗器(上海冠特超声仪器有限公司);80-2B型离心机(上海安亭科学仪器厂);SHBB95A型循环水式多用真空泵(郑州长城科工贸有限公司);YB-2恒温真空干燥箱(上海纽航仪器设备有限公司);葡萄糖、苯酚、浓硫酸、石油醚、甲醇、乙醇、乙醚、氯仿、丙酮、正丁醇等试剂均为分析纯。
1.2 铁皮石斛组织培养
1.2.1 铁皮石斛外植体增殖培养 取组培苗圃地中生长的铁皮石斛新鲜芽茎段,流水冲洗1 h,在超净工作台上用75%酒精处理1 min,再用0.1%升汞液浸泡12~15 min,倒去升汞液,用无菌水冲洗4~5次,每次不少于5 min,后用无菌纸吸干备用。将消毒好的茎段切除上下端各0.5cm后接种到培养基MS+6-BA 2.0mg/L+NAA 0.2mg/L+蔗糖25g/L+活性炭0.5g/L+琼脂10g/L(pH5.5~5.8)中诱导腋芽发生,培养温度为25℃,光照12~16 h/d,1600 lx。约60 d后,转接至培养基MS+6-BA 4.0mg/L+NAA 0.2mg/L+蔗糖25g/L+活性炭0.5g/L+琼脂10g/L(pH 5.8)中继代培养,每5周1次,得未发根的组培苗。
1.2.2 铁皮石斛生根培养 取增殖所得铁皮石斛组培苗转接至基本培养基1/2MS+NAA 0.2mg/L+香蕉泥100g/L+蔗糖30g/L+活性炭1g/L+琼脂10g/L(pH 5.8)中进行生根培养,培养温度为25℃,光照12 h/d,2500 lx,得发根组培苗。
1.3 多糖含量测定[5]
1.3.1 供试样品 采集至组培苗圃地生长2年半、3年半的铁皮石斛茎叶,本实验所得未发根组培苗茎叶和发根组培苗(发根组培苗完整植株,分为茎上、茎中、茎下和根部4部分)。将各样品(其中未发根组培苗和发根组培苗不进行炼苗,直接用于多糖含量测定)清洗干净,干燥后,粉碎过3号筛,供测定多糖含量。
1.3.2 样品溶液的制备 取样品粉末约0.3g,精密称定,加水200mL,加热提取2 h,提取液转移至250mL量瓶中,用适量水分次洗涤容器,洗液转移至同一量瓶中;放冷,加水稀释至刻度,摇匀,滤过,精密吸取续滤液2mL,置15mL离心管中;精密加入无水乙醇10mL,摇匀,冷藏1 h,取出,离心(4000 rpm)20 min,弃去上清液,必要时滤过,沉淀加80%乙醇洗涤2次,每次8mL,离心,弃去上清液,沉淀加热水溶解并转移至25mL量瓶中;放冷,用水稀释至刻度,摇匀,即得样品溶液。
1.3.3 对照品溶液的配制 取105℃干燥至恒重的无水葡萄糖对照品适量,精密称定,加水溶解并定量,摇匀,制成每1mL中含90 μg的溶液,即得对照品溶液。
1.3.4 检测波长的选择 精密吸取标准葡萄糖溶液0.3mL,置于具塞比色管中,加蒸馏水至2.0mL,再加苯酚试液1.0mL,摇匀,迅速滴加浓硫酸5.0mL,迅速摇匀,放置5 min,置沸水浴中加热15 min,取出,冷水迅速冷却至室温,作为供试溶液。在400~600 nm范围对供试溶液进行扫描。
1.3.5 标准曲线的制备 精密量取对照品溶液0.2、0.4、0.6、0.8、1.0mL,分别置10mL具塞试管中,加水至1.0mL;精密加5%苯酚溶液1mL,摇匀,再精密加硫酸5mL,摇匀,置沸水浴中加热20 min,取出,放入冰浴中冷却5 min。以相应的试剂为空白,按照紫外-可见分光光度法,在490 nm的波长处测定吸光度,以吸光度为纵坐标(Y),浓度为横坐标(X),绘制标准曲线,得回归方程:Y=0.0742X-0.0008(r=0.9980)。
1.3.6 样品测定 精密量取样品溶液1mL,置10mL具塞试管中,按照标准曲线绘制项下的方法,自“精密加入5%苯酚溶液1mL”起,依次测定吸光度,每个样品平行处理3份,取平均值。从标准曲线上读出供试品溶液中无水葡萄糖的量,代入回归方程计算葡萄糖的质量浓度,再按下式计算多糖的量:
多糖的量(%)=CD/W×100%。
式中:C为供试液中葡萄糖的质量浓度(mg/mL);D为供试液的稀释倍数;W为供试品量。
2 结果与分析
2.1 铁皮石斛增殖培养
2.1.1 外植体组织培养 将外植体接种至增殖培养基,其丛生芽的增殖率高,且生长势好,芽苗浓绿健壮。可对其芽苗进行再增殖,建立快繁体系,30 d左右长出完整茎叶。
2.1.2 铁皮石斛发根 将增殖所得不带根铁皮石斛组培苗接种至1/2 MS培养基上,约20 d左右基部根开始生长,45 d左右苗生长健壮、根系发达。
2.2 方法学考察
2.2.1 最大检测波长 将葡萄糖及铁皮石斛多糖溶液的显色后溶液分别在400~600 nm内扫描,结果在490 nm左右有最大吸收,故选择490 nm为检测波长。
2.2.2 精密度实验 精取供试溶液5份,每份0.3mL,加蒸馏水使成2.0mL,各加苯酚试剂1.0mL,按标准曲线操作,重复5次,测定其吸光度,计算RSD值为1.03%,表明仪器精密度良好。
2.2.3 重复性实验 精密称取铁皮石斛粉末5份,每份1.0g,按样品溶液制备和测定方法操作,分别测定其含量,结果计算RSD值为3.52%,重现性良好。

表1 重现性试验结果
2.2.4 回收率实验 精密称取已知铁皮石斛粉末5份,分别精密加入不同量的对照品,蒸馏水定容,摇匀,重复测定5次,测定其吸光度并用标准曲线计算含量。测得平均回收率为99.11%,RSD值为1.01%。
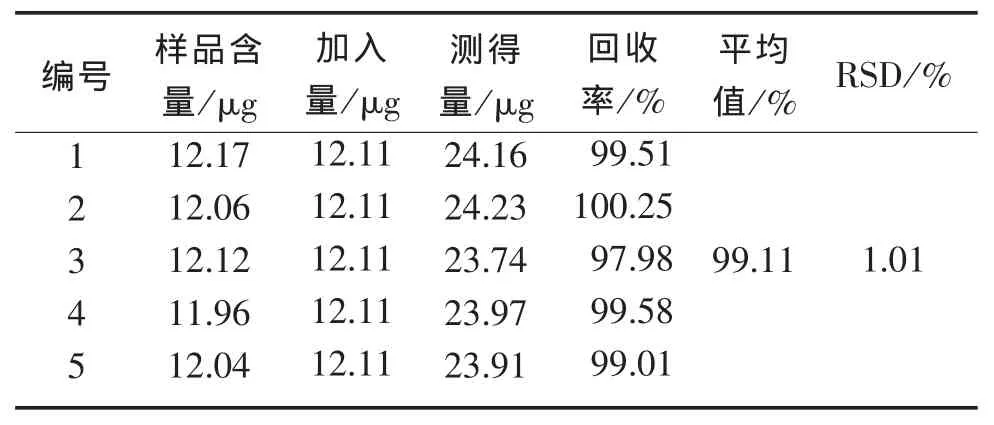
表2 加样回收率实验结果(n=5)
2.2.5 稳定性实验 精取供试溶液0.3mL,加蒸水使成2.0mL,加苯酚试剂1.0mL,按标准曲线操作,每隔30 min测定1次吸收度。测定结果为RSD=0.92%,测定值在240 min内有较好的稳定性。

表3 稳定性实验结果
2.3 多糖含量的测定 精密量取铁皮石斛各供试品溶液1.0mL,按“1.3.6”项下方法操作,测定吸光度。同时精密量取葡萄糖对照品溶液0.3mL,同法操作,按公式计算各样品的多糖含量,结果见表4。铁皮石斛发根组培苗的茎上、中、下3部分和根部多糖含量有较大差异,而未发根组培苗未检测到多糖。其中发根组培苗各部位多糖含量各不同,多糖含量茎中>茎上>茎下>根部,这与文献[6]报道的基本一致。组培苗圃地生长2年半、3年半的组培苗和发根组培苗的多糖含量分别为25.91%、26.80%和25.09%,可见,随组培苗苗龄的增加,茎叶中多糖含量也随之增加,且均达到药典中铁皮石斛多糖含量的规定。

表4 不同苗龄及部位的铁皮石斛中多糖含量测定结果(n=3)
3 讨 论
我国铁皮石斛种质资源丰富,但由于自然和人为因素影响,野生铁皮石斛种质资源受到严重威胁。种苗的大量、快速生长已成为规模化生产的关键,而组培快繁技术是解决该问题的最好方法[7],对铁皮石斛进行增殖培养,在短时间内可得到大量铁皮石斛组培苗。2010年版《中华人民共和国药典》规定:铁皮石斛按干燥品计算,含铁皮石斛多糖以无水葡萄糖(C6H12O6)计,不得少于25.0%。本文利用苯酚-硫酸法测定了铁皮石斛发根组培苗的多糖含量为25.09%,达到药典铁皮石斛多糖含量的规定,且随组培苗苗龄的增加,茎叶中多糖含量也随之增加,铁皮石斛组培苗多糖的药理作用有待于进一步研究。
[1]国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:265-266.
[2]诸燕,斯金平,郭宝林,等.人工栽培铁皮石斛多糖质量分数变异规律[J].中国中药杂志,2010,35(4):427.
[3]陈蕤.石斛多糖提取工艺的研究[J].中国医药导报,2010,7(12):40-43.
[4]刘宏源,杨金燕,黄松,等.3,5——二硝基水杨酸法测定铁皮石斛中多糖的含量[J].亚太传统医药,2010,6(8):14-16.
[5]吴刚,季祥彪,康冀川,等.石斛中多糖和生物碱的含量测定[J].山地农业生物学报,2008,27(3):274-278.
[6]华允芬,陈云龙,张铭.三种药用石斛多糖成分的比较研究[J].浙江大学学报,2004,38(2):249-252.
[7]邵华,张玲琪,李俊梅.铁皮石斛研究进展[J].中草药,2004,35(1):109-202.

