干扰组蛋白去甲基化酶基因表达对Ishikawa细胞增殖凋亡的影响
郑金丹,刘丽丽
1辽宁医学院,辽宁锦州 121000;2辽宁医学院第一附属医院,辽宁锦州 121000
子宫内膜癌(endometrial carcinoma)是女性生殖系统常见的恶性肿瘤,其病因尚不清楚,长期受雌激素刺激而无孕酮拮抗可能是其主要发病因素。孕激素是保护子宫内膜的重要因素,亦是内分泌治疗子宫内膜癌的重要方法,可使子宫内膜癌腺体向良性逆转[1]。孕激素通过与其受体(progesterone receptor,PR)结合发挥生物学效应,而PR阳性被认为是临床内分泌治疗激素依赖性子宫内膜癌的关键。最近,Stratmann,Haendler[2]在研究人类乳腺癌时发现,乳腺癌细胞中存在JARID1A基因过渡表达,可能与肿瘤的发生有关,沉默JARID1A基因可上调PR表达,抑制肿瘤细胞生长。Sharma在建立肿瘤细胞株对抗癌药物敏感性模型时发现,染色质介导的肿瘤细胞耐药可逆状态需要JARID1A参与[3]。本研究旨在通过SiRNA干扰JARID1A基因表达,探讨其对子宫内膜癌Ishikawa细胞增殖凋亡的影响。
材料和方法
1 材料 人子宫内膜癌高分化细胞系Ishikawa(ER、PR高表达)由北京大学人民医院惠赠。DMEM/F-12培养基、小牛血清购自美国Gibico公司,PR抗体Santa Cruz分装,重组人雌二醇HSD17B1(E2)购自Sigma公司,JARID1A抗体购自Cell signaling,转染试剂盒和DharmaFECT1转染试剂购自Dharmacon公司,四条JARID1A siRNA由Dharmacon公司设计合成。RT-PCR试剂盒购自TaKaRa公司。
2 细胞培养 Ishikawa细胞用含10%胎牛血清的DMEM/F-12培养液置于37 ℃、5% CO2的恒温培养箱培养,细胞密度达到70%以上时传代,实验取对数生长期细胞。
3 SiRNA转染Ishikawa细胞 根据前期工作基础选择1条干扰效果理想的序列进入本实验,空白对照(untr)不作任何处理,阴性对照(siCo)采用不针对任何基因的siRNA。JARID1A siRNA:5'-GCAAAU GAGACAACGGAAA-3'; JARID1A Non-Targeting siRNA:5'-UUCUCCGAACUUGUCACAUUU-3',转染过程按转染说明书操作。转染成功后将细胞放入CO2培养箱,37 ℃温育24~48 h,进行后续操作。
4 细胞RNA提取及RT-PCR 使用Trizol试剂提取细胞总RNA后,逆转录获得cDNA,按TaKaRa公司RT-PCR试剂盒说明书进行操作。总RNA经紫外分光光度计测OD260和OD280值,两者比值在1.8~2.0之间的RNA纯度为好。反转录使用Oligo(dT)引物,合成cDNA条件为:30 ℃,10 min;42 ℃,30 min;99 ℃,5 min。反转录结束后进行PCR反应,反应体系为20 μl。PCR引物经Gene Bank上的Blast比对后委托TaKaRa公司合成,PCR扩增产物使用1.5%琼脂糖,100伏电泳30 min,EB染色,凝胶成像系统(Bio Imaging System,UVP,USA)观察。以β-actin为内对照,引物见表1。

表1 PCR引物序列Tab.1 Sequences of PCR primers
5 蛋白提取及Western Blotting 细胞裂解液(pierce)提取细胞内总蛋白,考马斯亮蓝法测定蛋白浓度。配制10%的分离胶和5%浓缩胶,每孔加入20 μl样品后进行电泳,转印至PVDF膜上,经封闭后,加入PR多克隆一抗(1∶200),4 ℃孵育过夜,TTBS洗涤加PR标记的兔抗山羊二抗(1∶2 000),37 ℃孵育2 h,洗膜后加入ECL发光试剂,蛋白条带用Bio Imaging System采集后进行灰度值测定,目的蛋白与β-actin的灰度值比值即为该样品的蛋白相对含量。
6 CCK8检测Ishikawa细胞增殖 将sicon组、sicon+e2组、siJARID1A组和siJARID1A+e2组的Ishikawa细胞以每孔1 000个细胞密度接种96孔板中,重复种植4个96孔板,分别用来检测24 h、48 h、72 h、96 h细胞的增殖,450 nm条件下检测吸光度值。以时间为横坐标,每组细胞平均吸光值为纵坐标,绘制细胞增殖曲线。
7 流式细胞术检测细胞周期 将sicon组、sicon+e2组、 siJARID1A组和siJARID1A+e2组的Ishikawa细胞培养48 h后,分别加入1 ml PBS,1 500 g离心5 min,弃上清,加入400 μl碘化啶液(PI),室温避光30 min,流式细胞仪(BD bioscience)检测细胞周期。
8 统计学方法 采用SPSS13.0进行数据处理与统计学分析,计量资料以表示,单因素方差分析,对Ishikawa细胞吸光值进行Fried-man检验,检验水准a=0.05。
结 果
1 干扰效率 Ishikawa细胞转染SiRNA后, JARID1A mRNA表达降低,见图1。
2 E2对PR表达的影响 不同浓度E2均能上调Ishikawa细胞中PR mRNA的表达,在E2浓度100 nmol/L时,PR mRNA上调最明显(P<0.05),见图2。
3 SiRNA对PR表达的影响 Ishikawa细胞转染JARID1A SiRNA后,PR蛋白表达增加,PR mRNA表达上调,见图3、4。
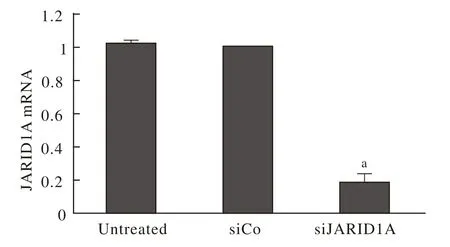
图1 JARID1A基因干扰效率 与siCo组相比,siJARID1A组中JARID1A mRNA表达明显降低(aP<0.01)Fig.1 Interference with JARID1A gene expression on proliferation and apoptosis of Ishikawa cells aP<0.01 vs siCo group

图2 RT-PCR检测PR mRNA表达Fig.2 RT-PCR-detected PR mRNA expression

图3 Western Blot检测PR蛋白表达 与sicon组和sicon+e2组相比较,siJARID1A组和siJARID1A+e2组细胞中PR蛋白表达增加(P<0.01)Fig.3 Western blot-detected PR protein expression. P<0.01 vs siCo group and sicon+e2 group
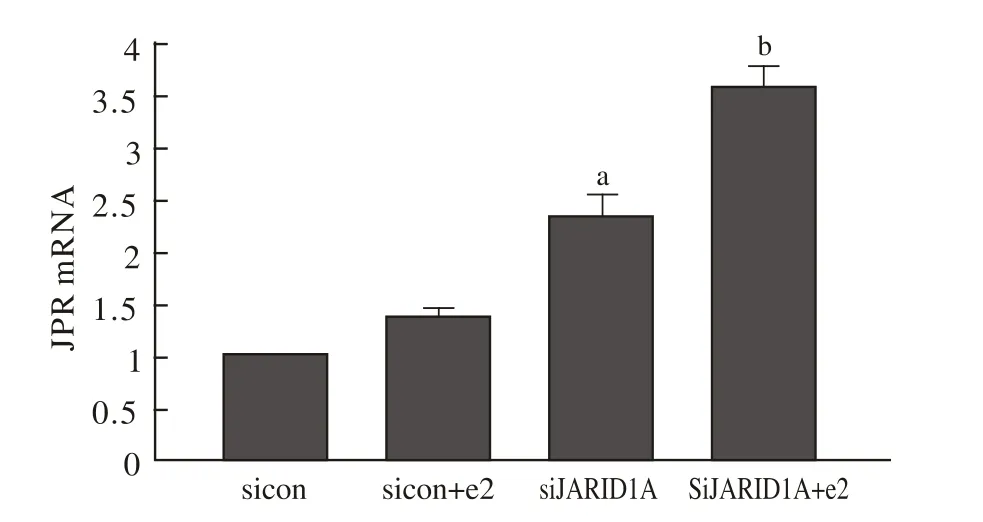
图4 RT-PCR检测PR mRNA表达 与sicon组相比,siJARID1A组中PR mRNA表达增加(aP<0.01);与sicon+e2组相比,siJARID1A+e2组PR mRNA表达上调(bP<0.05)Fig.4 RT-PCR-detected PR mRNA expression aP<0.01, vs siCo group; bP<0.05, vs sicon+e2 group
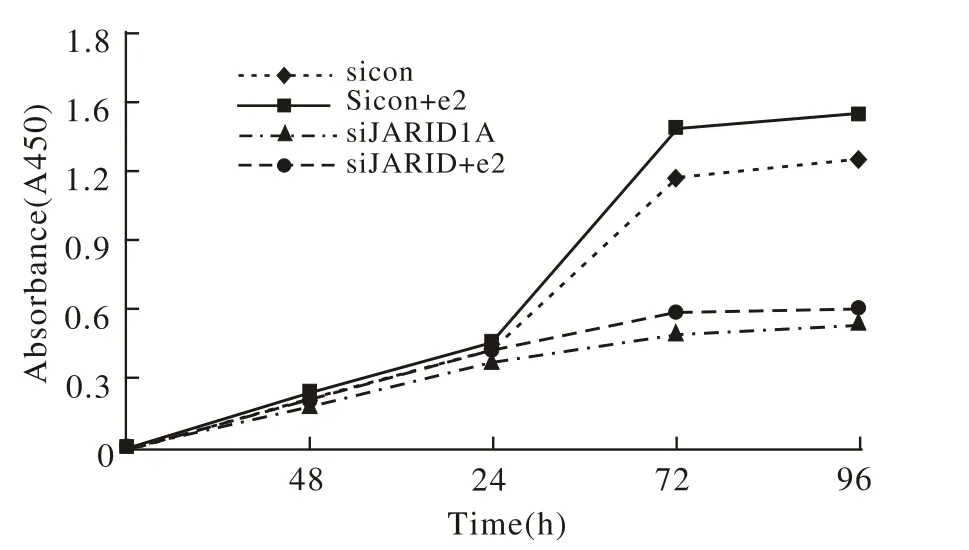
图5 细胞增殖曲线Fig.5 Proliferation curves of Ishikawa cells

图6 细胞周期 与sicon组、sicon+e2组相比,siJARID1A组和siJARID1A+e2组细胞G1、G2/M期受到抑制(aP<0.01,bP<0.05)Fig.6 Cell cycle of Ishikawa cells aP<0.01, vs siCo group; bP<0.05, vs sicon+e2 group
4 细胞增殖情况 Ishikawa细胞转染JARID1A Si-RNA 48 h后,细胞增殖速度明显减慢,sicon、sicon+e2组细胞在培养48 h后达对数增殖期,而siJARID-1A和siJARID1A+e2组细胞缺乏对数增殖特征,见图5。
5 细胞周期变化 JARID1A siRNA抑制Ishikawa细胞G1、G2/M期,见图6。
讨 论
子宫内膜癌的发病机制尚未阐明,多数学者认为其最常见病因是过量雌激素长期刺激的结果[4]。雌激素可刺激子宫内膜细胞增生,也可在DNA转录水平上诱导下游基因PR的生成,发挥其生物学效应[5]。本研究选取ER、PR均阳性的Ishikawa细胞系,结果证实不同浓度的E2均可以上调PR基因的表达,在E2浓度为100 nmol/L时,PR基因表达上调最明显,提示在PR阳性的子宫内膜癌细胞中,雌激素可上调PR的表达,为临床内分泌治疗子宫内膜癌提供理论依据。
JARID1A属于JARID1蛋白家族成员之一,起初被描述为视网膜母细胞瘤蛋白,有促进肿瘤细胞分化的作用[6]。最近研究证实JARID1A是一种组蛋白去甲基化酶,与其他组蛋白去甲基化酶不同,JARID1A通过自身ARID区域识别一组特殊的CCGCCCDNA序列调控下游基因表达[7-8]。全基因组分析结果表明,JARID1A控制着两组基因,一组涉及细胞分化的调控,另一组调控细胞线粒体的功能及RNA/DNA代谢[9]。本研究应用SiRNA干扰JARID1A基因表达,实验发现干扰JARID1A(si JARID1A、siJARID1A+e2组)能显著增加PR基因表达,上调PR蛋白表达。
肿瘤被认为是一类细胞周期性疾病,肿瘤细胞的主要生物学特性表现为侵袭生长[10]。实验中我们采用MTT法观察Ishikawa细胞增殖,流式细胞技术检测细胞周期。结果发现,E2能促进肿瘤细胞增殖,转染SiRNA 48 h后,肿瘤细胞增殖速度明显减慢,曲线低平,与对照组相比缺乏对数增殖特征;进一步研究发现,转染SiRNA后肿瘤细胞的G1、G2/M期受到抑制。
本研究证实,JARID1A siRNA能有效抑制Ishikawa细胞增殖、诱导肿瘤细胞凋亡,是通过上调PR基因表达以拮抗雌激素的生物学效应来完成。JARID1A是如何上调PR基因的表达仍需进一步深入研究,而JARID1A基因的发现则有望成为子宫内膜癌治疗的新靶点。
1 Flötotto T, Niederacher D, Hohmann D, et al. Molecular mechanism of estrogen receptor (ER)alpha-specific, estradiol-dependent expression of the progesterone receptor (PR) B-isoform[J]. J Steroid Biochem Mol Biol, 2004, 88(2): 131-142.
2 Stratmann A, Haendler B. The histone demethylase JARID1A regulates progesterone receptor expression[J]. FEBS J, 2011, 278(9): 1458-1469.
3 Sharma SV, Lee DY, Li B, et al. A chromatin-mediated reversible drug-tolerant state in Cancer cell subpopulations[J]. Cell, 2010,141(1): 69-80.
4 张海艳,李立安,李亚里,等.ER、PR、P53在子宫内膜癌中的表达及对预后的影响[J].军医进修学院学报,2012,33(1):27-29,41.
5 Dardes RC, Schafer JM, Pearce ST, et al. Regulation of estrogen target genes and growth by selective estrogen-receptor modulators in endometrial Cancer cells[J]. J Steroid Biochem Mol Biol, 2002,85(3): 498-506.
6 Christensen J, Agger K, Cloos PA, et al. RBP2 belongs to a family of demethylases, specific for tri-and dimethylated lysine 4 on histone 3[J]. Cell, 2007, 128(6): 1063-1076.
7 Klose RJ, Yan Q, Tothova Z, et al. The retinoblastoma binding protein RBP2 is an H3K4 demethylase[J]. Cell, 2007, 128(5):889-900.
8 Tu S, Teng YC, Yuan C, et al. The ARID domain of the H3K4 demethylase RBP2 binds to a DNA CCGCCC motif[J]. Nat Struct Mol Biol, 2008, 15(4): 419-421.
9 Lopez-Bigas N, Kisiel TA, Dewaal DC, et al. Genome-wide analysis of the H3K4 histone demethylase RBP2 reveals a transcriptional program controlling differentiation[J]. Mol Cell, 2008, 31(4):520-530.
10 吴艳萍,李立平,张颖,等.细胞周期调控分子与肿瘤关系的研究进展[J].军医进修学院学报,2006,27(4):306-308.

