一株以腺嘌呤高效合成ATP的毛霉菌的鉴定
朱家荣,杨善岩,杨光辉,裘娟萍
(浙江工业大学 生物与环境工程学院,浙江 杭州 310032)
一株以腺嘌呤高效合成ATP的毛霉菌的鉴定
朱家荣,杨善岩,杨光辉,裘娟萍
(浙江工业大学 生物与环境工程学院,浙江 杭州 310032)
为确定一株ATP高产毛霉菌ZGB1在分类学上的地位,通过形态观察、生理生化特性分析、18S与ITS r DNA序列比对,对该菌进行鉴定.ZGB1形态上与放射毛霉属相似.最适生长温度为28℃;在PDA培养基中生长对数期为6~36 h;最适pH为6.5;最适碳氮源分别为葡萄糖和酵母浸膏.18S r DNA序列(Accession No.JN604987)与雅致放射毛霉同源性为99%,ITS r DNA序列(Accession No.JN887460)与 雅 致 放 射 毛 霉 两 个 亚 种 (Actinomucorelegansvar.strain ATCC52360及Actinomucorelegansstrain CBS111556)同源性皆为100%.鉴定该菌为雅致放射毛霉的突变株,命名为Actinomucorelegansstrain ZGB1.该菌能以腺嘌呤高效合成ATP,当腺嘌呤质量浓度为3 g/L时,ATP产量可达9.84 g/L,摩尔转化率为80.46%.
毛霉;鉴定;18S r DNA;ITS r DNA
腺嘌呤腺苷三磷酸简称ATP,是生命活动所需能量的直接来源,参与生物体内多种生化反应,在临床上对癌症[1]、进行性肌萎缩、中风后遗症、心肌炎、冠状动脉硬化及肝炎等病症[2]具一定的辅助治疗作用.当前国内外主要采用生物合成法生产ATP,底物主要有腺嘌呤、腺苷和腺苷一磷酸等.国外主要采用腺嘌呤和腺苷生产ATP日本利用产氨短杆菌(Brevibacteriumammoniagenes)以腺嘌呤为底物生产ATP,转化效率高,生产成本低,处于国际领先水平[3];国内多以腺苷为底物通过酵母菌(Saccha-romyces)发酵生产ATP,生产成本高、市场竞争力低,所以国内的ATP生物合成技术急需进一步完善提高.采用毛霉菌(Mucor)以腺嘌呤为底物合成ATP的工艺之前国内已有报道,但存在产量及摩尔转化率较低等问题[4],尚需进一步优化提高.毛霉菌具有丰富的酶系,采用毛霉菌进行ATP的合成具有菌体生长迅速、工艺简单和反应时间短等优点;而且相比腺苷与腺苷一磷酸,以腺嘌呤为底物具有原料成本低和质量转化率高(质量转化率约是腺苷的2倍)等优点.因此,该工艺具有较高的经济价值及广阔的应用前景.
实验发现课题组保藏的一株毛霉菌——ZGB1具有较强的磷酸化系统,能以腺嘌呤为底物合成ATP,而且通过实验探索使ATP产量有了一定的提高,但要进行深入的研究,就必须对其进行准确的分类鉴定,确定其在分类学中的地位.当前分子生物学发展迅速,人们已认识到单靠传统的形态及生理生化特性为指标,已不足以对丝状真菌的鉴定 提 供 充 分 有 力 的 证 据[5-6],18S与ITS r DNA序列分析及系统发育树的构建,已经广泛应用于丝状真菌的鉴定中.笔者通过18S与ITS r DNA序列分析、系统发育树构建结合丝状真菌传统的分类鉴定方法,对实验所用毛霉菌ZGB1进行了分类鉴定,确定该菌为雅致放射毛霉(Actinomucorelegans)的突变株.为下一步通过诱变育种、代谢调控及基因工程等途径提高该菌ATP产量奠定了基础.
1 材料与方法
1.1 菌 种
Mucor:实验室筛选得到,编号ZGB1,以下简称ZGB1.
1.2 培养基
PDA培养基:去皮马铃薯200 g/L,蔗糖20 g/L,琼脂20 g/L,pH自然.
察氏培 养基:蔗糖 30 g/L,Na NO32 g/L,K2HPO4·3H2O 1 g/L,MgSO4·7H2O 0.5 g/L,KCl 0.5 g/L,FeSO4·7H2O 0.01 g/L,琼脂20 g/L,pH自然.
1.3 主要试剂
PCR试剂盒,PCR产物纯化试剂盒,p MD19-T simple vecto购于 Takara公司;T4-DNA Ligase,RNase,DL 2 000,1 kb marker plus,均购于 Ta Ka-Ra公司.其他常用试剂为国产生化或分析纯试剂.
1.4 方 法
1.4.1 菌株的分离纯化
将ZGB1活化培养后,制备孢子悬液稀释涂布PDA平板,于30℃培养12~18后挖取单菌落,置于新的PDA平板,继续培养至孢子成熟.如此重复进行2~3次分离,可将该菌分离纯化.
1.4.2 形态鉴定
将ZGB1孢子点种于PDA平板,30℃培养,每12 h观察记录菌落形态;用载玻片培养法(30℃恒温培养)进行菌株的显微镜检.
1.4.3 生理生化特性考察
以PDA培养基确定ZGB1生长最适温度与pH,并作生长曲线.以察氏培养基为基础培养基,确定最适碳源及氮源.液体培养接种以OD600=1.0的孢子悬液,按体积分数为10%的接种量接种.
1.4.4 分子鉴定
氯化苄法提取 ZGB1基因组 DNA[7-9],以真菌18S通用引物(18SU:5′-AGCCATGCATGTCTAAGTATAAGC-3′;18SL:5′-ACAAAGGGCAGGACGTAATCAAC-3′),ITS 通 用 引 物 (ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS2:5′-GCTGCGTTCTTCATCGATGC-3′)进 行 PCR 扩 增.PCR 体 系:10×PCR buffer 5.0 μL,d NTPs 4.0μL,MgCl23.0μL,正反引物各1.0μL,模板1.0μL,Taq酶1.0μL,dd H2O 补充至50.0μL.PCR程序:94℃预变性5 min;94℃变性45 s(ITS为1 min),52℃退火1 min(ITS为55℃退火30 s),72℃延伸45 s(ITS为延伸1 min),30个循环;72℃延伸10 min.PCR产物1%琼脂糖凝胶电泳检测,分别回收目的片段,并 T/A 克隆至p MD19-T simple vector,转化E.coliDH5α,经蓝白斑筛选获得转化子[10],测序由生工生物工程(上海)有限公司完成.利用MEGA4.1,构建ZGB1系统发育进化树.
1.4.5 ATP产量测定
ZGB1孢子悬液接种PDA液体培养基,于28℃、160 r/min培养36 h,抽滤获得菌体,65℃干燥3 h,即为有转化活性的菌体.转化体系:葡萄糖120 g/L,Na2HPO4·12H2O 90 g/L,MgCl2·6H2O 4 g/L,腺嘌呤3 g/L,菌体100 g/L.配好的反应体系搅拌均匀后,于33℃,160 r/min的摇床中转化.反应6 h开始每隔2 h用纸电泳检测转化情况,14 h终止反应.
ATP的分析测定,参照孙培龙、吴石金《纸电泳法定量分析腺苷三磷酸》[11].点样5μL于1.5 cm宽的普通滤纸条,以柠檬酸-柠檬酸钠溶液(柠檬酸9 g/L,柠檬酸钠1 g/L)为缓冲液,电压400 V,电泳50 min.电泳结束烘干滤纸条,于紫外分析仪下描出ATP斑点,剪成细条,以pH为1的HCl溶液于30℃,160 r/min摇床中浸提4 h,测定浸提液OD260.ATP产量计算公式为

式中:MrATP=551 g/mol;C为稀释倍数(浸提液体积/点样体积);EATP=1.43×104L/(mol·cm).
2 结果与分析
2.1 菌落形态特征
用无菌接种针将ZGB1孢子点种于PDA平板,30℃培养,每12 h观察记录菌落形态,结果如表1所示.
2.2 菌株形态特征
2.2.1 菌 丝
ZGB1菌丝无色、无横隔,分为营养菌丝和气生菌丝.如图1(a)所示,营养菌丝较细、弯曲且多分支,潜入培养基内生长,并分化出匍匐菌丝及假根.如图1(b)所示,气生菌丝于假根处生出直立生长、单生或总状分枝,直径8.0~11.0μm.这些特征与毛霉属的总状枝毛霉、放射毛霉属及根霉属相似.

表1 ZGB1菌落形态的特征Table 1 Colony feature of ZGB1
2.2.2 孢囊梗
孢囊梗是支持孢子囊的菌丝分枝,不同种属的霉菌孢囊梗具有一定的差异.如图1(c)所示,ZGB1孢囊梗由气生菌丝直接生出,轮生放射状,顶生孢子囊,有横隔,色泽同气生菌丝,直径为10.5~26.3 μm.其中孢囊梗轮生放射状、顶生孢子囊是放射毛霉属的典型特征[12].
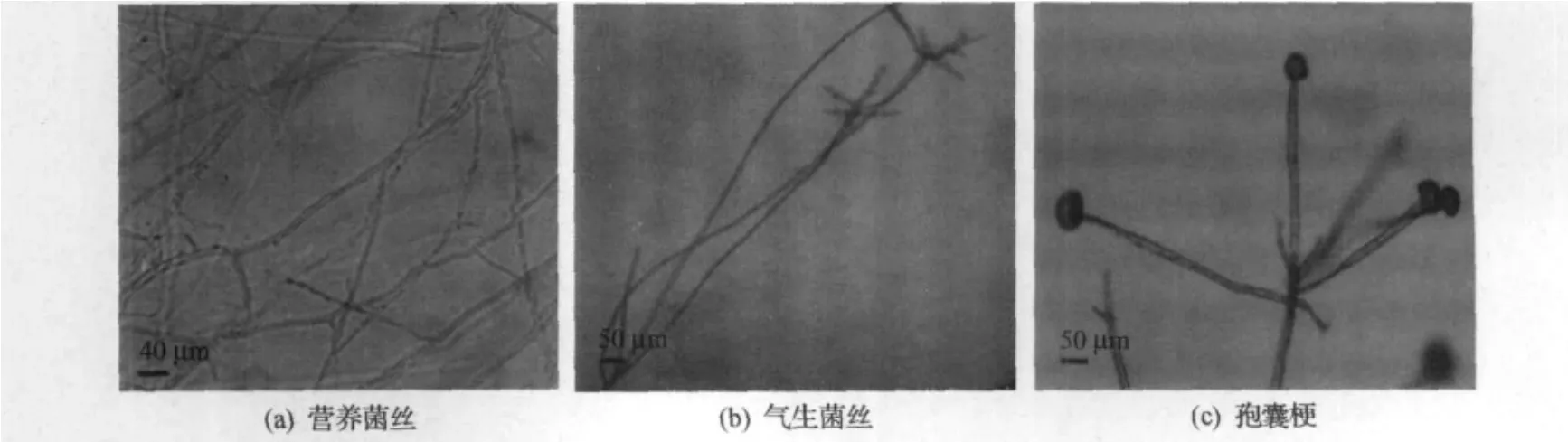
图1 菌丝及孢囊梗Fig.1 Hypha and sporangiophore
2.2.3 孢子囊
孢子囊是某些霉菌发育到一定阶段,由气生菌丝或孢囊梗顶端膨大形成的“囊状”的,内含孢囊孢子的特殊结构.如图2(a,b)所示,ZGB1孢子囊呈球形或洋犁形、表面绒毛状、黄褐色、囊壁粗糙,成熟后囊壁消解释放出孢囊孢子,孢子囊形状与毛霉属的多数种及放射毛霉属相似;孢子囊直径30.0~70.0 μm,这与放射毛霉属及毛霉属的总状枝毛霉、冻土毛霉、易脆毛霉相似.
2.2.4 囊 轴
囊轴又称囊柱或中轴,是孢囊梗的一种延伸,孢子囊成熟后,有些霉菌的囊壁会消解,释放出孢囊孢子,露出囊轴.但只有霉菌的某些特定种属具有囊轴结构.如图2(c)所示,ZGB1的囊轴无色光滑,圆形或卵圆形,直径25.0~60.0μm,有囊领、无囊托,这与放射毛霉属及毛霉属的分散毛霉、闪孢毛霉类似.
2.2.5 孢囊孢子
某些霉菌发育到一定阶段,孢子囊形成后,囊中的核经多次分裂,形成大量密集的有原生质包裹的核,然后生出各自的孢子壁,形成一个个的孢子.这种孢子形成于囊状结构的孢子囊中,因而得名孢囊孢子,该孢子为无性孢子.如图3(a)所示,ZGB1孢囊孢子呈短卵形或球形,直径7.9~24.0μm,略透 明,表面光滑.

2.2.6 厚垣孢子
图3(b)为 ZGB1的厚垣孢子,直径10.5~21.0μm.厚垣孢子属无性孢子,很多霉菌都能形成这类孢子.其形成过程是:在气生菌丝或孢囊梗中某处膨大、原生质浓缩、变圆,类脂物质密集,然后生出厚壁或原细胞壁增厚,形成圆形或纺锤形的厚垣孢子.它是霉菌抵抗不良环境条件,产生的一种休眠体,当菌丝体死亡后,其厚垣孢子还能存活很久,当遇到适宜条件时又可萌发成菌丝体[13].
2.2.7 节生孢子
节生孢子又叫粉孢子,是菌丝生长到一定阶段产生的一种卵圆形、成串如念珠状的结构,属无性孢子范畴[13].如图3(c)所示,ZGB1的节生孢子直径7.9~13.2μm.
根据以上实验结果,参照魏景超《真菌鉴定手册》[14]及郑儒永[15]、Khan Z U[12]等报道,从形态上将ZGB1与其他丝状真菌进行了分析比较,初步鉴定ZGB1属于毛霉科(Mucoraceae)的放射毛霉属(Actinomucor).
2.3 生理生化特性
2.3.1 最适温度
将ZGB1孢子点种PDA平板,分别于22,25,28,31,34,37,40℃恒温培养,测48 h时菌落直径,确定温度对其生长的影响.结果如图4所示,该菌最适生长温度为28℃,此温度下生长旺盛菌丝洁白,菌丛较高;37℃生长受抑制菌丛稀疏低矮;40℃完全不生长.这与总状枝毛霉及布氏毛霉相似.


图4 温度对ZGB1生长的影响Fig.4 Effect of temperature on the growth of ZGB1
2.3.2 最适pH
分别配制初始pH 为5.0,5.5,6.0,6.5,7.0,7.5,8.0的液体PDA培养基,接种ZGB1孢子,每样三个平行.于28℃,180 r/min培养24 h,抽滤收集菌体,65℃烘干至恒重,称量并计算菌体产量.结果如图5所示,当初始pH为6.5时ZGB1生长良好,菌体产量最高;当初始pH小于6.5时,ZGB1菌体产量随pH的提高而增加;初始pH超过6.5后菌体产量呈下降趋势.所以,ZGB1生长的最适初始pH在6.5左右.

图5 pH对ZGB1生长的影响Fig.5 Effect of pH on the growth of ZGB1
2.3.3 生长曲线
将ZGB1孢子悬液接种PDA液体培养基,于28℃,180 r/min培养.每隔6 h取3瓶,抽滤收集菌体,65℃烘干至恒重称量,并计算菌体产量作生长曲线.如图6所示,PDA培养基中对数生长期在6~36 h;稳定期大约在36~66 h(此时菌体产量可达2.64 g/L);66 h开始进入衰亡期,此时菌体量不再增加,反而呈略微下降的趋势.

图6 ZGB1生长曲线Fig.6 The growth curve of ZGB1
2.3.4 最适碳源
以察氏培养基为基础培养基,分别以乳糖、葡萄糖、糖蜜、半乳糖、淀粉、果糖和蔗糖为碳源,制备培养基并接种ZGB1孢子,每样三个平行.于28℃,180 r/min培养48 h,抽滤收集菌体,65℃烘干至恒重,并计算菌体产量.结果如图7所示,ZGB1对单糖的利用率要高于双糖,对淀粉利用率最差,而且在单糖中以葡萄糖为佳.
2.3.5 最适氮源
以察氏培养基为基础培养基,分别以NaNO3、酵母膏、蛋白胨、NH4NO3、黄豆粉、牛肉膏和CO(NH2)2为氮源,制备培养基接种ZGB1孢子,每样三个平行.于28℃,180 r/min培养48 h,抽滤收集菌体,65℃烘干至恒重测其质量.结果如图8所示,ZGB1对有机氮源利用率要高于无机氮源,且以酵母浸膏为佳.

2.4 分子鉴定

图9 ZGB1的18S与ITS r DNA序列Fig.9 18S and ITS r DNA sequences of ZGB1
如图9所示,以18S和ITS通用引物进行PCR扩增,分别得到约1.5 kb和略小于750 bp的片段.回收目的片段,测序明确其大小分别为1 522 bp和718 bp.序列提交Gen Bank数据库注册,获得登录号分别为JN604987和JN887460.
将两序列分别在NCBI数据库中BLAST比对,ZGB1的18S rDNA序列与雅致放射毛霉相似度达99%;而ITS rDNA序列与雅致放射毛霉的两个亚种(Actinomucorelegansvar.strain ATCC52360及Ac-tinomucorelegansstrain CBS111556)相似度均为100%.分别从比对结果中选取相似度最高的菌株,用MEGA4.1构建系统发育树.如图10,11所示,18S r DNA系统发育树中ZGB1与雅致放射毛霉位于同一分支,亲缘关系最近.ITS r DNA系统发育树中,ZGB1与雅致放射毛霉的两个亚种(Actinomucorelegansvar.strain ATCC52360及Actinomucor elegansstrain CBS111556)亲缘关系最近.

2.5 ATP合成能力测定
用该菌以腺嘌呤为底物进行ATP的合成,反应液进行纸电泳检测,考察其ATP合成水平.图12为反应10 h时的纸电泳结果,在紫外透射仪下可以看到ATP及腺嘌呤斑点,ATP与腺嘌呤分别于点样点两侧,向相反方向迁移.

图12 反应产物纸电泳Fig.12 Paper electrophoresis of reaction product
如图13所示,当腺嘌呤投加量为3 g/L时,反应10 h时ATP产量达到最大,最大值为9.84 g/L,摩尔转化率(实际产量与理论产量的物质的量之比)为80.46%.此后,反应液中的ATP含量随时间的增加降低,其原因可能是反应液内葡萄糖耗尽,不能再为腺嘌呤到ATP的转化反应提供能量,反应变为以逆反应为主,反应液中的ATP被逐渐消耗,同时在腺嘌呤与点样点之间会出现ADP及AMP斑点.
3 结 论
根据形态特征、生理生化特性、18S与ITS r DNA序列比对结合系统发育树分析,鉴定该菌为雅致放射毛霉的突变株,命名为Actinomucorelegansstrain ZGB1.该菌在分类学中的地位为真菌门(Fungi)、藻菌纲(Phycomycetes)、毛霉目(Mucorales)、毛霉科(Mucoraceae)、放射毛霉属(Actinomucor)和雅致放射毛霉(Actinomucorelegans).雅致放射毛霉,又名匍匐放射毛霉,是腐乳酿造中的常用菌种之一[16].该菌具有丰富的酶系,能分泌胞内酶和胞外酶,能用于制备氨肽酶[17]、蛋白酶[18]及神经酰胺[19]等,是一株极具应用价值的菌株.另外,该菌磷酸化系统较强,能以腺嘌呤为底物合成ATP,腺嘌呤投加量为3 g/L时,ATP产量可达9.84 g/L,腺嘌呤到ATP的摩尔转化率为80.46%.目前该工艺尚存在腺嘌呤转化不彻底的问题,尤其是当腺嘌呤投加量增大时,腺嘌呤到ATP的转化率呈下降趋势,所以该工艺转化条件及补料方法尚需进一步优化,另外可通过理化诱变以及基因工程技术对该菌进行改造,构建以腺嘌呤合成ATP的高产菌株,这些都需要建立在明确该菌在分类学中地位、了解其生理生化特性的基础之上,所以该菌的鉴定工作十分必要.
[1]LUDEWING B, HOFFMANN M W.Chemosensitivity:methods in molecular medicine[M].Totowa:Humana Press,2005:101-120.
[2]MARRIAGE B J,CLANDININ M T,MACDONALD I M,et al.Cofactor treatment improves ATP synthetic capacity in patients with oxidative phosphorylation disorders[J].Mol Genet Metab,2004,81(4):263-272.
[3]MURUYAMA A,FUJIO T.ATP production from adenine by a self-coupling enzymatic process:high-level accumulation under ammonium-limited conditions[J].Biosci Biotechnol Bio-chem,2001,65(3):644-650.
[4]詹谷宇,谢伯泰,邓邦权,等.用毛霉生产核苷酸类衍生物-毛霉用于以腺嘌呤为底物的ATP酶促合成[J].西北大学学报:自然科学版,1980(2):118-129.
[5]许玖英,岑英华,邓穗儿,等.一株茶碱降解菌的分离和坚定[J].微生物学报,2002,42(5):527-533.
[6]冯欣,张丽琳,孟庆恒,等.一株渤海丝状真菌的形态学及18S r DNA-ITS鉴定[J].信阳师范学院学报:自然科学版,2009,22(1):77.
[7]MOLLER E M,BAHNWEG G,SANDERMAN H,et al.A simple and efficient protocol for isolation of high molecular weight DNA from filamentous fungi,fruit bodies,and infected plant tissues[J].Nucl Acid Res,1992,20(22):6115-6116.
[8]孙立夫,张艳华,裴克全.一种高效提取真菌总DNA的方法[J].菌物学报,2009,28(2):299-302.
[9]孙小丁,郑彦杰,张苓花.微生物基因组DNA氯化苄提取方法优化的研究[J].中国酿造,2006,160(7):9-12.
[10]莎姆布鲁克J.分子克隆实验指南[M].黄培堂,译.2版.北京:科学出版社,2001:105-123.
[11]孙培龙,吴石金.生物化学技术实验指导[M].北京:化学工业出版社,2008:101-102.
[12]KHAN Z U,AHMAD S,MOKADDAS E,et al.Actinomucorelegansvar.kuwaitiensisisolated from the wound of a diabetic patient[J].Antonievan Leeuwenhoek,2008,94(3):343-352.
[13]蔡信之,黄君红.微生物学[M].2版.北京:高等教育出版社,2012:49-56.
[14]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:58-74.
[15]ZHENG Ru-yong,LIU Xiao-yong.Actinomucorelegans var.meitauzae,the correct name forA.taiwanensisandMucormeitauzae(Mucorales,Zygomycota)[J].Nova Hedwigia,2005,80:419-431.
[16]李蓓,李晓晖,衣杰荣.对硝基苯酚法对雅致放射毛霉脂肪酶特性的研究[J].食品工业科技,2011,32(11):220-222.
[17]ITO K,MA Xiao-hang,AZMI N,et al.Novel aminopeptidase specific for glycine fromActinomucorelegans[J].Biosci Biotechnol Biochem,2003,67(1):83-88.
[18]PAN Jin-Quan,LUO Xiao-chun,XIE Ming-quan,et al.Purification and characterization of one alkaline protease fromActinomucorelegansAS3.2778[J].China Biotchnology,2008,28(9):111-118.
[19]刘克武,李佳,刘鑫.一种雅致放射毛霉用于生产神经酰胺的
用途:中国,ZL200410022221[P].2004-04-05.
Identification of aMucoroverproducing ATP from adenine
ZHU Jia-rong,YANG Shan-yan,YANG Guang-hui,QIU Juan-ping
(College of Biological and Environmental Engineering,Zhejiang University of Technology,Hangzhou 310032,China)
To determine the status of aMucorZGB1 in taxonomy,which can efficiently synthesise ATP,it was identified based on morphological observation,physiological and biochemical property analysis,18S and ITS r DNA sequence analysis.The optimum temperature for growth was 28℃.The range of its log growth phase was 6~36 h.The adequate pH was 6.5.The optimum carbon was glucose.Its optimum nitrogen source was yeast extract.The homology of 18S r DNA sequences(Accession No.JN604987)ofMucorZGB1 withActinomucoreleganswas 99%.The homology of ITS r DNA sequences(Accession No.JN887460)ofMucorZGB1 with two subunits ofActinomucorelegans(Actinomucorelegansvar.strain ATCC52360 andActinomucor elegansstrain CBS111556)was 100%.So ZGB1 was identified as one mutant strain ofActinomucorelegansand namedActinomucorelegansstrain ZGB1.9.84 g/L ATP was accumulated from 3 g/L adenine and the molar conversion ratio was 80.46%.
Mucor;identify;18S r DNA;ITS r DNA
Q939.97
A
1006-4303(2013)02-0171-07
2012-02-20
朱家荣(1954—),男,上海人,副教授,研究方向为应用微生物学,E-mail:zjzjr@zjut.edu.cn.
(
陈石平)

