蚯蚓蛋白质组双向电泳技术体系的建立及条件优化
吴石金,赵士良,沈飞超,徐 铭
(浙江工业大学 生物与环境工程学院,浙江 杭州 310032)
蚯蚓蛋白质组双向电泳技术体系的建立及条件优化
吴石金,赵士良,沈飞超,徐 铭
(浙江工业大学 生物与环境工程学院,浙江 杭州 310032)
对赤子爱胜蚓(Eiseniafetida)表皮组织的两种蛋白质提取方法进行了比较,并对双向电泳IPG胶条pH范围,上样量条件进行了优化,结果表明:裂解液提取法提取的蛋白质量浓度较低,蛋白种类缺失,采用TCA-丙酮沉淀法提取法,可显著提高提取液蛋白质提取效果,样品中蛋白质质量浓度可达12.49μg/μL.蚯蚓表皮组织蛋白质主要分布在pH范围4~7之间,适于选用24 cm pH 4~7线性梯度IPG胶条,采用考马斯亮蓝染色法时最适上样量为600μg,所得电泳图谱可检测蛋白点达(629±20)个,且重复性实验匹配率较高.用TCA-丙酮沉淀法提取蚯蚓表皮组织蛋白质组,按优化的参数进行双向电泳分离,所得图谱分辨率高、重复性好,可用于蚯蚓蛋白质组学研究.
赤子爱胜蚓;蛋白质组;TCA-丙酮;双向电泳;条件优化
蛋白质组(proteome)是由 Wilkins和 Williams于1995年首次提出,并定义为“由基因组所表达的全部蛋白质”[1].双向电泳(two-dimensional electro-phoresis,2-DE)是蛋白组学研究中的核心技术之一,原理是利用蛋白质等电点(isoelectric points,p I)和分子量(molecular weight,MW)的不同将样品蛋白质组在二维平面上进行分开,是目前常用的一种能够连续在一块胶上分离数千种蛋白质的方法[2].利用双向电泳技术对微生物和动植物全蛋白组进行分析,为毒理反应提供蛋白质水平理论依据的研究已非常广泛,如李明云等[3]对低温胁迫大黄鱼(Pseudosciaenacrocea)肝组织损伤进行双向电泳分析并找到了4个差异蛋白,陈国良等[4]建立了青杨(Populu)叶片双向电泳技术体系并运用于盐胁迫毒性研究.双向电泳技术的关键是样品制备,其决定了所得图谱的分辨率和清晰度,样品制备的目的是尽可能提取全部蛋白质并防止其降解,同时除去样品中非蛋白质成分,减少对双向电泳的干扰.生物组织成分复杂,且不同生物蛋白质组差异较大,目前为止没有一种通用的蛋白质提取方式,因此需要根据研究对象组织特性进行方法筛选.此外,双向电泳过程中IPG胶条pH范围选择、上样量等技术条件,也对图谱中蛋白点的信息量以及实验重复性也有着巨大影响.
赤子爱胜蚓(Eiseniafetida)属环节动物门寡毛纲(Oligochaeta),是土壤中生物量最大的无脊椎动物.蚯蚓对土壤中的污染物有着不同程度的反应,首先表现为分子水平上的变化,进而影响到生存、生长和繁殖,甚至造成死亡.因此,以蚯蚓作为指示生物,通过分子生物学工具寻找污染标记物来诊断土壤污染生态毒理已成为研究热点[5].宋玉芳等[6]研究发现菲、芘单一与复合污染与蚯蚓致死率显著相关,蚯蚓体内细胞色素P45和金属硫蛋白等也被研究发现可作为生物标志物蛋白运用于污染检测[7].为了进一步从蛋白质组学水平上对蚯蚓进行生物毒理学研究,就需要建立适用于蚯蚓组织的双向电泳技术.蚯蚓表皮组织成分复杂,含有大量多糖,核酸,脂类和盐离子等物质,以及大量具有自我消化机制的蛋白水解酶[8],使得蚯蚓的样品制备具有特殊性和复杂性.笔者通过对蚯蚓表皮组织不同蛋白质提取方法进行比较和加以改进,并对IPG胶条pH范围以及双向电泳上样量进行优化,建立具有高分辨率和重复性的蚯蚓双向电泳技术体系,为后续的蚯蚓蛋白质组学研究奠定基础.
1 材料和方法
1.1 材 料
赤子爱胜蚓(Eiseniafetida)购于浙江省金华蚯蚓养殖公司.蚯蚓在拌有牛粪和自然土壤(浙江工业大学校园花圃采取并晒干处理)的培养箱内,25℃恒温培养,选取成年(头部以下具具有明显生殖环带)并且体重、体长相近的蚯蚓作为实验对象.
1.2 主要化学试剂和仪器设备
尿素、硫脲、甲叉丙烯酰胺、丙烯酰胺、十二烷基硫酸钠(SDS)、3-[3-(胆酰胺基丙基)二甲氨基]丙磺酸盐(CHAPS)、四甲基乙二胺(TEMED)、二硫苏糖醇(DTT)、碘乙酰胺、蛋白酶抑制剂(cocktail)及考马斯亮蓝为上海生工生物有限公司生产,三氯乙酸、丙酮和其他试剂为国产试剂.固相IPG胶条(pH 3~10,24 cm;pH 4~7,24 cm,均为线性pH梯度),载体两性电解质(Bio-lyte pH 3~10,pH 4~7)和上样缓冲液试剂盒等为Bio-Rad公司生产.所有溶液配制用水均由Millipore公司生产Mlilli-Q超纯水仪提供.
双向电泳系统,包括一向IPGphor3型等电聚焦仪,二相SDS垂直电泳仪,为GE公司生产.生产UV1000型紫外/可见光分光光度计为上海天美科学仪器有限公司生产,以及UMAX2100XL大型扫描仪,双向电泳图谱分析软件Image Master 2D platinum 6.0等.
1.3 蛋白质提取方法
1.3.1 裂解液提取法
参照双向电泳技术操作手册[9]建议方法并加以调整.清理后的蚯蚓表皮组织置于预冷研钵中,加入9倍体积的裂解液(裂解液A:8 mol/L尿素,4%CHAPS,1%DTT,0.2%Bio-lyte,0.1%蛋白酶抑制剂;裂解液 B:7 mol/L 尿素,2 mol/L 硫脲,4%CHAPS,1%DTT,0.2%Bio-lyte,0.1%蛋白酶抑制剂)和少量石英砂冰上研磨,收集样品加入1.5 mL EP管,4℃裂解30 min(期间剧烈震荡3次),在15 000 g(4 ℃)下离心15 min,取上清,-20℃保存.
1.3.2 TCA-丙酮沉淀法
参照Damerval[10]所提到的方法并加以调整,清理后的蚯蚓表皮组织置于预冷研钵中,加入9倍体积含1%DTT和10%TCA的丙酮溶液及少量石英砂于冰上碾磨,收集样品加入1.5 mL EP管,于4℃沉淀过夜,在15 000 g(4℃)下离心30 min.将沉淀重悬于含1%DTT的预冷丙酮中,-20℃放置1 h后15 000 g(4℃)离心30 min,于通风橱内使丙酮充分挥发,得到干燥的沉淀,15 000 g(4℃)离心1 h,-20℃保存.改良后的TCA-丙酮沉淀法,沉淀加入丙酮清洗的步骤重复两次,在丙酮充分挥发后将沉淀溶解于上样缓冲液.
所得样品均参照Bradford蛋白定量法[11],以牛血清蛋白作为标准蛋白测定样品蛋白质质量浓度,用μg/μL表示.
1.4 双向电泳
1.4.1 第一向固相pH梯度等电聚焦电泳
取经过Bradford蛋白定量法确定蛋白质质量浓度的样品,控制上样量分别为400,600,800μg用上样缓冲液补充至450μL,小心加入等电聚焦水化槽,去掉IPG胶条保护膜胶面朝下对准正负极放入水化槽,覆盖3 mL矿物油后加盖进行等电聚焦,等电电泳参数设置:水化12 h,梯度除盐250 V×1 h,500 V×1 h,1 000 V×1 h,2 000 V×1 h,4 000 V×1 h,高压聚焦8 000 V×10 h,保持500 V×1 h.
1.4.2 IPG胶条的平衡
等电聚焦结束后,IPG胶条依次在平衡液A(6 mol/L尿素,2%SDS,60 mmol/L Tris-HCl pH 8.8,30%甘油,0.001%溴酚蓝,1%DTT)和平衡液B(6 mol/L 尿 素,2%SDS,60 mmol/L Tris-HCl pH 8.8,30%甘油,0.001%溴酚蓝,2.5%碘乙酰胺)中各平衡15 min,经超纯水清洗1 s后转移至胶体体积分数12.5%的二相SDS-PAGE凝胶上端,并用低熔点琼脂糖封顶.
1.4.3 第二向SDS-PAGE电泳
首先以每块胶恒定功率5 W电泳2 h,当观察到溴酚蓝指示剂由第一向胶条转移到第二向凝胶后加大功率至每块胶10 W,当溴酚蓝指示剂接近底部边缘时停止电泳,电泳全程由冷却循环系统控制温度为20℃.
1.4.4 凝胶染色与扫描
采用考马斯亮蓝染色法[12],凝胶用超纯水清洗3 min,加入750 mol/L固定液(50%甲醇,12.5%冰醋酸)固定1 h,超纯水清洗后加入染色液(1.25 g/L考马斯亮蓝R-250,45%甲醇,10%冰醋酸)于摇床内染色30 min,染色结束后用脱色液与摇床内(10%甲醇,10%冰醋酸)反复脱至图谱清晰,凝胶转移到扫描仪上扫描,最后于含有20%甘油的超纯水中保存.
2 结果与讨论
2.1 蛋白质提取方法选择
2.1.1 蛋白质得率
两种裂解液和传统以及改进后的TCA-丙酮沉淀法蛋白提取样品总蛋白质量浓度,见表1,最高与最低值相差不超过15%,说明4种方法在蛋白提取总量上没有显著差距.裂解液提取法蛋白质得率相对较低,添加硫脲后提取效果有所提升,但不明显,改良前的TCA-丙酮沉淀法的蛋白质得率最高,改良后蛋白质得率略有下降.分析原因为裂解液对蚯蚓组织蛋白质的变性能力低于TCA-丙酮沉淀法,在含有尿素的裂解液中添加硫脲,仍然难以溶解分子量较高的蛋白质,同时裂解液蛋白酶抑制效果较差,造成了提取过程中蛋白质的降解损失,而改良后的TCA-丙酮沉淀法,则是因为增加了丙酮清晰的步骤,导致了少量蛋白质的损失.

表1 不同蛋白质提取方法样品蛋白质质量浓度Table 1 Protein content extracted by different protein extraction method μg/μL
2.1.2 蛋白质提取效果SDS-PAGE分析
不同蛋白质提取方法所制备样品单向SDSPAGE电泳分析结果,如图1所示,裂解液提取法样品蛋白条带难以辨识,在裂解液中添加硫脲后,在蛋白质分子量45 k Da以下出现了部分蛋白条带,但仍然比较模糊,TCA-丙酮沉淀法样品蛋白条带数量较多,且比较清晰,分布于各个分子量区间,改良后的TCA-丙酮沉淀法样品条带表现效果较改良前更好,实验结果与龙峰[13]对于脑脊液的蛋白质提取研究类似,分析原因为裂解液所制备样品盐离子和脂类等杂质含量较高,阻碍了蛋白质的变性和溶解,并对电泳造成了影响,而改良后的TCA-丙酮沉淀法杂质去除能力相对较好,所制备蛋白质样品更符合双向电泳的技术要求.综上考虑,改良后的TCA-丙酮沉淀法在蚯蚓表皮组织蛋白质提取质量浓度、提取种类丰富度上,均优于裂解液提取法,更适于蚯蚓表皮组织的双向电泳样品制备.

图1 不同蛋白提取方法样品SDS-PAGE电泳图谱Fig.1 SDS-PAGE pattern of Eiseniafetida protein samples extracted by four methods
2.2 蚯蚓蛋白质的双向电泳
2.2.1 不同pH范围IPG胶条双向电泳
IPG胶条pH范围的优化原则是先宽后窄,pH范围较宽的胶条,可用于确定样品中蛋白质分布的大体规律,然后选取符合目标生物蛋白质等电点主要分布区域的窄pH范围IPG胶条,提高低丰度蛋白点和重叠蛋白点的分辨率[14].选用pH 3~10的24 cm IPG胶条进行双向电泳所得图谱,如图2(a)所示,蛋白点分离效果不明显,大部分蛋白点集中于胶上pH 4~7的区域内,蛋白点重叠情况严重,难以分辨,可知蚯蚓表皮组织蛋白质等电点主要分布在4~7之间,为了提升这一区间内蛋白点的分离效果,选用pH 4~7的IPG胶条进行双向电泳,如图2(b)所示,蛋白质等电聚焦效果明显增强,原本聚集在pH 3~10 IPG胶条等电点4~7之间的蛋白点也能获得较好的分离,且低丰度蛋白丢失的情况明显减少,分辨率有很大改善.因此,为提升蚯蚓表皮组织双向电泳图谱蛋白点分辨率,应选用24 cm pH 4~7的IPG胶条.从图2(b)中还发现,等电点酸性端的蛋白质分布较少,而在碱性端上发现因为IPG胶条pH范围不足而无法继续聚焦的蛋白点,可见蚯蚓表皮组织蛋白质中存在一定强碱性蛋白质,为了进一步提升双向电泳图谱上的信息量,在后续的研究中可选择扩大IPG胶条的碱性pH范围,或者选择宽等电点范围非线性梯度IPG胶条.2.2.2 不同上样量对双向电泳的影响

图2 蚯蚓蛋白质样品不同pH梯度范围IPG胶条双向电泳图谱Fig.2 2-DE patterns of Eiseniafetida extracts using different pH gradient IPG strips

图3 蚯蚓蛋白质样品不同上样量双向电泳图谱Fig.3 2-DE patterns of Eiseniafetida extracts with different loading sample quantity
上样量直接影响电泳图谱上的蛋白点的分辨效果,整个双向电泳技术流程具有高度复杂性,上样量的大小还与胶条长度,pH范围,染色方法有关.保持其他电泳参数不变,对上样量分400,600,800μg 3个梯度进行考察,所得图谱见图3.当上样量为400μg时,如图3(a)所示,蛋白点稀少,只检测出(187±20)个蛋白点,分析原因为上样量过低,电泳中部分蛋白质无法成功从第一向转移至第二向,而低丰度的蛋白无法染色和分析,导致大量蛋白点的丢失;当上样量为600μg时,如图3(b)所示,分离效果有了明显改善,共检测出(629±20)个蛋白点,为检测数最多,且背景清晰,蛋白点重叠较少;当上样量为800μg时,如图3(c)所示,低丰度的蛋白点表现较好,但是在电泳图谱蛋白分子量45~99 k Da和等电点5~6之间出现大量高丰度蛋白点的横向条纹,且蛋白点重叠的现象非常严重,电泳背景较深,导致此区域蛋白点相互干扰,检测结果误差增大,蛋白点检测数为(524±20)个,分析原因为上样量过高,导致第一向等电聚焦负担加重,且杂质含量增加,造成蛋白点等电分离不完全[15].综合考虑,采用考马斯亮蓝染色方法时,为尽可能提高低丰度蛋白点的表现效果的同时不影响等电聚焦和图谱背景,应选择600μg为最佳上样量.
2.2.3 蚯蚓双向电泳体系重复性验证
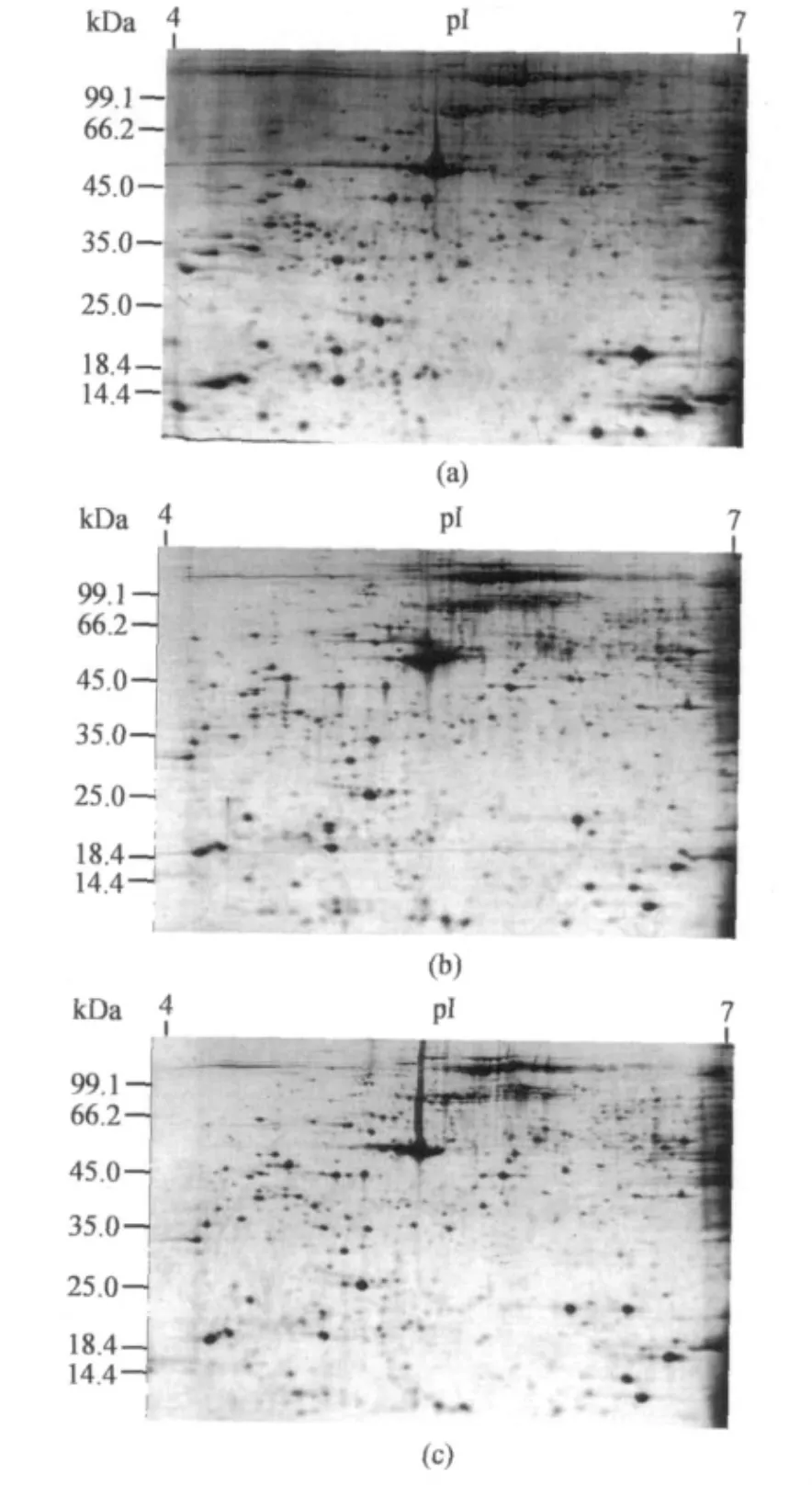
图4 蚯蚓蛋白质样品3次双向电泳所得图谱Fig.4 2-DE patterns of Eiseniafetida extracts for 3 times
蚯蚓组织蛋白质样品以相同实验条件(采用TCA-丙酮沉淀法制备样品,IPG胶条选择24 cm pH 4~7,上样量为600μg,凝胶采用考马斯亮蓝染色)分别进行三次双向电泳,所得图谱如图4(a—c)所示,三张电泳图谱蛋白点检测数均大于600.利用Image Master2D软件对图谱进行分析,将三张图谱合成为为一张合成图谱,作为参考胶,三张图谱和参考胶蛋白点的平均配对率达到83%以上.从实验结果可知,此双向电泳体系所得蚯蚓表皮组织蛋白质组电泳图谱蛋白点信息量大,分辨率高,同时具有较高的重复性,可以满足蚯蚓蛋白质组学分析研究的要求.
3 结 论
建立了适用于蚯蚓表皮组织的双向电泳技术体系,具体方法和参数设置:采用改良的TCA-丙酮沉淀法对蚯蚓表皮组织进行蛋白质提取,选择长度24 cm pH梯度范围为4~7的IPG胶条进行等电电泳,选用考马斯亮蓝染色法作为凝胶染色方法时,最适上样量为600μg,所得双向电泳图谱利用Image Master2D分析可检测蛋白点达(629±20)个.重复性实验结果表明,该方法所得电泳图谱蛋白点清晰,背景较低,且重复性好,能够满足蚯蚓蛋白质组学研究的需要.
[1]PENNINGTO S R,WILKINS M R,HOCHSTRASSER D F,et al.Proteome analysis:from protein characterization to biological function[J].Trend Cell Biol,1997,7(4):168-173.
[2]杜鹏.蛋白质组双向电泳技术研究进展[J].卫生研究,2005,34(2):237-240.
[3]李明云,冀德伟,吴海庆,等.低温胁迫下大黄鱼肝脏蛋白质组双向电泳分析[J].农业生物技术学报,2010,18(2):323-328.
[4]陈国良,蒋晶,乔桂荣,等.青杨双向电泳实验体系的建立[J].浙江林学院学报,2009,26(5):644-651.
[5]王晓尉,张波.蚯蚓分子生物标志物在土壤氯代苯胺类污染评价中的应用研究[J].农业环境科学,2010,29(8):1490-1494.
[6]宋玉芳,周启星,许华夏,等.菲、芘、1,2,4-三氯苯对蚯蚓的急性毒性效应[J].农村生态环境,2003,19(1):36-39.
[7]周世萍,于泽芬,段昌群,等.蚯蚓分子标记物在环境监测中的应用研究进展[J].环境科学导刊.2008.27(1):85-88.
[8]蔡明才,艾娜,张梁,等.蚯蚓蛋白质的自溶与开发应用[J].生物学通报,2004,39(4):23-24.
[9]BERKELMAN T,STENSTED T.2-D electrophoresis using immobilized pH gradients:principles and methods[M].Piscataway:Amersham Pharmacia Biotech,1998:17-46.
[10]DAMERVAL C,DE VIENNE D,ZIVY M,et al.Technical improvements in two-dimensional electrophoresis increase the level of genetic variation detected in wheat-seedling proteins[J].Electrophoresis,1986,7(1):52-54.
[11]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biocherr,1976,72(2):248-254.
[12]ZHOU Zhi-dong,LIU Wang-yi,LI Min-qian.An improved coomassie brilliant blue(CBB R-250)Staining to proteins in gels[J].Nuclrar Science and Techniques,2002,13(4):253-257.
[13]龙峰.TCA/丙酮沉淀对脑脊液标本中蛋白质双向电泳的影响分析[J].四川医学,2010,31(4):532-533.
[14]刘建军,房师松,李习艺,等.蛋白质组研究技术平台的建立—双向电泳条件的建立及优化[J].卫生研究,2004,33(3):327-330.
[15]舒海燕,曹刚强,凌华,等.双向电泳过程中的常见问题及解决方法[J].安徽农业科学,2009,37(3):1223-1224.
Establishment and optimization of two-dimensional gel electrophoresis technology system for earthwormEiseniafetidaepithelium proteome
WU Shi-jin,ZHAO Shi-liang,SHEN Fei-chao,XU Min
(College of Biological and Environmental Engineering,Zhejiang University of Technology,Hangzhou 310032,China)
In order to establish and optimize two-dimensional electrophoresis(2-DE)technology system for earthwormEiseniafetidaepithelium proteome,sample preparation method,loading quantity of samples,appropriate IPG strips and system repetition were studied.The results showed that,compared with the lysis buffer extraction method,TCA-A extraction method could increase the protein extracting efficiency up to 12.49μg/μL.While the 24 cm IPG strip(pH 4~7)and 600μg loading sample quantity were considered to be the optimal condition for 2-DE analysis of earthwormEiseniafetidaepithelium proteome,up to(629±20)protein spots can be detected on the gel after coomassie brilliant blue R-250 staining,repeatability of the system also turned out to be good.Therefore,the high resolution and repeatable 2-DE technology system could be wildely used in proteome study of earthwormEisenia fetida.
Eiseniafetida;proteome;TCA-A;two-dimensional electrophoresis;optimization
Q503
A
1006-4303(2013)02-0156-05
2012-03-09
国家自然科学基金资助项目(20977087);浙江省自然科学基金资助项目(Y5090054);浙江省公益技术研究社会发展项目(2010C33G2020078)
吴石金(1971—),男,江西赣州人,教授,博士,研究方向为蛋白质组学技术,E-mail:wujan28@zjut.edu.cn.
(
陈石平)

