肝癌HSP70-肽复合物抗肿瘤研究
黄学珍,刘学政
(1.吉水县双村镇卫生院普外科,江西 吉水331602;2.井冈山大学附属医院神经外科,江西 吉安 343000)
肝癌是临床上常见的恶性度很高的肿瘤,即使进行了根治性手术、规范性放疗和化疗,患者的晚期总会发生肿瘤的转移和复发。其根本原因是患者的免疫功能受到破坏,肿瘤细胞能够逃避机体的免疫监视[1]。因此通过药物或生物制剂的作用,提高肿瘤患者的免疫功能,改变肿瘤患者的免疫低下及免疫缺陷,增强机体对肿瘤细胞免疫力和杀伤力,对抗肿瘤的研究具有重要的指导意义;其次,T细胞介导的免疫反应在机体抗肿瘤作用中起重要作用,因此诱导激活T细胞的主动抗肿瘤作用是提高机体免疫能力的重要环节。本研究通过改良的凝胶梯度洗脱法从手术切取肝癌组织中分离出HSP70-肽复合物并激活T淋巴细胞,观察激活T淋巴细胞对肝癌细胞的杀伤作用。
1 材料与方法
1.1 材料与试剂
标本肝癌组织系井冈山大学附属医院提供,均经病理诊断为细胞性肝癌。蛋白分子质量Marker(广州华美生物工程公司),DEAE-52纤维素(whatman 分装),SGC-6801 肝癌细胞珠(sigma公司),硝酸纤维素薄膜(上海生物制品所),3H-TdR(美国强生公司)。
1.2 实验方法
1)肝癌HSP70-肽复合物的提取和纯化:取肝癌组织 125 g,匀浆,经 43℃加热 1 h,离心(1 000 r·min-1,10 min)取上清液,5 h后用4倍体积裂解液[0.05 mmol·L-1Tris-HCl(pH 7.2),含 0.05%trypsin、0.1 mmol·L-1PMSF、0.1%NaHPO4·12H2O]裂解细胞,胞膜破裂后高速离心(5 000 r·min-1,15 min)取上清液,用SephadexG-100粉50 g和层析缓冲液100 mL充分搅匀,用玻璃层析柱使其沉降倒除上层混悬液后静止3 d。经DEAE-52 cellulose柱梯度洗脱,测吸光度A值(波长280 nm),收集各峰蛋白,通过对分子质量的鉴定,取相对分子质量70 000组份。
2)T淋巴细胞的提取:用尼龙毛和磁珠交联法分离T淋巴细胞,淋巴细胞分离液常规分离PBMC,将要分离的单个核细胞(PBMC)倒入注射器内,盖上注射器,37℃温育36 min至1 h。将特异性抗T淋巴细胞单克隆抗体与磁性小珠交联形成免疫磁珠,用免疫磁珠从PBMC中结合T淋巴细胞,打开下口,缓慢放流(1滴·min-1),收集于离心管中。
3)肝癌HSP70-肽复合物激活T淋巴细胞:于48孔板中加入T淋巴细胞(1×106反应细胞)和肝癌HSP70-肽复合物,置37℃。5%CO2环境中培养,予离心(1 000 r·min-1,10 min)后收集其上清液。
4)肝癌HSP70-肽复合物激活T淋巴细胞对肝癌细胞的体外杀伤作用:建立实验组(效应细胞为肝癌HSP70-肽复合物激活T淋巴细胞)和对照组(为未经激活的淋巴细胞),每组50份样本,并分别设立效应细胞和靶细胞平行对照孔,培养基调靶细胞浓度为1×104mL-1,效应细胞浓度为1×104mL-1,效靶之 50∶1,阴性对照孔只加 100 μL RPMI-1640 培养液,阳性对照孔中加100 μL 1 mol·L-1盐酸,每孔效靶细胞各 100 μL,总体积 200 μL,细胞混匀,37 ℃、5%CO2、饱和适度培养48 h,实验终止前4 h每孔加入新鲜配制的 5 mg·mL-1的 MTT 20 μL,离心(1 000 r·min-1)10 min,从每孔中吸出 150 μL 上清液,每孔加入分析纯MDSO 150 μL,震荡溶解5 min,于酶标仪上570 nm处读取OD值,按下列公式计算杀伤率:杀伤活性=上清液cpm×2/(细胞cpm+上清液cpm×2)×100%,cpm为每分钟放射性活性。
1.3 统计学方法
使用SPSS11.5统计软件。计量资料用x±s表示,各组间比较用两个样本的t检验,组内比较用单个样本的t检验。以P<0.05为差异有统计学意义。
2 结果
肝癌细胞经DEAE-52纤维素柱梯度洗脱分离后共有4个蛋白峰,各峰蛋白经电泳和考马斯亮蓝染色鉴定第一峰蛋白在相对分子质量70 000处有一深染的蛋白带,为此本研究得到了相对分子质量约为70 000的肝癌HSP70-肽复合物。
肝癌HSP70肽复合物激活T淋巴细胞(实验组)对肝癌细胞具有明显的杀伤力,未经肝癌HSP70-肽复合物激活的T淋巴细胞(对照组)对肝癌细胞几无杀伤力,2组比较差异有统计学意义(P<0.01),且杀伤活性随着效靶比增加而增加(P<0.05),见表1。
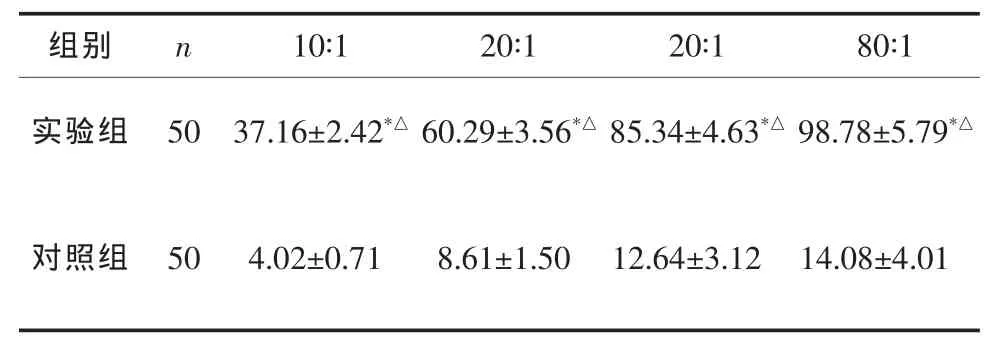
表1 2组肝癌细胞杀伤率比较 x±s,%
3 讨论
热休克蛋白(HSP)是高度保守的蛋白质。HSP根据其分子质量的大小分为HSP90家族、HSP70家族、HSP60家族和小分子HSP 4个家族,各家族在正常的生理反应中低水平表达[2-3],然而,当机体受到紫外线照射、病毒感染、感染性休克、失血性休克、重金属中毒、细菌感染、放射性照射、寄生虫感染、细胞肿瘤恶化的病理和生理刺激情况下HSP的合成迅速增加。HSP70是HSP中最保守,含量最丰富的一类。HSP70在应激刺激及病理状态下生成最为显著,它作为分子伴侣与新结合的多肽链结合,并参与细胞内蛋白质的折叠,装配降解和修复过程,同时,HSP70具有与细胞内的蛋白质和多肽相互作用的功能,以维护蛋白的自稳系统,在细胞的信息传递、分化及获得性免疫反应中具有重要的调控作用,而且它又可作为一种内源性保护物质对机体损伤产生自身保护作用[4]。
有学者对MCA诱导的小鼠肉瘤HSP70的免疫作用进行了研究,发现被免疫鼠产生了抵抗相应HSP活细胞移植的能力,但正常组织来源的HSP不产生这种抗肿瘤移植的能力,而用灭活的自体肿瘤细胞诱导大鼠产生对同一肿瘤的移植排斥,说明HSP诱导的免疫也具有很强的特异性,仅对该肿瘤有作用,从而推测肿瘤细胞中存在肿瘤特异抗原,并在实验中证实小鼠肿瘤移植存在不同个体特异性肿瘤抗原及HSP70具有肿瘤免疫原性[5-6]。
HSP70-肽复合物在肿瘤免疫中的作用及机制及激活树突状细胞(DC)的抗肿瘤免疫有重要意义,DC是最强的抗原提呈细胞,HSP70有效地将肿瘤抗原肽传递给DC,从而达到高效应肿瘤抗原肽的作用,HSP70作为其免疫佐剂具有以下4个优点:1)用凝胶梯度洗脱法从肿瘤组织中制备的HSP70-肽复合物能结合多种肿瘤抗原,用它进行机体肿瘤免疫,不需要确定并分离肿瘤特异性抗原免疫符合物。激发机体产生抗肿瘤特异的激活T淋巴细胞效应,而且这种作用在同种间不受MHCI类分子限制,为肿瘤疫苗治疗提供了新的理论思路。2)肿瘤中提取的HSP70-肽复合物可活化多个T淋巴细胞,对所有肿瘤细胞均有杀伤的作用,避免了免疫逃逸和肿瘤的复发和转移。3)HSP70-肽复合物具有佐剂的功能,因此肿瘤的制备不需要佐剂。4)免疫HSP70-肽复合物可诱导树突状细胞,使机体产生记忆T细胞反应。HSP70-肽复合物在肾癌[7]和黑色素瘤[8]的免疫治疗中已取得了良好的效果。黄波等[9]的研究表明,H22肿瘤混合抗原肽经过HSP70提呈后能抑制肿瘤的生长,而且还可与其他因素配合产生良好的治疗效果。
本实验中,笔者利用肝癌组织提取HSP70-肽复合物,激活T淋巴细胞,并观察激活T淋巴细胞对肝癌细胞的杀伤作用,结果显示肝癌HSP70-肽复合物激活T淋巴细胞对肝癌肿瘤细胞具有很强的杀伤作用。
[1] Cho H S,Shimazu T,Toyokawa G,et al.Enhanced HSP70 lysine methylation promotes proliferation of cancer cells through activation of Aurora kinase[J].B Nat Commun,2012,3:1072.
[2] Tan S S,Ahmad I,Bennett H L,et al.GRP78 up-regulation is associated with androgen receptor status,HSP70-HSP90 client proteins and castrate-resistant prostate cancer[J].J Pathol,2011,223(1):81-87.
[3] Targosz A,Brzozowski T,Pierzchalski P,et al.Helicobacter pylori promotes apoptosis,activates cyclooxygenase(COX)-2 and inhibits heat shock protein HSP70 in gastric cancer epithelial cells[J].Inflamm Res,2012,61(9):955-966.
[4] Zimmermann M,Nickl S,Lambers C,et al.Discrimination of clinical stages in non-small cell lung cancer patients by serum HSP27 and HSP70:a multi-institutional casecontrol study[J].Clin Chim Acta,2012,413(13/14):1115-1120.
[5] Hatfield M P,Lovas S.Role of HSP70 in cancer growth and survival[J].Protein Pept Lett,2012,19(6):616-624.
[6] Sato S,Trackman P C,Mäki J M.The Ras signaling inhibitor LOX-PP interacts with HSP70 and c-Raf to reduce Erk activation and transformed phenotype of breast cancer cells [J].Mol Cell Biol,2011,31(13):2683-2695.
[7] Yu W Y,Chuang T F,Guichard C.Chicken HSP70 DNA vaccine inhibits tumor growth in a canine cancer model[J].Vaccine,2011,29(18):3489-3500.
[8] Dall’Era M A,Oudes A,Martin D B,et al.HSP27 and HSP70 interact with CD10 in C4-2 prostate cancer cells[J].Prostate,2007,67(7):714-721.
[9] 黄波,冯作仕.HSP70-H22肿瘤细胞肽复合物与树突状细胞成熟的关系[J].华中科技大学学报,2002,31(2):133-137.

