紫花苜蓿E180序列和45S核糖体基因的物理定位及染色体荧光分带
喻 凤,窦全文
(1.中国科学院西北高原生物研究所高原生物适应与进化重点实验室,青海 西宁 810001;2.中国科学院大学,北京 100049)
紫花苜蓿(Medicago sativa L.,2n=4x=32)是豆科蝶形花亚科苜蓿属多年生草本植物[1-2]。由于其具有耐干旱、耐贫瘠、耐冷热、产量高而质优、营养丰富等多种特点,常被冠以“牧草之王”的美誉,广泛种植于西北、华北、东北等地区,是中国栽培面积最大的牧草[3]。此外苜蓿同时又是蔬菜、蜜源、肥田、固氮、保持水土并调节生态环境等多功能合一不可多得的宝贵植物[4]。
苜蓿的染色体较小,在根尖细胞中的长度仅为2~3 μm,且大多数为中部着丝粒染色体,形态相似,很难区分。许多学者[5-9]对苜蓿的不同栽培品种及其亚种的核型进行过研究,准确地确定了不同品种的染色体数,建立了相关的核型公式,但均因缺乏稳定可用的细胞学标记,仅根据形态特征区分染色体,致使染色体配对和测量难以准确。此外,学者们也有根据C-带[10]、DAPI-带[11]以及混合的 Cot-1DNA 带[12]对苜蓿的同源染色体进行了较精确的配对,但均未能对染色体上各分带中的分子特性提供直接有力的证据。到目前为止,仅有核糖体DNA作为已知分子信息的探针被反复应用于四倍体苜蓿的分子细胞遗传学标记中[11-13]。因此,苜蓿准确而稳定的分子细胞学核型的建立急切需要更多可识别的分子细胞学标记。
荧光原位杂交(FISH)是将标记的DNA序列定位在染色体或染色质上的一种有效而精准的分子细胞遗传学方法。通过FISH将核糖体基因和特异性重复序列在染色体上进行物理定位,不仅可以为核型分析提供稳定有效的可识别的细胞学染色体标记,而且可以用于研究多倍体植物物种的起源进化、基因组组分的分析、细胞学遗传图谱的构建、染色体的结构变异的检测、基因工程育种等重要的遗传学问题[14-17]。E180 重复序列是 Xia 等[18]于 1993 年在紫花苜蓿中通过酶切消化全基因组克隆到的1个750 bp长的DNA片段,Southern杂交和序列分析显示该片段是以185~188 bp碱基为重复单元组成的高度串联重复序列。
本研究通过设计引物对E180序列进行PCR扩增,再次获得该片段,首次将该串联重复序列作为探针结合45S核糖体基因对两种常用的栽培紫花苜蓿品种进行双色FISH定位,并分析比较其荧光分带,为两种重要的栽培紫花苜蓿种质资源的区分、建立详细的分子细胞遗传学图谱和测序工作的进一步开展提供了可靠的依据。
1 材料与方法
1.1 植物材料
紫花苜蓿栽培品种金皇后和中苜1号均由种子公司直接购买。
1.2 染色体制片
将不同材料的种子放于湿润的滤纸上,室温下发芽。待根尖长至约2 cm时,取出植株于0~4℃冰水中处理24 h。用卡诺液固定30 min以上,取根尖分生区部分,45%醋酸火焰干燥压片,相差显微镜观察,选取中期分裂良好的制片冰冻揭片。
1.3 E180片段的获得
运用Primer Premier 5.0软件对已发表的750 bp E180片段设计引物,上引物序列为:5'-CATGCTTCGATTCGATAAG-3',下引物序列为:5'-GGGTTAAGTGAATTTCCTTG-3'。用 Nagaki等[19]于 1995 年描述的两步PCR程序对E180串联重复序列进行扩增。将扩增的PCR产物富集后,对亮带进行胶回收并进行测序。
1.4 探针标记
用日本鸟取大学Tsujimoto教授提供的含有45 S核糖体基因片段的质粒pWrrn和胶回收后的E180片段分别作为探针制备模板。质粒pWrrn(含45 rDNA)通过缺口平移法用红色Tetramethyl-rhodamine-5-dUTP进行标记;E180片段通过随机引物法用绿色Flurescein-12-dUTP进行标记。
1.5 荧光原位杂交及信号检测
染色体制片在0.2 mol/L NaOH溶液中室温变性10 min后,用-20℃无水乙醇固定。每张制片杂交液为10 μl,其中含有50% 甲酰胺、50%硫酸葡聚糖、1 mg鲑鱼精 DNA、1 μl 20×SSC 和10 ng探针DNA。杂交液在90~92℃变性5 min后,与变性后的制片在37℃下杂交20~24 h。杂交后的制片用双蒸水冲洗,利用含 DAPI(4,6-diamidino-2-phenylindole)的抗荧光衰减封片剂(Vector)封片。用Leica荧光显微镜观察(每个材料观察5个细胞),利用 CCD(Cool snapper,Photometrics)获取图像,利用Photoshop 5.0进行图像后期处理。
2 结果与分析
2.1 E180片段的获得
对E180序列设计引物,引物扩增的目标片段大小为108 bp。以中苜1号基因组为模板,用两步PCR程序对E180片段进行扩增。扩增结果(图1)显示,扩增产物主要为大小不等的弥散条带,且弥散带在1500 bp以下可见规律性的亮带集中分布,其中300 bp处的条带最亮,100 bp和500 bp处次之,500 bp以上隐约可见较弱的主带分布;约100 bp处的亮带被认为是108 bp大小的引物目标片段,约300 bp处的亮带被认为是108 bp的目标片段加上1个E180重复单元(约185~188 bp)的片段,约500 bp处的亮带被认为是108 bp的目标片段加上2个E180重复单元的片段。将最小的亮带进行胶回收后测序,并将该测序结果与原始的E180序列进行比对分析。序列比对结果(图2)显示,PCR扩增的片段相对于原始的E180序列具有2个碱基的缺失和1个碱基的突变。该结果表明E180序列在中苜1号中也呈串联重复分布,可作为很好的荧光原位杂交探针使用。
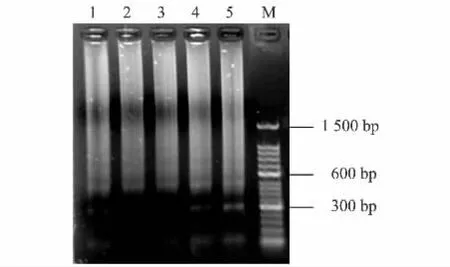
图1 E180 PCR扩增结果Fig.1 The PCR amplification of E180 repetitive sequence
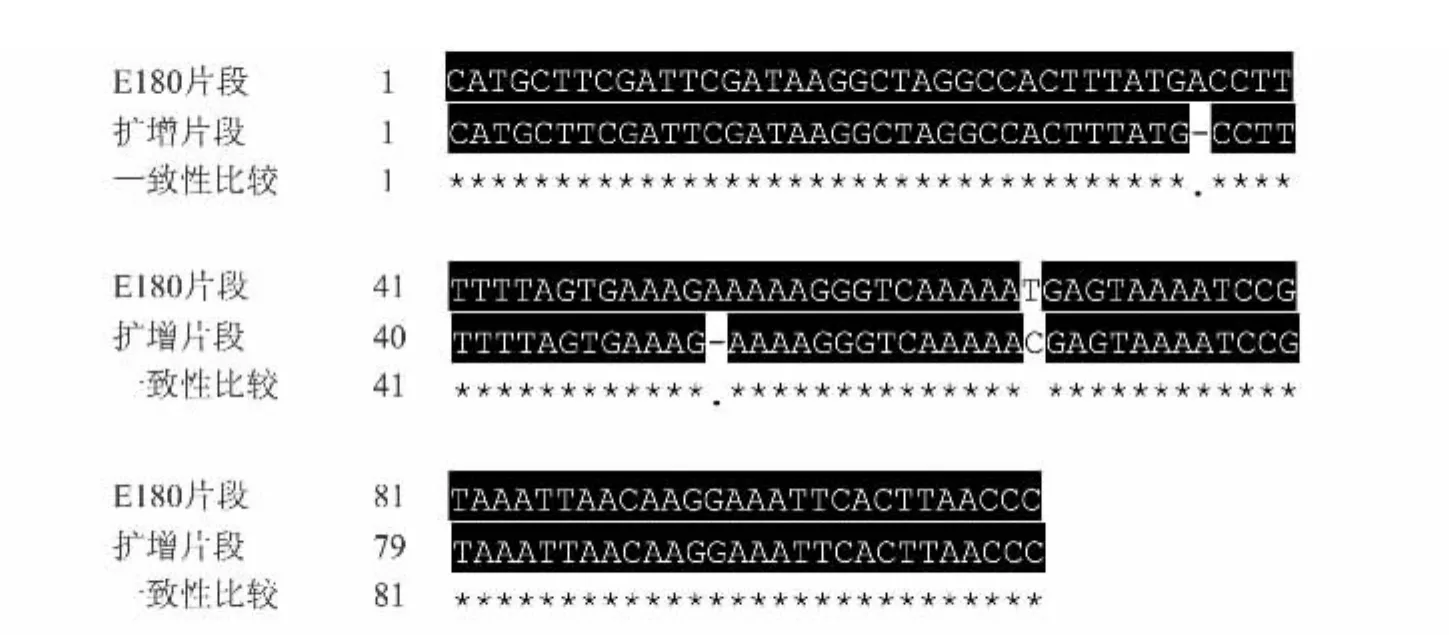
图2 E180片段原始序列和扩增片段测序结果Fig.2 Comparison of sequences between E180 original fragment and PCR amplified fragment
2.2 E180和45S rDNA的双色FISH定位
利用绿色E180探针和红色45S核糖体基因探针对2种紫花苜蓿染色体制片进行双色荧光原位杂交定位。荧光带型分析结果表明45S核糖体基因在2个材料中都表现为4条染色体上有杂交信号;E180杂交信号在金皇后和中苜1号体细胞的绝大多数染色体上的都有分布,主要集中分布于染色体近着丝粒区和近端部部位,且各染色体之间表现出了明显可见的多态性杂交信号(图3)。
2.3 染色体荧光分带分析
根据E180和45 S rDNA 2种杂交信号在染色体上的不同分布特征,对2种紫花苜蓿的32条染色体进行了同源染色体配对分析,并对2种物种染色体上的信号特征进行统计,尝试建立该物种的分子核型(图3,表1)。结果表明2种紫花苜蓿的绝大多数染色体的同源染色体(11~13对)都能得到清晰可靠的辨别。根据特征性杂交信号的分布,16对染色体主要可以区分为以下几种类型(因多条染色体的杂交信号在2种品种间呈多态性,此类型仅以中苜1号为标准划分):a型,无45S杂交信号,无E180杂交信号(1号染色体);b型,长臂具有45S杂交信号,长臂和短臂近着丝粒区具有E180杂交信号(2号染色体);c型,长臂具有45S杂交信号,着丝粒区具有E180杂交信号,短臂无杂交信号(3号染色体);d型,短臂中间区具有E180杂交信号,长臂无杂交信号(4、8、15和16号染色体);e型,短臂近端粒区和着丝粒区具有E180杂交信号,长臂无杂交信号(5号和11号染色体);f型,长臂近着丝粒区具有E180杂交信号,短臂无杂交信号(6号染色体);g型,短臂中间区和着丝粒区具有E180杂交信号,长臂无杂交信号(7号染色体);h型,短臂中间区和长臂近着丝粒区具有E180杂交信号(9号染色体);i型,短臂近端粒区和长臂近着丝粒区具有E180杂交信号(10号染色体);j型,长臂中间区具有着丝粒信号,短臂无杂交信号(12号染色体);k型,短臂近端粒区具有E180杂交信号,长臂无杂交信号(13号染色体);l型,短臂中间区和长臂中间区具有E180杂交信号(14号染色体)。在12种杂交信号的分布类型中,仅在d型和e型中发现了具有相似信号分布的染色体:4号、8号、15号和16号染色体具有相似的信号分布,5号和11号染色体具有相似的信号分布,其余信号分布类型中都只有唯一的染色体存在。
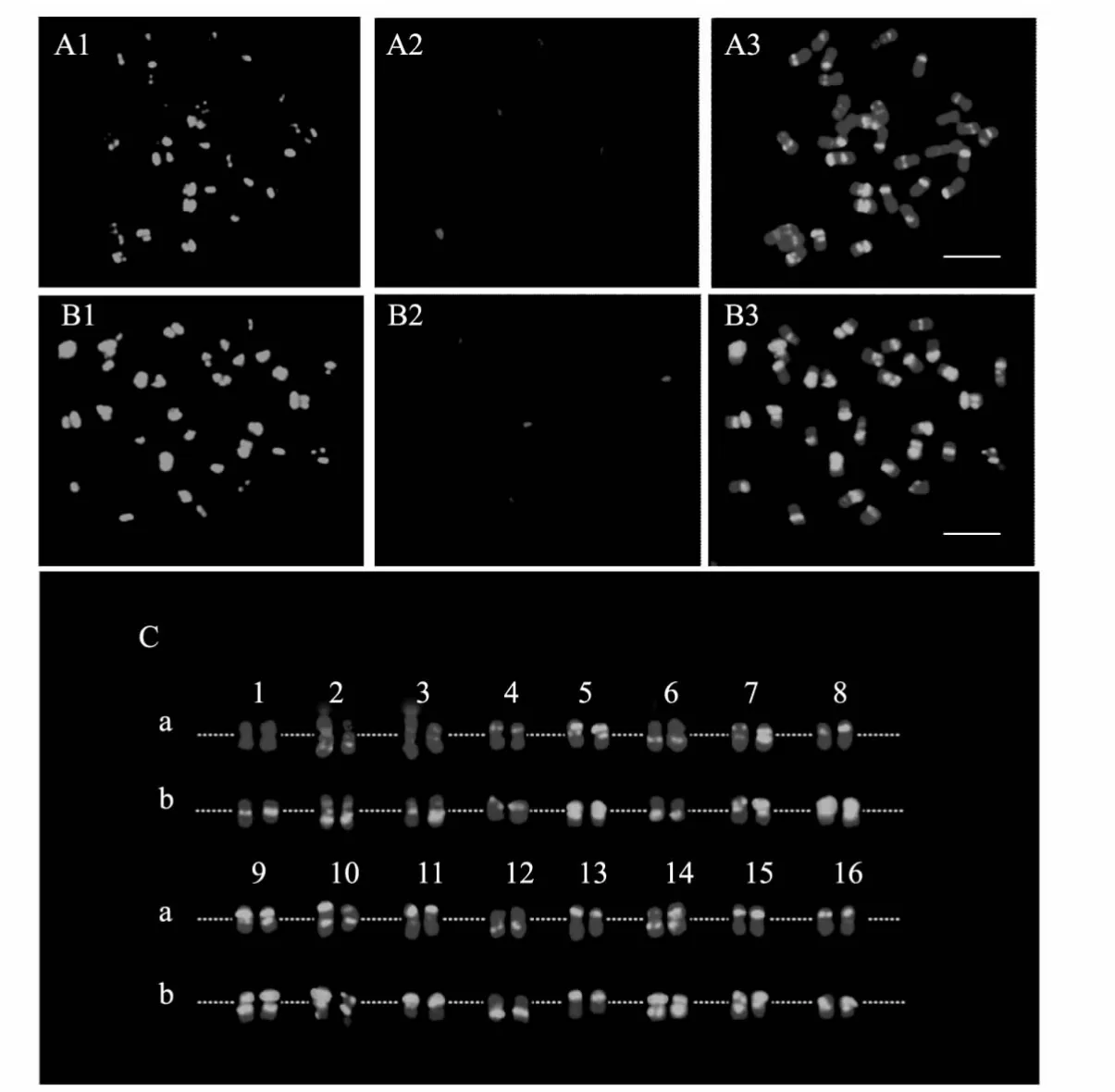
图3 两种紫花苜蓿的FISH结果和核型分析Fig.3 FISH patterns and molecular karyotypes of two M.sativa species
2.4 2个紫花苜蓿品种之间同源染色体的不同分布特征
比较2种探针在不同紫花苜蓿材料各同源染色体上的分布特征,结果如表1所示。2种紫花苜蓿的45 S杂交信号都被定位于2号和3号染色体的长臂端,而2种紫花苜蓿的E180杂交信号在12对染色体上呈现一致分布,在6对染色体上呈现出不同的杂交信号。1号染色体:在中苜1号中没有检测到任何杂交信号,在金皇后的着丝粒区检测到了E180杂交信号;4号染色体:在中苜1号的短臂中间区检测到E180杂交信号,在金皇后的短臂近端粒区检测到了E180杂交信号;5号染色体:在中苜1号短臂的近端粒区和着丝粒区检测到了E180杂交信号,在金皇后短臂的近端粒区和长臂的近着丝粒区检测到了E180杂交信号;8号染色体:在中苜1号短臂的中间区检测到了E180杂交信号,在金皇后短臂的中间区和长臂的近着丝粒区检测到了E180杂交信号;15号染色体:在中苜1号短臂的中间区检测到了E180杂交信号,在金皇后短臂的近端粒区和长臂的近着丝粒区检测到了E180杂交信号;16号染色体:在中苜1号短臂的中间区检测到了E180杂交信号,在金皇后短臂的中间区和长臂的近着丝粒区检测到了E180杂交信号。
3 讨论
真核生物的核糖体基因是一个串联的多基因家族,该基因被认为在植物进化过程中是相当保守的基因,在染色体组中通常以1对或几对染色体分布,物理位置比较保守[20]。窦全文等[21]利用45S核糖体基因探针对多种四倍体苜蓿染色体制片进行FISH定位,结果表明所有材料的4条染色体上均有45S核糖体基因杂交信号,本试验中所用的2个材料的信号分布与此相符。各种重复DNA序列的物理定位可以用原位杂交技术分析染色体或染色质的分子特性,以串联重复DNA序列为探针的原位杂交还可以用于分子细胞图谱的构建[22]。Xia等[18]于1993年报道E180是富含“AT”碱基的串联重复序列。本试验以E180为探针对苜蓿染色体进行荧光原位杂交的结果显示苜蓿的大部分染色体的近端部和近着丝粒区都属于“AT”丰富区,详细地将E180重复序列在苜蓿总基因组上的分布进行了定位,可以为苜蓿基因组学研究提供部分参考信息。
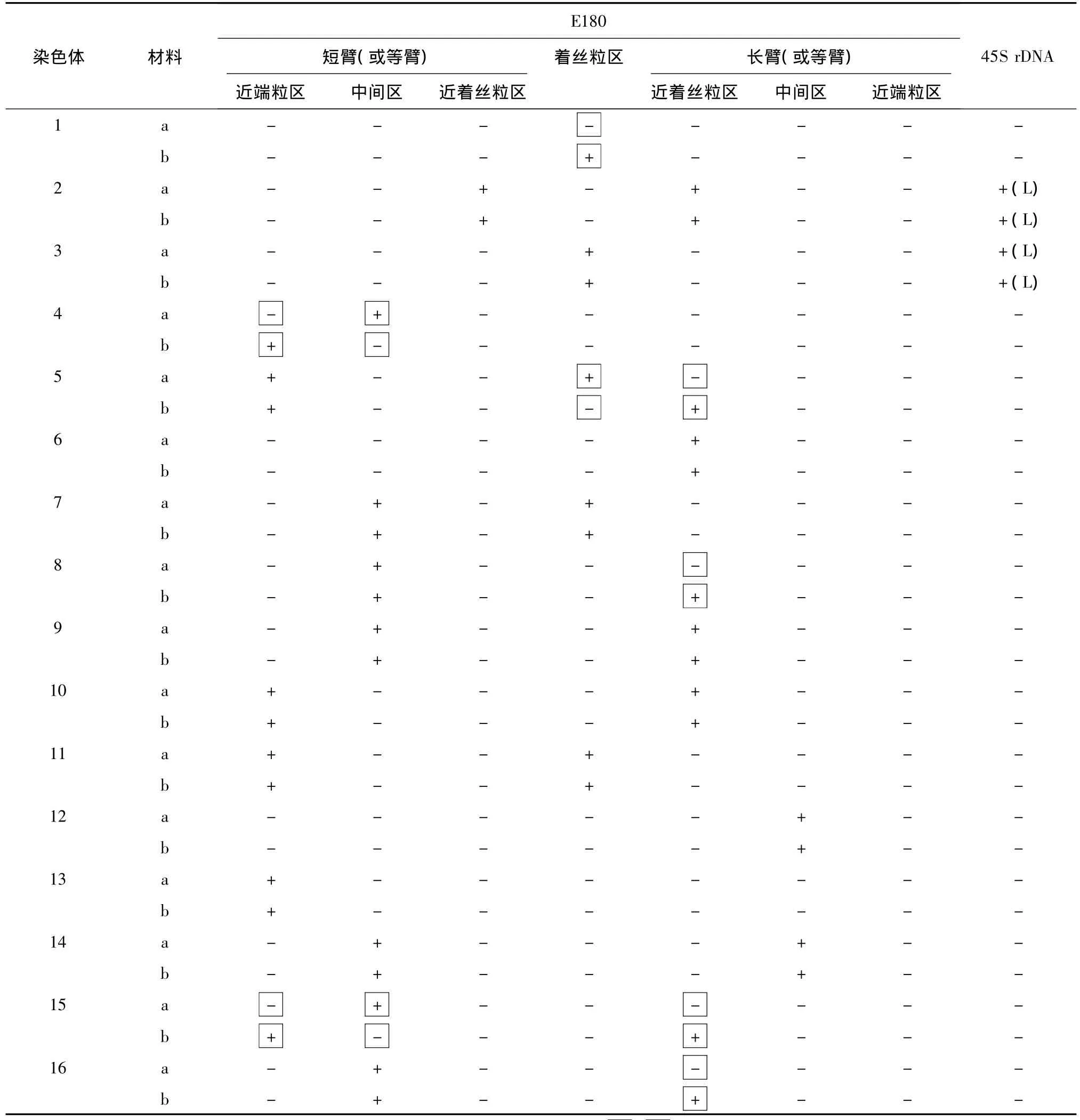
表1 2种紫花苜蓿染色体荧光分带特征分析Table 1 Fluorescence patterns in two Medicago sativa species
染色体核型分析是对生物体细胞核内全部染色体的形态特征进行分析,是遗传学研究的重要手段,也是物种分类和物种鉴定的基本依据[23]。Bauchan等[24]应用C-带分型和形态分析构建出了四倍体苜蓿的核型图,他们的研究结果显示苜蓿基因组中有4套相似的染色体组,每套染色体中有8个染色体。然而,由于C-带技术的复杂程度阻碍了该技术在不同实验室间的应用。本试验中所用的荧光原位杂交技术是染色体分析的一个强有力工具,它不仅可以对标记的染色体进行区分还可以直接提供染色体上的分子信息。在染色体荧光分带分析中,我们根据杂交信号的分布,将苜蓿的16对染色体区分为了12种类型,而不是8种类型,这与C-带中提出的苜蓿基因组中有4套相似的染色体组不相符,提示同源四倍体的苜蓿部分染色体已有分化的趋势。
中苜1号是由中国农业科学院畜牧研究所培育成功的耐盐苜蓿品种,而金皇后是从美国进口的紫花苜蓿品种,两者在来源上有很大的差别。本研究对2品种的FISH结果进行比较,发现中苜1号和金皇后的同源染色体组成间存在明显的染色体变异,这种变异可能是由于苜蓿的异交特性造成的,也可能是育种过程中人工选择的结果。了解不同品种染色体之间的多样性,会增加育种工作的目的性。本研究结果表明E180的FISH定位不仅可以进一步了解苜蓿染色体组的分子特性,还可以作为一个稳定可靠的染色体新标记被推广应用于苜蓿属植物的细胞学研究中,为苜蓿属植物的物种起源、系统分类与进化、基因组学研究等方面的研究提供稳定可靠的新依据。
[1]张鹤山,陈明新,王 凤,等.18个紫花苜蓿品种苗期抗旱性综合评价[J].江苏农业科学,2012,40(3)168-171.
[2]刘大林,邱伟伟,马晶晶,等.不同紫花苜蓿品种在长江中下游地区生产性能的比较[J].江苏农业科学,2011,39(6):332-334.
[3]王 鑫,马永祥,李 娟.紫花苜蓿营养成分及主要生物学特性[J].草业科学,2003,20(10):39-40.
[4]白静仁.我国苜蓿品种资源的发展及利用[J].中国草地,1990(4):57-60.
[5]张为民.四种紫花苜蓿的核型分析[J].山西农业大学学报,2006,26(1):73-76.
[6]韩微波,逢淑梅,张月学,等.51个苜蓿品种的核型分析研究初报[J].牧草与饲料,2006(1):32-34.
[7]张凤仙,毕玉芬,王晓云.云南野生苜蓿与引进苜蓿的核型分析[J].云南农业大学学报:自然科学版,2008,23(4):431-435.
[8]白 岚,张爱勤,方 晴,等.新疆两个苜蓿品种的核型分析[J]. 中国草地学报,2009,31(6):76-79.
[9]张雪婷,杨文雄,杨芳萍,等.6个紫花苜蓿材料的核型及其亲缘关系分析[J]. 西北植物学报,2011,31(4):671-676.
[10]BAUCHAN G R,HOSSAIN M A.Distribution and characterization of heterochromatic DNA in the tetraploid African population alfalfa genome[J].Crop Science,2001,41(6):1921-1926.
[11]陈建民,洪义欢,王幼平,等.苜蓿核糖体基因物理定位及染色体荧光分带[J]. 遗传,2006,28(2):184-188.
[12]窦全文,雷云霆,王海庆.黄花苜蓿和紫花苜蓿分子核型比较[J]. 草地学报,2012,20(4):718-723.
[13]FALISTOCCO E.Physical mapping of rRNA genes in Medicago sativa and M.glomerata by fluorescent in situ hybridization[J].Journal of Heredity,2000,91(3):256-260.
[14]王忠华,李旭晨,夏英武.荧光原位杂交技术在植物学中的应用[J].植物学通报,2001,18(1):40-45.
[15]杨国华,英 加.荧光原位杂交技术在植物细胞遗传学和绘制基因图谱中的应用现状与展望[J].西北植物学报,2002,22(4):421-429.
[16]佘朝文,宋运淳.植物荧光原位杂交技术的发展及其在植物基因组分析中的应用[J].武汉植物学研究,2006,24(4):365-376.
[17]荣红颖,张晓东,郭新梅.植物荧光原位杂交技术的发展及在基因工程育种中的应用[J].分子植物育种,2007,5(6):89-96.
[18]XIA X,ERICKSON L.An AT-rich satellite DNA sequence,E180,in alfalfa(Medicago sativa)[J].Genome,1993,36(3):427-432.
[19]NAGAKI K,TSUJIMOTO H,ISONO K,et al.Molecular characterization of a tandem repeat,Afa family,and its distribution among Triticeae[J].Genome,1995,38(3):479-486.
[20]徐川梅,别同德,王春梅,等.45S rDNA在小麦及其近缘物种染色体上的分布[J]. 遗传,2007,29(9):1126-1130.
[21]窦全文,雷云霆,王海庆.苜蓿种质间染色体多态性的荧光原位杂交检测[J].植物遗传资源学报,2012,13(5):782-788.
[22]张 明,曹家树.染色体原位杂交技术[J].植物生理学通讯,2000,36(6):544-549.
[23]闫素丽,安玉麟,孙瑞芬,等.染色体核型分析及染色体显微分离技术研究进展[J].生物技术通报,2008(4):70-74.
[24]BAUCHAN G R,HOSSAIN M A.Identification of Alfalfa chromosomes using Geimsa banding and image analysis techniques[M].Canada:Proceedings of the XVIII International Rangel and Congress,1997:61-62.

