巨噬细胞在混合嵌合体诱导异种免疫耐受中作用的实验研究
朱 勇 施舜缤 沈振亚
1.南通大学附属吴江医院胸外科,江苏吴江 215200;2.苏州大学附属第一医院心血管外科,江苏苏州 215000
目前,由于同种器官匮乏,器官移植的数量受到限制,异种移植是器官移植目前的重要研究方向之一。迟发性异种排斥反应(DXR)成为了异种器官移植的主要障碍[1-2]。研究表明T细胞在迟发性异种排斥反应(DXR)中起重要作用,特别是CD4+T细胞介导异种细胞排斥反应尤为重要[3-4]。诱导免疫耐受是抑制细胞免疫反应的最理想方法。而混合性嵌合是目前比较有前景的诱导异种免疫耐受的策略之一[5]。在同种移植和协调性异种移植领域,利用混合嵌合体可诱导出供者特异性的免疫耐受[6]。但在非协调性异种移植供受体间,利用相同的方法却不能获得免疫耐受,其中原因之一就是供者骨髓细胞在受体体内迅速消失而不能形成持续稳定的嵌合体。有研究发现在比较猪-SCID/NOD小鼠(巨噬细胞功能缺陷)及猪-SCID小鼠嵌合体模型发现,前者的嵌合状态维持明显长于后者[7]。本研究在豚鼠到大鼠实验动物模型中,利用脂质体包裹clodronate清除受体巨噬细胞后,采用非清髓性的预处理方案诱导建立混合嵌合体,研究巨噬细胞在建立非协调性异种混合嵌合体中的作用。
1 材料与方法
1.1 实验动物及分组
供体选用健康三色豚鼠,雌雄不限,受体选用健康SD雌性大鼠,体重250~300g,实验动物均由苏州大学实验动物中心提供,实验动物许可证号:SYXK(苏)2002-0037。取7d前开始饮红霉素(250mg/L)和庆大霉素(320mg/L)水清洁级雌性SD大鼠,(D-0)接受60Coγ射线(剂量率0.5Gy/min,总剂量5.0Gy)全身照射,照射后4h内经后肢隐静脉输注2×108/mL豚鼠BMC的细胞悬液0.8mL(24h实验组大鼠输注经CFSE标记的豚鼠BMC细胞悬液),2d(D-2)后经环磷酰胺预处理(腹腔内注射CTX,50mg/kg),实验动物随机分为3组,每组10例(各组5例预处理后24h处死):A组(豚鼠BMC移植组):仅行豚鼠BMC移植;B组(豚鼠BMC移植组+空脂质体移植组):BMC移植前3d经后肢隐静脉输注不含clodronate空脂质体(每天2次,每次1mL),余同A组;C组(豚鼠BMC移植组+包裹clodronate脂质体移植组):BMC移植前3d经后肢隐静脉输注含clodronate脂质体共120mg/kg(每天2次),余同A组。
1.2 豚鼠骨髓细胞制备
将豚鼠颈椎脱臼处死后,置于75%酒精中浸泡15min,无菌条件下取股、胫骨,用RPMI 1640冲洗骨髓腔,反复吹打,分散细胞,200目钢筛过滤制成单细胞悬液,加红细胞裂解液裂解红细胞后PBS液洗2次,以RPMI 1640调整细胞浓度为2×108个/mL备用,台盼兰染色法判定细胞活率>90%。
1.3 脂质体包裹Clodronate制备
脂质体的制备采用反相蒸发技术,即70.9mg磷酸卵磷脂、10.8mg胆固醇溶于10mL氯仿溶液中,同时加入1.8mg/mL p-aminophenyla-D-mannopyranoside甲醇溶液2mL,形成脂质,加入10mL clodronate(10mg/mL)PBS溶液,于56℃超声水浴10min,从而形成水包油乳剂,进而于56℃旋转蒸发,形成完整脂质体。空白脂质体即在形成脂质体后加入10mL PBS溶液,余同脂质体制作。制备好脂质体及空白脂质体置4℃冰箱备用。
1.4 CFSE标记豚鼠骨髓细胞及体内追踪检查
活体染料羧基荧光素乙酰乙酸(carboxy fluoresceindiacetate,succinimidyl ester,CFSE) 用 DMSO 溶解成 10mmol/L 的储存液,-20℃保存。临用前,取适量用PBS 稀释成5μmol/L 的工作液,平衡至室温备用。取制备好的豚鼠骨髓细胞, 加入等体积的 CFSE 工作液(终浓度为 2.5μmol/ L) , 充分混匀后在室温条件下轻轻振荡10min。然后用PBS 离心(300g,5min)洗涤细胞2 次,悬浮于含100mL/L FBS 的RPMI1640完全培养液中,并调整细胞密度为2×108/L。注入CFSE标记的豚鼠骨髓细胞后1、6、12、24h分别取大鼠外周血50~100μL,裂解红细胞后流式细胞仪检测CFSE标记细胞百分比。同是于24h处死受体大鼠取脾、骨髓细胞,制得单个核细胞后行流式细胞检查CFSE标记细胞百分比。
1.5 大鼠肝、脾CD68免疫组化检查
CD68是巨噬细胞特异性标志物,本实验用免疫组化方法检查。免疫组化染色采用SP法(Streptavidin-biotin immunoperoxidase method),操作步骤按说明书染色步骤进行。
1.6 嵌合体嵌合率的测定
A、B、C组动物接受60Coγ射线全身照射后行豚鼠BMC移植,经环磷酰胺预处理,在21d、35d取外周血检测嵌合率。取A、B、C组大鼠的外周血离心分离得到单个核细胞,用PBS调整细胞浓度至1×106/100μL;取上述细胞悬液100μL,加入小鼠抗豚鼠MHC Class Ⅱ抗体,混匀,避光、室温、孵育15min;加入3mL PBS缓冲液,混匀,1500rpm离心5min,弃除上清,管底留少许液体(≤100μL);加入1Test PE标记的大鼠抗小鼠IgA二抗,混匀,避光、室温、孵育15min;加入3mL PBS缓冲液,混匀,1500rpm离心5min,弃上清,加入0.5~1mL PBS重悬,6h内上流式细胞仪检测,通过细胞阳性率来检测受体大鼠的外周血中豚鼠细胞比例。
1.7 外周血中CD3+T细胞、CD4+T细胞和CD8+T细胞检测
正常大鼠及实验组BMC移植后21d流式细胞仪检测外周血中CD3+T细胞、CD4+T细胞和CD8+T细胞的水平。取受体大鼠外周血100μL,加入带标记的CD3、CD4、CD8抗体,混匀,避光、室温、孵育15~20min后加入A液、B液和C液进行红细胞裂解;加入5倍以上体积PBS缓冲液,混匀,1500rpm离心5min,弃除上清,管底留少许液体(≤100μL);加入0.5~1mL PBS重悬,流式细胞仪检测。
1.8 单向混合淋巴细胞反应(mixed lymphocyte reaction)
分别将供体(豚鼠)和受体(大鼠)脾脏制成细胞浓度为1.0×107/mL的淋巴细胞悬液。以各实验组SD大鼠的淋巴细胞作为MLR的反应细胞,豚鼠淋巴细胞的作为MLR刺激细胞,刺激细胞经丝裂霉素处理;取96孔细胞培养板,设置零孔(加入RPMI 1640培养基150μL,不含细胞)、对照孔O组(加入正常大鼠脾细胞悬液100μL、培养基50μL)和待检孔A、B、C组(每孔加入培养基50μL、供受体淋巴细胞悬液各50μL),每份标本设三复孔。将培养板置于湿度100%、37℃、5%CO2培养箱内培养96h后,加入CCK-8 10μL /孔;培养箱内培养4h后在酶标仪上测定OD值(选择检测波长450nm)。MLR的刺激效应按照下列公式计算:刺激效应=(实验组OD值-对照组OD值)/ 对照组OD值×100%。
1.9 统计学方法
所有数据的统计均使用SPSS17.0软件包进行统计。统计方法使用student’s t检验和方差分析,数据以(± s)表示,检验水准:α=0.05。
2 结果
2.1 巨噬细胞特异性标志物CD68免疫组化检查
预处理后第1天,C组肝脏、脾脏红髓及红白髓移行处巨噬细胞消失,白髓处有仍有少量CD68阳性巨噬细胞,到预处理后第21天时,肝脾中巨噬细胞已恢复与正常对照大鼠相似。而A、B两组与正常对照大鼠相比无变化(图1、2)。说明脂质体包裹clodronate能清除大鼠体内巨噬细胞。
2.2 豚鼠骨髓细胞输注24h内受体外周血中豚鼠细胞比例测定
A、B、C组动物接受60Coγ射线全身照射后行经CFSE标记豚鼠BMC移植,移植后1、6、12、24h分别检测大鼠外周血中CFSE标记细胞比例,即豚鼠BMC细胞比例。在各时间点中,C组大鼠外周血中CFSE标记细胞比例均明显高于A组及B组,而A组及B组之间无显著差异(表1),说明受体去除巨噬细胞后可提高其外周血中豚鼠BMC比例,即大鼠巨噬细胞在豚鼠BMC在其外周血中迅速消失起作用。

图1 正常大鼠肝脏高表达CD68(光镜×400)

图2 正常大鼠脾脏高表达CD68(光镜×400)

图3 C组大鼠预处理后24h肝脏无CD68表达(光镜×400)

图4 C组大鼠预处理后24h脾脏CD68低表达(白髓少量表达)(光镜×400 )
表1 移植24h内各时间点大鼠外周血中豚鼠细胞变化(± s ,%)
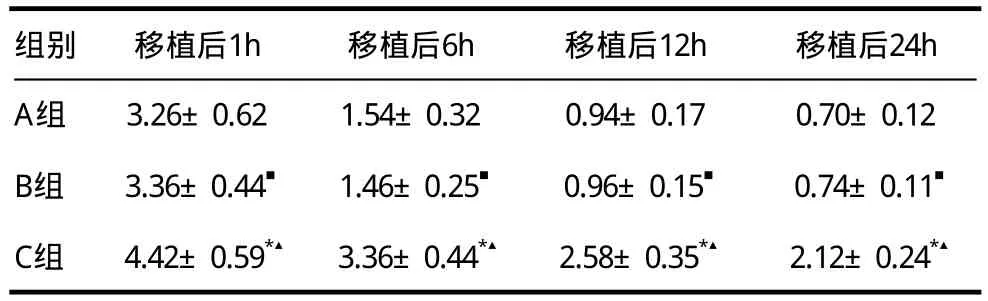
表1 移植24h内各时间点大鼠外周血中豚鼠细胞变化(± s ,%)
注:移植后1h:与A组相比,*P=0.006;与B组相比,▲P=0.011;与A组相比,■P=0.781;移植后6h:与A组相比,*P<0.001;与B组相比,▲P<0.001;与A组相比,■P=0.721;移植后12h:与A组相比,*P<0.001;与B组相比,▲P<0.001;与A组相比,■P=0.897;移植后24h:与A组相比,*P<0.001;与B组相比,▲P<0.001;与A组相比,■P=0.714
组别 移植后1h 移植后6h 移植后12h 移植后24h A组 3.26±0.62 1.54±0.32 0.94±0.17 0.70±0.12 B组 3.36±0.44■ 1.46±0.25■ 0.96±0.15■ 0.74±0.11■C组 4.42±0.59*▲ 3.36±0.44*▲ 2.58±0.35*▲ 2.12±0.24*▲
2.3 豚鼠骨髓细胞输注21d及35d嵌合率检测
3组在21d后取外周血均检测到一定比例的嵌合体细胞,到预处理后35d观测发现嵌合率均明显降低。流式细胞仪检测C组嵌合率明显高于A、B两组(P<0.05),A组与B组之间嵌合率无显著差异(表2),说明去除巨噬细胞明显提高嵌合率。
表2 受体大鼠的外周血中豚鼠源性细胞检测结果(嵌合率)(± s ,%)

表2 受体大鼠的外周血中豚鼠源性细胞检测结果(嵌合率)(± s ,%)
注:21d与A组相比,*P<0.001;与B组相比,▲P<0.001;与A组相比,■P=0.842;35d与A组相比,*P=0.002;与B组相比,▲P=0.001;与A组相比,■P=0.864
组别 预处理后21d 预处理后35d A组 3.12±0.29 0.58±0.18 B组 3.06±0.27■ 0.56±0.15■C组 5.12±0.70*▲ 1.04±0.21*▲
2.4 外周血中CD3+T细胞、CD4+T细胞何CD8+T细胞测定
从表3中可以看出经辐照后T细胞亚群中CD3+T细胞比例下降,约为正常大鼠的20%;CD3+CD4+T细胞和CD3+CD8+T细胞亦下降,而CD3+CD4+T细胞下降幅度更大,但两者比值对照组和各实验组之间无差异,与正常SD大鼠有显著差异。
表3 各组淋巴细胞亚群(± s ,%)

表3 各组淋巴细胞亚群(± s ,%)
注:(1)CD3+T细胞:与同期正常大鼠照射组相比,*P<0.01;对照组、A组、B组及C组组间两两相比,▲P>0.05;(2)对照组即在大鼠全身照射后输注生理盐水,余同A组
组别 CD3+T细胞 CD3+CD4+T细胞 CD3+CD8+T细胞 CD4+/CD8+正常SD大鼠 52.28±5.61 42.46±7.42 10.88±1.72 4.08±1.40对照组 14.20±0.83*▲ 9.47±0.63*▲ 4.73±0.29*▲ 2.01±0.12*▲A组 16.34±0.75*▲ 11.08±0.51*▲ 5.26±0.33*▲ 2.11±0.11*▲B组 16.42±0.48*▲ 10.93±0.26*▲ 5.49±0.31*▲ 1.99±0.10*▲C组 17.18±0.79*▲ 11.52±0.97*▲ 5.66±0.51*▲ 2.05±0.30*▲

表4 各组刺激效应值(100%)
2.5 单向混合淋巴细胞反应
经豚鼠骨髓细胞移植3组(A、B、C组)较未行骨髓细胞移植的两组(D、E组)的受体淋巴细胞增殖显著减弱。其中,C组刺激效应小于A、B两组,A、B两组之间刺激效应无显著差异,D、E两组之间刺激效应也无显著差异。
3 讨论
Clodronate 是一种人工合成的双磷酸酯,脂质体包裹clodronate可被巨噬细胞吞噬、消化,进而clodronate释放、聚集于细胞内,当细胞内clodronate达到一定浓度后,可导致巨噬细胞凋亡[8-9]。本研究中,输注脂质体包裹clodronate早期,SD大鼠肝脏、脾脏红髓及红白髓移行处巨噬细胞消失,说明脂质体包裹clodronate能清除大鼠体内巨噬细胞。而白髓内有仍有少量CD68阳性巨噬细胞,这与Van Rooijen等实验结果相似,同时他们发现输注脂质体包裹clodronate也不能清除胸腺、骨髓及淋巴结内的巨噬细胞,并且在胸腺内树突状细胞数无变化。考虑原因可能是脂质体大小与通入脾白髓、胸腺等组织的微循环血管内皮组织间隙相似,从而使脂质体不能进入这些组织内[8,10]。停止输注脂质体包裹clodronate后,大鼠体内的巨噬细胞会逐渐恢复。由此可见,利用脂质体包裹clodronate的方法清除巨噬细胞的动物模型是可行的。而其对胸腺内巨噬细胞及树突状细胞不予清除,对本实验用此模型研究以中枢性克隆清除为主要作用机制的异种嵌合体尤为重要。
在非协调性异种移植供受体间,利用相同的方法却不能获得免疫耐受,其中原因之一就是供者骨髓细胞在受体体内迅速消失而不能形成持续稳定的嵌合体。有学者认为在非协调性异种移植中,由于供者来源的骨髓细胞缺乏供者MHC-I类分子,不能被供者NK细胞抑制性受体(KIR)识别,因而激活供者NK细胞而被杀伤清除,因此NK细胞在供体骨髓细胞迅速消失中起主要作用。然而Sykes M等[11]利用猪—SCID小鼠的模型研究表明,NK细胞对猪造血细胞在SCID小鼠体内迅速消失并不起主要作用。
我们的实验中,利用非清髓的方法建立豚鼠到大鼠的非协调性异种混合嵌合体模型。我们发现在豚鼠骨髓细胞移植后,豚鼠骨髓细胞在受体大鼠外周血内迅速减少。而在移植前利用脂质体包裹clodronate的方法清除受体大鼠巨噬细胞组,无论是移植后24h内受体外周血、骨髓及脾脏中豚鼠源性细胞比例,还是预处理后21d及35d测外周血嵌合率,都明显高于对照两组。这些都说明大鼠的巨噬细胞在豚鼠BMC移植后迅速减少中起重要作用,在BMC移植前去除巨噬细胞可提高嵌合率。
由于豚鼠BMC细胞移植前去除巨噬细胞,豚鼠细胞早期在外周血中被巨噬细胞清除减少,因此24h内测的豚鼠细胞比例均较其他两组增高。随着外周血中豚鼠细胞增多,植入大鼠骨髓中的豚鼠BMC细胞相应增多,使豚鼠源性各造血系细胞生成增多,它们在胸腺内植入后产生介导克隆丢失的树突状细胞和胸腺细胞,最终使来之豚鼠并迁移到外周的成熟胸腺细胞增多。因此,在我们的实验中,预处理后21d和35d发现去除巨噬细胞组测嵌合率明显高于细胞移植前未去除巨噬细胞组。而此时从免疫组化结果来看,清除巨噬细胞组的大鼠体内巨噬细胞已恢复到正常水平。因此在豚鼠BMC移植后早期(大鼠巨噬细胞恢复正常水平前)种植入大鼠骨髓中增多对提高嵌合水平有重要的作用。造血干细胞移植建立嵌合体常需要超大剂量干细胞,限制了其在临床的运用,而我们的实验似乎可以提供一些新的思路。
T细胞亚群的检测对于判断机体免疫耐受情况有重要意义[12],在本实验中,我们选用了CD3+、CD4+、CD8+T细胞亚群的检测。CD4+T细胞参与T细胞依赖性异种抗体的合成,可介导补体依赖的细胞毒和ADCC作用,CD8+T细胞作为非依赖性的细胞毒性T细胞,在DXR中可直接杀伤移植物。如CD4+和CD8+T细胞均升高、且CD4/ CD8比值上升,这预示着排斥反应即将发生。在我们的实验中,预处理21d后对照组及各BMC输注组CD3+、CD4+、CD8+T细胞较正常大鼠均降低,而在CD4+、CD8+T细胞中,CD4+T细胞降幅更大,故CD4/CD8比值下降。但在BMC组与对照组的相比中,CD4/ CD8比值下降的幅度无显著差异。因此我们认为,混合嵌合体对T细胞亚群的生成与分布并无影响,CD4/ CD8比值下降可能与CD4+T细胞比CD8+T细胞对γ射线照射更为敏感有关。
MLR是评价T细胞免疫应答功能的经典体外实验方法,可间接反映体内T细胞对某一组织相容性抗原的免疫应答功能,对客观地判断T细胞免疫应答功能、免疫耐受的诱导及移植物的排斥均有重要的参考价值[13-14]。本实验通过对单向混合淋巴细胞培养结果的观察,发现BMC移植三组刺激效应都低于对照两组,提示异种间建立混合嵌合体虽然对T细胞亚群的分布无影响,但其识别异种抗原的能力有所下降。而BMC移植前去除巨噬细胞组21d嵌合率较其他两组高,刺激效应较其他两组BMC移植组低,且有显著差异,说明提高嵌合水平可获得更高程度的免疫抑制。
综上所述,通过在BMC移植前清除受体巨噬细胞,增加了供体BMC在受体体内的存活,从而提高嵌合水平,获得了更高水平的免疫抑制,这为研究混合嵌合体在非协调性异种器官移植中免疫耐受机制提供必要的理论依据。
[1]Shen Z,Ye W,Ten X.Suppression of NF-kappaB p65 expression attenuates delayed xenograft rejection[J]. Xenotransplantation,2013,20(2):123-130.
[2]张恒,杨洪吉.延迟性异种移植排斥反应机制及其对策研究进展[J].实用医院临床杂志,2011,8(6):63-66.
[3]Sachs DH,Sykes M,Yamada K.Achieving tolerance in pig-to-primate xenotransplantation:reality or fantasy[J].Transplant Immunology,2009,21(2):101-105.
[4]李俊杰,李霄,窦科峰.异种移植免疫排斥的研究进展[J].国际外科学杂志,2011,38(10):710-714.
[5]王东梅,宋长兴,张志欣.克服异种移植免疫排斥的研究进展[J].中国修复重建外科杂志,2009,23(1): 106-110.
[6]郁华亮,肖序仁.移植免疫耐受的研究现状及进展[J].中国组织工程研究与临床康复,2009,13(31):6109-6112.
[7]Chen AM,Zhou Y,Swenson K,et al.Porcine stem cell engraftment and seeding of murine thymus with class Ⅱ+ cells in mice expressing porcine cytokines:toward tolerance induction across discordant xenogeneic barriers[J]. Transplantation,2000,69(12):2484-2490.
[8]Van Rooijen N,Sanders A.Liposome mediated depletion of macrophage:mechanism of action, preparation of liposomes and applications[J]. J Immunol Meth,1994,174(1-2):83-93.
[9]张建新,党胜春,崔磊,等.氯磷酸二钠脂质体对胰腺炎大鼠肺泡巨噬细胞凋亡的影响[J].中华肝胆外科杂志, 2010,16(3):212-215.
[10]Buiting AM,Zhu F,Bakker JA,et al.Biodistribution of clodronate and liposomes used in the liposome mediated macrophage“suicide”approach[J].Journal of Immunological Methods,1996,192(1-2):55-62.
[11]Sykes M,Ohdan H,Manilay JO,et al.Hematopoietic chimerism and tolerance of T cells,B cells, and NK cells[J]. Transplantation Proceedings,1998,30(8):4020.
[12]朱小慧.免疫耐受机制的研究进展[J].细胞与分子免疫学杂志,2011,27(5):593-595.
[13]杜成友,姚榛祥,黄平,等 .受体外周血 IgG、MФ、NK 、CD4、CD8及MIR的变化与异种移植物存活的关系[J].中国免疫学杂志,2001,17(2):89-92.
[14]Kitazawa Y,Li XK,Xie L,et al.Bone marrow-derived conventional,but not cloned,mesenchymal stem cells suppress lymphocyte proliferation and prevent graft-versus-host disease in rats[J].Cell Transplantation,2012,21(2-3):2-3.

