微小巴贝虫在不同免疫状态小鼠体内消长规律研究
蔡玉春,卢 艳,陈韶红,郭 俭,陈木新,田利光,张玲玲,周 洋,陈家旭
2010年河南、安徽等地发生因蜱虫叮咬引发人相关疾病流行的报道引人关注。蜱可传播多种疾病,已经确认经蜱叮咬感染人的巴贝虫只有4种,即:微小巴贝虫(Babesiamicroti)也称田鼠巴贝虫;牛巴贝虫(B.bovis),歧异巴贝虫(B.divegen);和马巴贝虫(B.equi),至少还有3种未定种的巴贝虫也可以感染人体。其中以微小巴贝虫感染为多见[1-8]。本文以引进的微小巴贝虫建立动物模型,观察其在不同免疫状态动物体内的动态规律,为巴贝虫病致病机制、诊治技术及防控措施等研究奠定研究基础。
1 材料与方法
1.1 实验材料
1.1.1 虫株 微小巴贝虫(Babesiamicroti),peabody mjr株购自美国模式培养物集存库(American type culture collection,ATCC),货号:PRA-99
1.1.2 实验动物 BALB/c小鼠、严重联合免疫缺陷小鼠(severe combined immune deficiency,SCID)、非肥胖糖尿病/重症联合免疫缺陷小鼠(nonobese diabetic/severe combined immunodeficient,NOD/SCID)均购自中科院上海实验动物中心。
1.2 仪器和试剂 显微镜(日本奥林巴斯公司),EDTA抗凝采血管(浙江拱东医疗科技有限公司),0.9%生理盐水(上海长富制药公司),地塞米松(山东新华制药公司),吉姆萨染液原液(上海怡成生物科技公司),甲醇(上海振兴化工一厂)。
1.3 试验方法
1.3.1 BALB/c小鼠免疫抑制 3周龄雌性BALB/C小鼠腹腔注射地塞米松,0.5 mg/只,连续注射5 d。
1.3.2 动物接种 感染种鼠(红细胞染虫率,即虫密度为60%)眶窦取血,置EDTA抗凝采血管中,在无菌条件下以1∶3比例加0.9%生理盐水,使虫密度约为20%,腹腔接种正常BALB/c小鼠、免疫抑制BALB/c小鼠、SCID小鼠以及NOD-SCID小鼠,100μL/只,每组5只,4只接种鼠,1只为正常鼠。
1.3.3 薄血片吉姆萨染色 从接种当天及接种后每天尾部采血涂制薄血片,吉姆萨染色镜检观察红细胞染虫率。
1.3.4 红细胞染虫率计算 油镜下观察染色血片,统计视野中每500个红细胞的染虫红细胞数量,计算染虫红细胞占此500个红细胞的百分率即为当天的巴贝虫染虫率。
2 结 果
2.1 不同小鼠体内B.microti动态变化情况BALB/c小鼠组感染后第3 d在红细胞内查见虫体,之后红细胞染虫率升高,第4 d起红细胞染虫率即达20%,第7 d达到高峰(染虫率82.4%),随后虫密度开始降低,染虫率在20%以上约持续7天,至第20 d,染虫率降为2.45%,随后一直保持在0%-2%的较低水平状态。免疫抑制BALB/c小鼠感染后第2 d查见虫体,第3 d染虫率达到20%以上,第5 d染虫率最高,后缓慢降低,第12 d又出现染虫率高峰为50.88%,至第16 d仍维持在20%以上,染虫率在20%以上约持续14 d,第24 d后下降至2%以下,以后维持在0%~2%的较低水平。NODSCID小鼠感染后第3 d在红细胞内查见虫体,第4 d虫密度升高,第5 d时达20%,第7 d达高峰(染虫率72.5%),随后逐渐下降,第12 d降至低谷(染虫率20.8%),随后虫密度再次升高,分别于第16 d、第24 d出现2次染虫率升高又下降的过程,至观察结束,平均染虫率为41.9%。SCID小鼠于感染后第3 d红细胞内查见虫体,第5 d开始上升,第8 d达高峰(染虫率86.4%),随后虫密度逐渐下降,第12 d降至低谷,随后虫密度再次升高,至第18 d出现第二次染虫率最高为62.2%,之后缓慢降低,至观察的第30 d,染虫率仍为31.4%,平均染虫率为38.2%(图1,表1)。
2.2 血涂片中巴贝虫形态 在4种不同小鼠体内,微小巴贝虫虫体寄生在红细胞内,多数为两虫寄生,有的多达6虫寄生。虫体很小,核呈紫色,浆呈兰色,形态多种多样,从点状体、小的环状形到大的阿米巴样形不一,可呈泪滴状、戒子状、圆形、梨形、棒状或歧异形。但以环状体为主,还可见 四联型”或“马耳他十字型”。图2中为在BALB/c小鼠薄血片中发现的比较典型的巴贝虫形态:有小点状体,马耳他十字,小环状体,环状体,长丝状体,以及感染高峰时段游离在红细胞外大量虫体。
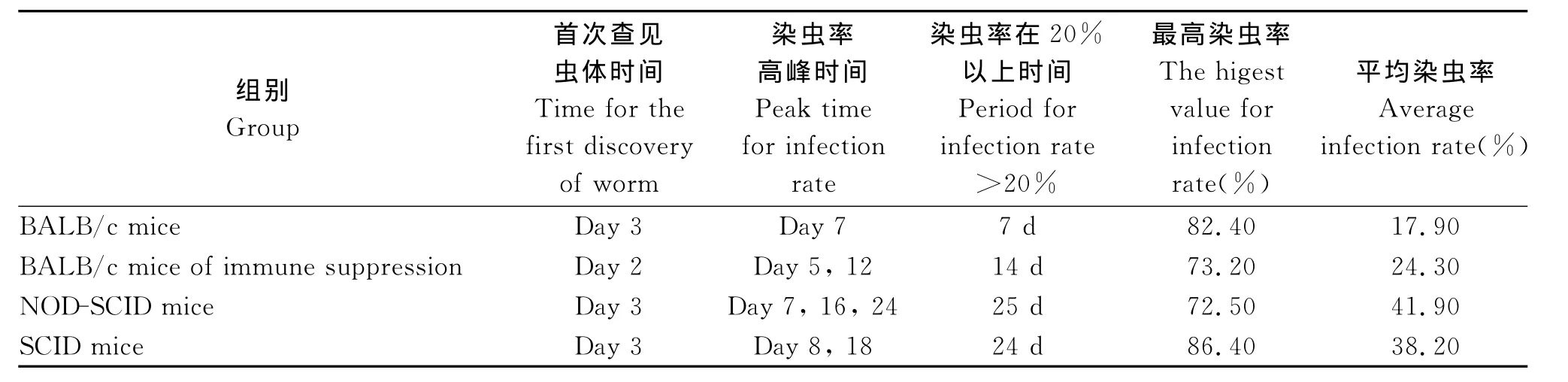
表1 不同小鼠体内B.microti动态变化Tab.1 Infection dynamics of Babesia microti in different groups

图1 不同组小鼠染虫率和时间的关系曲线图A:BALB/c小鼠组;B:免疫抑制 BALB/c小鼠组;C:NOD-SCID小鼠组;D:SCID小鼠组.Fig.1 Infection dynamics curve of Babesia microti in different groupsA:BALB/c mice;B:BALB/c mice of immune suppression;C:NOD-SCID mice;D:SCID mice
2.3 巴贝虫在不同组小鼠体内形态变化情况 选取感染巴贝虫的BALB/c小鼠、免疫抑制BALB/c小鼠、NOD-SCID小鼠、SCID小鼠第3 d、第7 d、第11 d、第15 d、第19 d和第23 d的血涂片来观察巴贝虫在不同小鼠体内变化情况。巴贝虫在BALB/c小鼠和免疫抑制BALB/c小鼠变化情况较为一致,在第四天出现少量环状体,第7d红细胞内出现大量虫体,红细胞裂解,虫体形态各异,小环状体,大环状体,长丝状体等,有些为两虫、三虫寄生,第11 d、第15 d仍有较多红细胞被虫体寄生,多为点状体和小环状体,至第19 d、第23 d染虫红细胞明显大量减少,每视野中仅见2~4个环状体。NOD-SCID小鼠组,第4 d也出现少量虫体,多为单虫寄生,环状体,第7 d、第11 d大量红细胞被虫体感染,且出现溶血现象,多为幼织红细胞感染,多环状体,少量虫体游离在外;第15 d已有大量虫体游离在外,红细胞大量裂解,染虫红细胞多为2~4虫感染,多大环状体和长丝状体;第19 d仍溶血严重,视野中仅可见少量红细胞,多为新补充的幼织红细胞,虫体多为长丝状体;第23 d红细胞有所恢复,但仍旧可见较多点状体、环状体和长丝状体等虫体。SCID小鼠组同NOD-SCID小鼠组较为一致,每视野中染虫红细胞都较多,有溶血现象,至第23 d染虫红细胞数量无明显下降(图3)。
3 讨 论
巴贝虫是一类机会性致病寄生虫,一些巴贝虫也是人兽共患寄生虫,如微小巴贝虫、歧异巴贝虫等,即可感染动物,也可机会性感染人。近年来,巴贝虫在人体感染的病例时有报道,且呈世界性分布。不同人对巴贝虫感染症状反应不一。症状轻者体温正常,略有不适;重者骤然发病,高热,恶寒战栗,头痛剧烈,恶心呕吐;危重患者甚至迅速发展为溶血性贫血,伴发黄疸、蛋白尿、血尿及肾功能障碍等,脾脏切除患者、老年以及细胞免疫功能低下患者,感染症状较正常人严重[9]。脊椎动物和蜱是巴贝虫的两个宿主,当感染性蜱叮咬宿主吸血时,子孢子随唾液进入宿主体内,侵入红细胞进行裂体增殖;部分裂殖子形成雄、雌配子体,配子体在蜱叮咬宿主时进入蜱体内,进行配子生殖和包子增殖,在蜱唾液腺发育成孢子体,并通过蜱叮咬宿主时感染哺乳动物宿主,进入下一个循环[10]。随着户外活动的增加,人们暴露于蜱虫叮咬的机会也增加,特别对于脾脏切除等免疫功能低下的患者,更易感染;另外,无症状的带虫者也可通过输血传播[11]。
本研究观察了微小巴贝虫感染不同免疫状态BALB/c小鼠、SCID小鼠和 NOD-SCID小鼠后,红细胞内的动态变化情况。由动态曲线图可以看到,微小巴贝虫感染正常BALB/c小鼠和免疫抑制的BALB/c小鼠,在免疫抑制的BALB/c小鼠体内,感染后2 d就出现较多虫体,出现两次感染高峰,且感染时间较正常BALB/c小鼠长。在感染高峰时段,出现较多多虫感染现象,但在观察的30 d中,最终感染率会降至较低水平,第25 d后下降至2%以下,以后维持在0%~2%的较低水平。而SCID小鼠组和NOD-SCID小鼠组与这两组BALB/c小鼠有很大不同,微小巴贝虫在其体内有感染率的上下波动,但一直处于较高水平,平均感染率NOD-SCID小鼠为41.9%,SCID小鼠组为38.2%。这一现象给我们很大的启示,由于SCID小鼠是严重联合免疫缺陷小鼠,而NOD/SCID小鼠是SCID小鼠与非肥胖性糖尿病小鼠(NOD/Lt)品系回交的免疫缺陷鼠,不仅拥有C.B-17 SCID鼠的特征,缺乏适应性免疫系统,不再发生自身免疫性糖尿病,同时还表现出NOD小鼠所具有的多种固有免疫缺陷,包括NK细胞活性低、骨髓功能发育不正常(巨噬细胞对LPS反应性分泌IL-1的能力下降)、约30%纯合子无补体成分c5并缺乏补体系统的溶血活性[12-13]。所以,微小巴贝虫虫体在NOD/SCID小鼠和SCID小鼠体内存活时间长,不被免疫系统清除,这提示NOD/SCID小鼠和SCID小鼠可能是保存微小巴贝虫良好的动物模型,也是一个研究免疫反应机理的很好的模型。

图2 BALB/c小鼠体内不同巴贝虫形态A:点状体;B:马耳他十字;C:小环状体;D:环状体;E:长丝状体;F:细胞外虫体Fig.2 Blood smear of BALB/c mice infected with Babesia microtiA:Small point-like body;B:Maltese cross;C:A small circular ring;D:Circular ring;E:Long threadlike body;F:Parasites free outside of red blood cells.

图3 不同组小鼠感染巴贝虫血涂片A:BALB/c小鼠组;B:免疫抑制BALB/c小鼠组;C:SCID小鼠组;D:NOD-SCID小鼠组Fig.3 Blood smear of different mice groups infected with Babesia microtiA:BALB/c mice;B:BALB/c mice of immune suppression;C:SCID mice;D:NOD-SCID mice
另外,由巴贝虫感染不同小鼠血涂片可以看到,大量虫体侵染红细胞,虫体的生长、裂殖导致红细胞大量溶血,引起小鼠溶血性贫血,且尿成黄色。在未处理和免疫抑制BALB/c小鼠体内,虽染虫率高峰时段也可达到82.4%和73.2%,且出现溶血现象,但7~10 d后,由于免疫系统的作用,虫体最终会下降至0%~2%的较低水平,且以后染虫率不会再升高。而缺乏免疫系统的NOD/SCID小鼠组,虫体可在其体内反复增值,裂解红细胞。这说明小鼠的免疫系统起到关键的作用,免疫系统健全的个体,就可以通过自身免疫系统的清除作用,将虫体大量清除以使其处于很低的水平,但却成为一个隐性带虫者,这在输血时会造成很大的危害,在美国等国家已经受到重视[14-15];而免疫系统低下或切脾等免疫系统不健全者,则像SCID小鼠和NOD/SCID小鼠一样存在很大的风险[16]。
本次研究获得了微小巴贝虫在BALB/c小鼠、SCID小鼠和NOD/SCID小鼠体内动态变化的规律;通过免疫抑制BALB/c小鼠充分说明了免疫系统对小鼠体内清除微小巴贝虫的重要作用;且初步建立了巴贝虫感染SCID小鼠、NOD/SCID小鼠的免疫缺陷模型,为进一步开展巴贝虫感染宿主免疫因子及免疫细胞在清除微小巴贝虫时的作用打下了坚实的理论和实验基础。
[1]Krause PJ,Mc Kay K,Thompson CA,et al.Disease-specific diagnosis of coinfecting tickborne zoonoses:babesiosis,human granulocytic ehrlichiosis,and Lyme disease[J].Clin Infect Dis,2002,34(9):1184-1191.DOI:10.1086/339813
[2]Gorenflot A,Moubri K,Precigout E,et al.Human babesiosis[J].Ann Trop Med Parasitol,1998,92(4):489-501.
[3]Homer MJ,Aguilar-Delfin I,Telford SR 3rd,et al.Babesiosis[J].Clin Microbiol Rev,2000,13(3):451-469.DOI:10.1128/CMR.13.3.451-469.2000
[4]Hildebrandt A,Hunfeld KP,Baier M,et al.First confirmed autochthonous case of humanBabesiamicrotiinfection in Europe[J].Eur J Clin Microbiol Infect Dis,2007,26(8):595-601.DOI:10.1007/s10096-007-0333-1
[5]Meer-Scherrer L,Adelson M,Mordechai E,et al.Babesiamicrotiinfection in Europe[J].Curr Microbiol,2004,48(6):435-437.DOI:10.1007/s00284-003-4238-7
[6]Saito-Ito A,Tsuji M,Wei Q,et al.Transfusion-acquired,autochthonous human babesiosis in Japan:isolation ofBabesiamicroti-like parasites with hu-RBC-SCID mice[J].J Clin Microbiol,2000,38(12):4511-4416.
[7]Tsuji M,Wei Q,Zamoto A,et al.Human babesiosis in Japan:
epizootiologic survey of rodent reservoir and isolation of new type of Babesia microti-like parasite[J].J Clin Microbiol,2001,39(12):4316-4322.DOI:10.1128/JCM.39.12.4316-4322.2001
[8]Shi ZB,Li ZZ,Gao RQ,et al.A case of human babesiasis[J].Chin J Parasitol Parasit Dis,1996,14(3):240-240.(in Chinese)
石珍宝,李珍珍,高权荣,等.人体感染巴贝虫一例[J].中国寄生虫学与寄生虫病杂志,1996,14(3):240-240.
[9]Hunfeld KP,Brade V.Zoonotic Babesia:possibly emerging pathogens to be considered for tick-infested humans in Central Europe[J].Int J Med Microbiol,2004,293(37):93-103.
[10]Hunfeld KP,Hildebrandt A,Gray JS.Babesiosis:recent insights into an ancient disease[J].Int J Parasitol,2008,38(11):1219-1237.DOI:10.1016/j.ijpara.2008.03.001
[11]Leiby DA.Babesiosis and blood transfusion:flying under the radar[J].Vox Sang,2006,90(3):157-165.DOI:10.1111/j.1423-0410.2006.00740.x
[12]Bhadri VA,Cowley MJ,Kaplan W,et al.Evaluation of the NOD/SCID xenograft model for glucocorticoid-regulated gene expression in childhood B-cell precursor acute lymphoblastic leukemia[J].BMC Genomics,2011,12:565.DOI:10.1186/1471-2164-12-565
[13]Wang N,Xiao F,Liu J,et al.SLAM family predicting the initiation potential of human acute lymphoblastic leukemia in NOD/SCID mice[J].Chin Med J(Engl),2011,124(19):3074-3079.
[14]Leiby DA.Transfusion-transmittedBabesiaspp.:bull’s-eye onBabesiamicroti[J].Clin Microbiol Rev,2011,24(1):14-28.DOI:10.1128/CMR.00022-10
[15]Wormser GP,Prasad A,Neuhaus E,et al.Emergence of resistance to azithromycin-atovaquone in immunocompromised patients withBabesiamicrotiinfection[J].Clin Infect Dis,2010,50(3):381-386.DOI:10.1086/649859
[16]Hemmer RM,Ferrick DA,Conrad PA.Role of T cells and cytokines in fatal and resolving experimental babesiosis:protection in TNFRp55-/-mice infected with the human Babesia WA1 parasite[J].J Parasitol,2000,86(4):736-742.

