169例女性宫颈病变组织HPV基因分型检测结果分析
张晓燕,余 琦,李 宁*
(1.河北北方学院,河北 张家口 075000;2.解放军总参谋部总医院(309医院)病理科,北京 100091)
169例女性宫颈病变组织HPV基因分型检测结果分析
张晓燕1,余 琦2,李 宁2*
(1.河北北方学院,河北 张家口 075000;2.解放军总参谋部总医院(309医院)病理科,北京 100091)
*通讯作者
宫颈癌是女性常见恶性肿瘤,严重危害妇女健康,其中人类乳头瘤病毒(HPV)基因型与宫颈癌关系最为密切。准确高效的HPV分型检测方法,对于女性宫颈病变患者的健康显得尤为重要。本研究对169例女性宫颈病变患者进行HPV感染基因分型检测,采用表面等离子谐振法检测HPV不同基因亚型,探讨HPV-DNA基因分型和不同宫颈病变的关系,对宫颈病变的早期诊断、预后判断、治疗后的随访监测及宫颈癌疫苗的研发都有重要意义。
1 材料与方法
1.1 资料
1.1.1 病例来源:收集2010年10月至2011年11月于解放军第309医院妇科门诊就731例患者中选取宫颈活检组织169例,年龄20-64岁,平均39.0岁。按组织学病理分类:慢性宫颈炎103例,宫颈上皮内瘤变(CIN)48例,宫颈鳞状细胞癌(SCC)18例。
1.1.2 仪器及试剂:W2600型生物传感芯片阅读仪(北京金菩嘉医疗科技有限公司),表面等离子谐振法检测试剂盒(其中芯片为柱面镜)。
1.2 方法
1.2.1 DNA提取纯化:取石蜡切片放入1.5ml离心管中,加入20μl裂解液,95℃水浴10min融化石蜡。在石蜡凝固前,12 000rpm离心2min,分离溶液和石蜡。加模板前12 000rpm离心2min,上部为石蜡层,取下部的水相做PCR模板。
1.2.2 PCR扩增 ① 按照扩增混合液89μl和Taq酶1μl的比例配置PCR反应体系,反应体系为100 μl,按照计算得出的数量,取扩增混合液和Taq酶,在无菌离心管内涡旋振荡15s使其混匀,并瞬时数秒。按每管90μl分装到无菌的扩增管中,并分别做好样本和阳性对照流池内控品的标记。② 按照标记,向各个PCR扩增中加入5μl对应的样本DNA。盖盖后轻弹管壁使其混匀,瞬时离心数秒使液体全部收集到PCR管底部。③将已经配好的PCR扩增体系放入合适的PCR扩增仪中,按照试剂盒说明书进行扩增。
1.2.3 进行杂交 将扩增产物瞬时离心使液体收集管底,向每管样本扩增产物中加入20μl阳性对照池内控品扩增产物和60μl杂交缓冲液,涡10s混匀,置水浴锅中95℃变性3-5min,之后严格按照SPR检测系统操作即可。
1.2.4 判定标准
SPR检测系统显示:①结果有效:阳性对照流池的信号值≥40mo,阴性对照流池信号值<40mo,则可认定为结果有效。②结果无效:阳性对照流池的信号值<40mo,或者阴性对照流池信号值≥40 mo,则可认定为结果无效。③分型探针检测阳性:探针的信号值≥40mo;④分型探针检测阴性:探针的信号值<4 0mo;
1.3 统计学方法SPSS 17.0软件包建立数据库,采用χ2检验,阳性例数少于5例自动修正为Fisher精确检验,双侧检验水准α=0.05。
2 结果
2.1 宫颈病变与HPV感染情况
在被检查的169名妇科就诊患者中,HPV阳性者69例,总阳性率为40.8%;慢性宫颈炎103例,阳性率为20.4%;CIN(包括CINⅠ、CINⅡ、CINⅢ)48例,阳性率为66.7%;宫颈鳞状细胞癌 (SCC)18例,阳性率为88.9%。随宫颈病变的逐渐升级,HPV感染率呈升高趋势。CIN,宫颈鳞状细胞癌,慢性宫颈炎三组相比,(χ2=48.287,P<0.01,差异有统计学意义(见表1)。
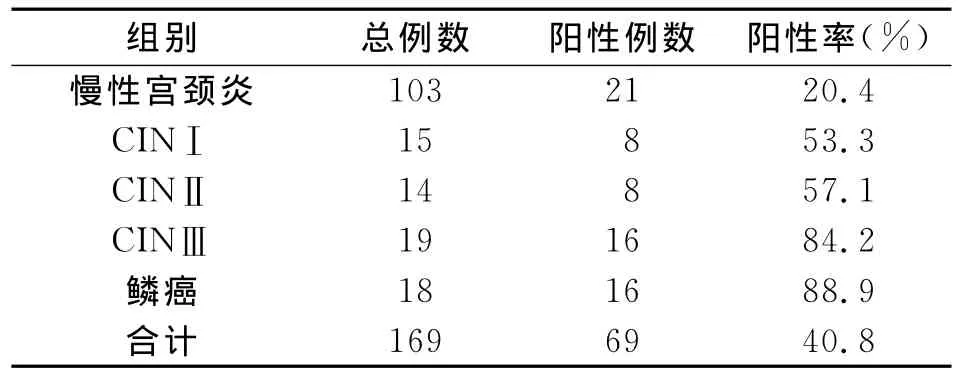
表1 宫颈病变与HPV感染情况比较
2.2 HPV感染与年龄分布
169名宫颈病变患者分成4个年龄段,从表2中可以看出30-40年龄组阳性率(51.1%)最高。对各组阳性率进行检验(χ2=4.346,P>0.05),提示感染者的年龄差异无统计学意义。
2.3 HPV感染的基因亚型分布见表3。HPV单亚型与多重感染病例亚型分布见表4。
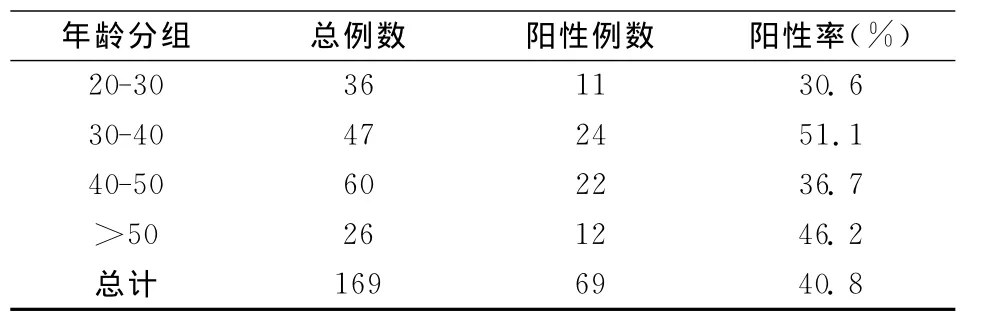
表2 169例女性患者的年龄分布和HPV阳性率
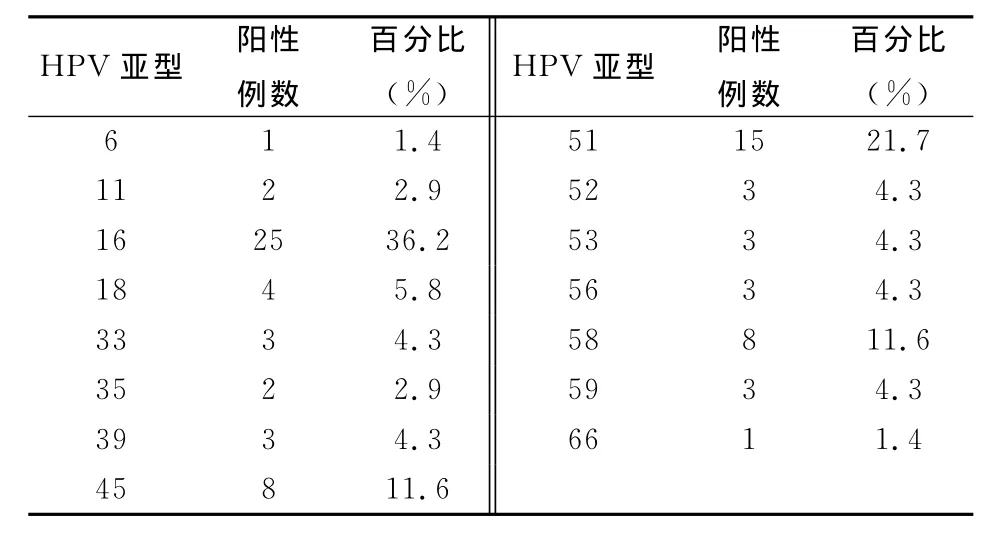
表3 69例HPV阳性者HPV亚型的分布
从表3中可看出高危HPV基因型HPV16、HPV51、HPV45、HPV58感染率较高,感染低危基因型有 HPV6、HPV11(低危型均在宫颈慢性炎组)。在HPV阳性组织69例中低危3例(4.3%),高危型感染66例(95.7%),其中单亚型感染51例(81.2%),多重型感染18例(18.8%,均为高危混合型),见表4。
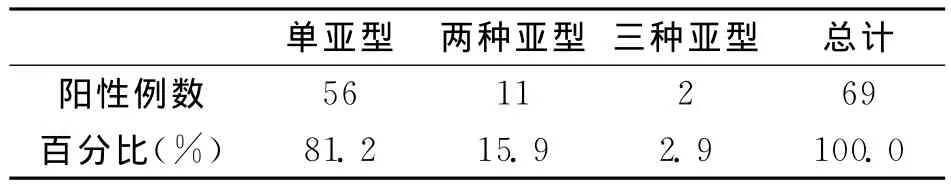
表4 HPV单亚型与多重感染病例亚型的分布情况
3 讨论
宫颈癌被认为是第二个最常见的妇女癌症,尤其是在发展中国家[1]。从全球来看,宫颈癌的发病率约为50万例,每年有50%的病死率。亚洲国家患病率为54%并且有关的死亡人数的80%发生在发展中国家,预计到2020年将增加至90%[2]。分子流行病学已证实,HPV的持续感染是导致子宫颈癌的必要条件.目前,超过90种不同HPV基因型已经确定。在高度鳞状上皮内病变(HSILs)和浸润性宫颈癌组织中已经证实,基因型HPV16、18、31、33、35、39、45、51、52、56、58、59和66为高危型;基因型HPV6和HPV11视为是低危型[3]。在不同的流行病学研究中,低危型HPV6、HPV11通常与生殖器尖锐湿疣有关;而高级别的宫颈鳞状上皮内病变常常感染HPV16、HPV18、HPV45、HPV31基因型[4]。然而,宫颈HPV感染类型是可变的,持续的感染,久而久之就会改变[5]。本研究表明,CIN组与SCC组HPV感染均为高危型感染,其中HPV16、HPV51感染率较高,且两组的多重感染率亦高。所谓HPV的多重感染或称重叠感染,是指在某一个体或某一种病变中感染或检测到两种或两种以上的HPV亚型。已有研究表明,妇女宫颈HPV的多重感染率波动于2%-71%,最多见的报道是10%-20%[6].Lee等人[7]报道,单一的 HPV 基因型感染使宫颈癌的患病风险增加19.9倍,而多重HPV基因型感染使风险增加到31.8倍,表明HPV多重感染增加了宫颈癌患病率。然而,在Sasagawa等[8]报道中,多重 HPV基因型感染的平均比值(OR值)低度鳞状上皮内病变为24,HSILs为16,宫颈癌为8.3,随着宫颈疾病的加重多重感染率反而有所下降。这说明,多重HPV感染和宫颈癌的发病之间的关联问题可能要等待进一步的大规模研究。
近年来在我国的宫颈癌发病率呈上升趋势,发病年龄也趋于年轻化,HPV感染也越发年轻化。大多数患者初次感染HPV无任何症状出现,一般无须治疗,不超过2年就会自行消失。然而,在一些妇女中,HPV感染有时会持续多年,并可能会增加宫颈癌的风险[9].本研究表明,在不同的年龄段中,30-40岁HPV感染率最高,这可能与多性伴侣,吸烟和长期使用口服避孕药以及其他性传播疾病有关[10,11]。
本实验应用等离子谐振技术(SPR)检测24种HPV基因型,包括16种高危型(16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、81)和 8种低危型(6、11、40、42、43、44、54、70)。首先从待测样品中提取基因组,采用聚合链式反应 (PCR)扩增待测样品中HPV基因片段,将PCR产物与杂交液按一定比例混合后,注入SPR生物传感芯片阅读仪,使其流过表面包被有24种HPV基因型特异性探针的SPR生物传感芯片,与芯片表面HPV基因型特异探针反应,芯片阅读仪利用金属膜/液面界面,由光发射引起的物理光学现象来分析分子间相互作用原理来检测芯片上的杂交信号,数据通过软件分析可直接判断结果,从而同时对HPV的24种基因型进行检测。SPR一次检测就可能判断某一基因座位的大部分或全部等位基因,此技术在HPV混合感染的检测中更具优势,能检测出较多的型别和某些少见的HPV型别,可作为筛查检测工具。不仅可用于分型,而且可以对多个型别的混合感染同时进行监控,较杂交捕获法更有优势。灵敏度和特异性相对其他方法较高,其敏感性高于细胞学。检测结果客观性强,运用计算机软件对杂交结果进行扫描分析和数据处理,减少了分析时间。
综上所述,持续的高危型HPV感染是宫颈癌发生的必要条件和首要因素。利用表面等离子谐振法(SPR)对 HPV 进行检测和分型,并进一步对HPV各亚型的分布有所了解,有助于指导女性宫颈癌的预防、筛查、疫苗研究及宫颈癌的早期诊断,达到降低宫颈癌发生率的目的。
[1]Qiao YL.Perspective of cervical cancer prevention and control in developing countries and areas[J].Ai Zheng,2010,29(1):1.
[2]Parkin DM,Bray F,Ferlay J,et al.The burden of HPV related cancers.In:Barrett ADT,Stanberry LR(eds)Vaccines for biodefense and emerging and neglected diseases[M].Academic Press,London,2006:S11-S25.
[3]Hidemichi Watari,Rie Michimata,Motoaki Yasuda,et al.High Prevalence of Multiple Human Papillomavirus Infection in Japanese Patients with Invasive Uterine Cervical Cancer[J].Pathobiology,2011,78:220.
[4]Lavinia M C,Diana S,Cecilia C.HPV and cervical squamous intraepithelial lesions:clinicopathological study[J].Rom J Morphol Embryol,2011,52(1):89.
[5]Brown DR,Legge D,Qadadri B.Distribution of human papillomavirus types in cervicovaginal washings from women evaluated in a sexually transmitted diseases clinic[J].Sex Transm Dis,2002,29(12):763.
[6]Milutin G N,Sabol I,Halec G,et al.Retrospective study of the prevalence of high-risk human papillomaviruses among Croation women[J].Coll Antropol,2007,31(2):89.
[7]Lee SA,Kang D,Seo SS,et,al.Multiple HPV infection in cervical cancer screened by HPV DNA chipTM [J].Cancer Lett,2003,198:187.
[8]Sasagawa T,Basha W,Yamazaki H,et,al.High-risk and multiple human papillomavirus infections associated with cervical abnormalities in Japanese women[J].Cancer Epidemiol Biomarkers Prev,2001,10:45.
[9]Lan Vu,Ha Le,Oanh Luong,et al.Prevalence of Cervical Human Papillomavirus Infection Among Married Women in Hanoi,Vietnam [J].Asia-Pacific Journal of Public Health,2011,28:1.
[10]Winer RL,Lee SK,Hughes JP,et al.Genital human papillomavirus infection:incidence and risk factors in a cohort of female university students[J].Am J Epidemiol,2003,157:218.
[11]Castle PE,Wacholder S,Lorincz AT,et al.A prospective study of high-grade cervical neoplasia risk among human papillomavirus-infected women[J].Natl Cancer Inst,2002,94:1406.
1007-4287(2013)05-0934-03
2011-12-28)

