双离子液体富集结合原子吸收测定植物中痕量锂
徐晶晶, 李在均
(江南大学化学与材料工程学院,江苏无锡214122)
锂是人和动物生命活动中重要的微量元素。通过锂离子扩散、阴离子(LiC)交换、Li+-Na+交换、调节Na-K转运体改善人体的造血功能。锂作用于腺苷酸环化酶(AC)-环腺苷酸(cAMP)系统,抑制AC活性以及cAMP合成,在神经系统起着重要的作用。锂能抑制DNA聚合酶的活性,从而导致遗传异常;但锂可以抑制单纯孢疹病毒Ⅰ与Ⅱ型及其他DNA病毒的复制,具有较好的抗病毒效果[1]。研究表明,人体对锂的饮食需要量为60~100 μg/d。人体缺锂可能导致暴力倾向、心脏病和学习能力低下;动物缺锂则使寿命缩短、行为异常、生殖存活率降低等[2]。锂盐应用于医学在20世纪50年代就有报道,锂盐对神经性疾病(如狂躁症、抑郁症、儿童多动症、癫痫、帕金森病)和脂溢性皮炎等疾病有显著的治疗作用[3]。然而,口服锂盐易引起注意力分散、记忆力降低、甲状腺肿大、肾功能障碍等许多毒副作用。
药用植物治疗效果明显,副作用低,被广泛用于各种疾病治疗。锦葵科、石竹科、蔷薇科和毛莨属植物中含锂相对丰富,可用于人体的安全补锂[4]。由于植物中锂含量非常低,共存元素丰富,对分析方法在灵敏度和选择性方面均有较高要求。目前,锂定量测定的常规方法主要是电感耦合等离子发射光谱法(ICP-AES)、质谱法(MS)、高碘酸钾法、原子发射光谱法(AES)和火焰原子吸收分光光度法(FAAS)[5-7]。ICP-AES 灵敏度高,但仪器昂贵,分析成本高;MS法操作简单,但植物中所含的其他金属元素易对测定锂产生干扰;高碘酸钾法是通过加入高碘酸铁盐和钾盐与锂离子生成黄色复盐,洗涤后进行溶解比色分析,实验繁琐,且不能用于痕量锂的定量测定;AES法操作简便,检测限低,但光谱及非光谱干扰较严重;FAAS法简便快速,选择性好,但灵敏度偏低。为获得可靠的分析结果,适当地预富集对植物中痕量锂的检测是十分重要的。锂富集的常规方法是沉淀法、离子交换法、灰化法和溶剂萃取法[8-9]。沉淀法不适合痕量锂的富集;离子交换法生产成本高,交换过程耗时长;灰化法在高温条件下进行,能源损耗大,锂的富集倍数小。溶剂萃取法成本低,设备简单,广泛应用于萃取微量及痕量锂。通常,锂的萃取采用煤油、二氯苯等有机溶剂作为稀释剂或萃取介质[10-11]。有机溶剂的大量使用不仅产生环境污染,而且对操作人员的身体健康危害严重。
离子液体具有导电率高、蒸气压低、液程宽、化学与电化学稳定性好、无污染和易回收等突出的优点[12];同时可以选择性地将某种有机阳离子和某种阴离子结合在一起,“设计”合成具有适合某种特殊需要的离子液体。近年来,离子液体用于溶剂萃取领域的研究取得较大进展,并在分析化学、湿法冶金等方面得到应用[13]。文中采用憎水性离子液体1,3-二辛基咪唑六氟磷酸盐、亲水性离子液体溴化1-丁基-3-甲基咪唑和4-甲基-10-羟基苯并喹啉分别作为萃取介质、协助剂和螯合剂,建立了双离子液体锂绿色萃取分离新体系,并结合火焰原子吸收光度法应用于快速分析测定植物样品中痕量锂。该方法具有绿色、环保和高效的显著特点。
1 材料与方法
1.1 试剂及仪器
1.1.1 试剂 N-三甲基硅烷基咪唑,工业纯,浙江凯乐化工厂生产;溴代正丁烷、溴代正己烷和溴代正辛烷,工业纯,宜兴市芳桥骋源化工有限公司生产。六氟磷酸钾、氢氧化钠、氢氧化锂、硝酸银,分析纯,均由国药集团化学试剂有限公司提供。
4-甲基-10-羟基苯并喹啉按文献方法合成[14]。0.2 mol/L的4-甲基-10-羟基苯并喹啉溶液配制:准确称取一定量的4-甲基-10-羟基苯并喹啉,加入到离子液体中,在搅拌下加热溶解使其完全溶解,备用。实验用水为二次蒸馏水。
1.1.2 仪器 Varian spectrAA 220Z原子吸收分光光度计,美国Varian公司制造;旋转蒸发器,上海申顺生物科技有限公司制造;80-2离心沉淀器,金坛医疗仪器厂制造;GS12-2电子恒速搅拌器,上海医械专机厂制造;DZF-6020真空干燥箱,上海新苗医疗器械制造有限公司制造。
1.2 离子液体的合成
在500 mL三口烧瓶中,加入100 mL N-三甲基硅咪唑(0.92 mol)和 197 mL溴代正辛烷(1.84 mol),70℃ 条件下搅拌反应48 h,得到黄色黏稠液体溴化1,3-二辛基咪唑;然后将其转移至2 000 mL烧杯中,加入1 000 mL去离子水,搅拌并分批加入169 g六氟磷酸钾(0.92 mol),室温下反应4 h,弃去水相,用去离子水反复洗涤,直至用AgNO3溶液检验无Br-为止。真空干燥,得无色透明的1,3-二辛基咪唑六氟磷酸盐离子液体([D(C8)IM][PF6]),总产率为87%。离子液体的组成和结构被元素分析、红外、质谱和核磁共振证实。其他离子液体均按上述方法合成,仅以不同的溴代烷代替溴代正辛烷[15]。
1.3 锂的萃取与反萃
在250 mL分液漏斗中,加入100 mL水相(含质量浓度为0.5 mg/L的 LiOH,浓度为0.6 mol/L的[C6Mim]Br和 1.6 mol/L NaOH)和 10 mL 的[D(C8)IM][PF6] 离子液体相 (含浓度为 0.2 mol/L的4-甲基-10-羟基苯并喹啉),剧烈摇动5 min,静置分层,收集离子液体相。采用原子吸收法测定水相中锂的浓度,并按下式计算萃取率

其中,c0和c分别为萃取前后水相中锂的浓度。向离子液体相中加入 1.5 mL浓度为 0.1 mol/L的Na2SO4,剧烈摇动5 min,离心分离,收集上层水相,用于原子吸收分光光度计测定锂离子的浓度。
1.4 样品的收集与灰化
摘取蔷薇藤藤蔓的蔷薇叶子,依次用白猫洗洁精清洗、自来水冲洗、超纯水漂洗3次,然后置于烘箱中于90℃ 干燥2 h,真空冷却至室温制得脱水蔷薇叶子样品。准确称取一定量的上述脱水样品于小瓷坩埚中,放在电炉上碳化1 h,然后置入马弗炉于550℃ 灰化8 h;冷却后,加入10 mL浓度为1mol/L的硝酸溶解灰分,然后转移至25 mL容量瓶中用去离子水定容[7]。
2 结果与讨论
2.1 萃取介质的选择
作为溶剂萃取的介质,离子液体的黏度及在水中的溶解度直接影响萃取过程的操作性、萃取效率的高低和富集倍数的大小。通常,离子液体咪唑环上烷基链的碳原子数越大,其阳离子的有机性越好,使离子液体不仅因对极性较小的离子缔合物溶解能力强而具备较高的萃取效率,而且在水中的溶解度迅速减小,有利于用提高相比的方法获得较大的富集倍数。然而,现有的1-烷基-3-甲基咪唑六氟磷酸盐离子液体可设计性较差,当烷基链的碳原子数增加至10,离子液体呈现为半固体状态,它难以用于常温下的溶剂萃取。近几年,单海霞等设计合成了一系列新的离子液体——对称烷基咪唑六氟磷酸盐([D(Cn)IM][PF6])[15-16](见图 1)。咪唑环的1-位和3-位同时连接上两个相同的烷基链,使其阳离子和阴离子的不对称性增加,从而获到了更大的液程范围。
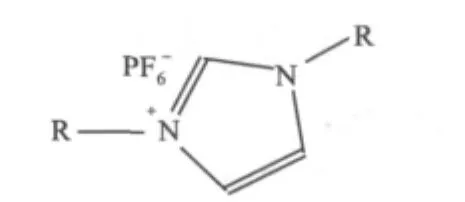
图1 [D(Cn)IM][PF6]的分子结构通式Fig.1 Molecular structure of[D(Cn)IM][PF6]
表1 为不同对称烷基咪唑六氟磷酸盐离子液体的黏度(25℃)和在水中的溶解度。
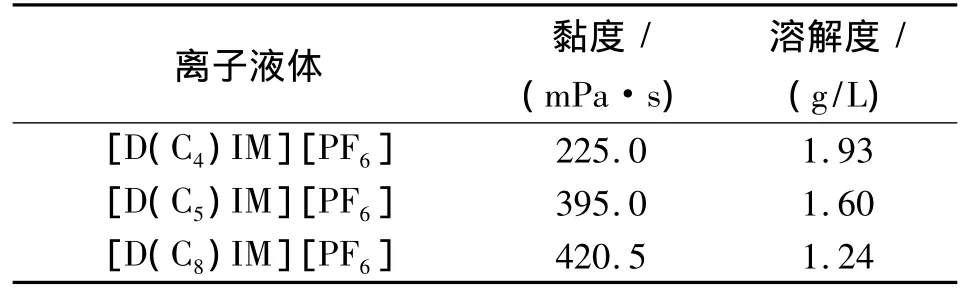
表1 不同离子液体的黏度和在水中溶解度Tab.1 Viscosity and solubility for ionic liquid
从表1可以看出,离子液体的黏度随着碳原子数的增加逐渐增大,而它在水中的溶解度却缓慢地下降。3种对称烷基咪唑离子液体的水溶性明显小于传统的1-丁基 -3-甲基咪唑六氟磷酸盐(18 g/L)[15]。离子液体黏度太大,在萃取过程中易附着器壁上造成其损失。综合考虑离子液体黏度及在水中溶解度两方面因素,文中选择[D(C8)IM][PF6]为萃取介质。
2.2 缔合剂的影响
水溶性的离子液体溶于水后即电离成咪唑阳离子和溴阴离子。其中,咪唑阳离子可与4-甲基-10-羟基苯并喹啉和锂络合所形成的带负电荷的络阴离子缔合。图2为不同离子液体作为缔合剂对锂萃取率的影响。
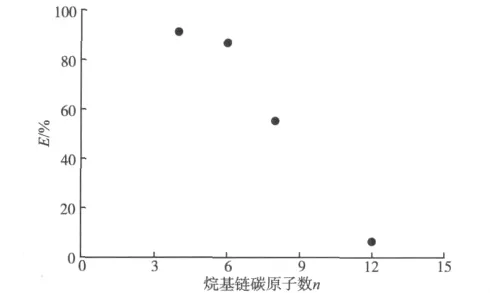
图2 离子液体对萃取率的影响Fig.2 Effect of different ionic liquid on lithium extraction efficiency
由图2可以看出,随着离子液体中烷基链上碳原子数的增加,锂的萃取率迅速降低。这主要是因为碳链的增长使离子液体阳离子进入络阴离子附近的空间位阻增大,不利于形成稳定的螯合-离子缔合物,使萃取效率减小。
此外,文中还考察了不同离子液体溶液的表面活性。研究发现,随烷基链的碳原子数增加离子液体的表面张力迅速降低。表面张力越小,其表面活性越高,在萃取过程中两相分离就越困难。因此,溴化1-丁基-3-甲基咪唑被选择作为缔合剂。
2.3 萃取条件优化
为了提高萃取效率,文中分别考察了介质酸度、缔合剂浓度和萃取时间的影响。4-甲基-10-羟基苯并喹啉作为螯合剂,它的1-位氮原子和10-位羟基中的氧原子是配位原子,按配位化学理论羟基上的氢原子离去后所形成的带负一价的氧具有更强的配位能力,10-羟基苯并喹啉与锂离子的螯合反应宜在强碱性介质中进行。因此,采用氢氧化钠以确保水相呈强的碱性。氢氧化钠浓度对锂萃取的影响如图3所示。
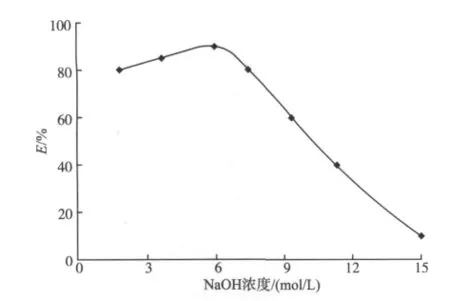
图3 NaOH浓度的影响Fig.3 Effect of the concentration of NaOH
由图3可以看出,当氢氧化钠浓度小于1.6 mol/L,锂的萃取率随氢氧化钠浓度的增加而增大;继续增加氢氧化钠的浓度,其萃取率将减小,这可能是因溶液中大量游离OH-与4-甲基-10-羟基苯并喹啉共同同锂发生竞争配位所致。缔合剂参与形成中性的螯合-离子缔合物,只有形成中性分子后锂才能被有效萃取而进入离子液体相,因此它的浓度对锂的萃取率影响是显著的。缔合剂的浓度对锂萃取率的影响见图4。
由图4可知,当溴化1-丁基-3-甲基咪唑的浓度小于0.6 mol/L时,锂萃取率随缔合剂浓度的增加而迅速增加;继续增加缔合剂浓度,锂萃取率趋于平稳。为了获得较高的萃取率,文中采用浓度为0.6 mol/L的溴化1-丁基-3-甲基咪唑。由于锂与螯合剂及缔合剂之间的反应瞬间即可完成,萃取时间主要取决于该螯合-离子缔合物在两相中的分配平衡。实验结果表明,当萃取时间超过5 min时锂萃取率达到最大;进一步延长萃取时间,锂萃取率基本保持不变。为节省时间,萃取时间确定为5 min。
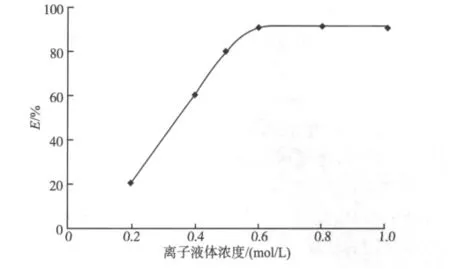
图4 离子液体浓度的影响Fig.4 Effect of the concentration of ionic liqud
2.4 锂的反萃
锂螯合 -离子缔合物分解,可采用削弱4-甲基-10-羟基苯并喹啉中氮和氧原子的配位能力和引入大量阴离子同螯合剂中的配合原子进行配位、缔合竞争两种方式实现。前者常采用加入强酸将螯合剂中的氧和氮原子质子化,使其丧失配位能力;后者常通过加入大量无机盐以提供丰富的阴离子使螯合剂中的配位原子的配位优势下降。由于4-甲基-10-羟基苯并喹啉易溶于酸性水溶液,如果采用酸反萃将导致水相中含有大量的螯合剂而难以用于原子吸收光度法检测锂。因此,文中选择向离子液体相中加入Na2SO4溶液将萃取螯合-缔合物转化成硫酸盐,使锂离子从有机相返回到水相,从而实现锂离子的反萃。
此外,作者还考察了Na2SO4浓度对锂反萃的影响。结果表明,当Na2SO4浓度达到0.1 mol/L时锂的反萃率达到最大,继续增加浓度反萃率趋于稳定。实验中采用0.1 mol/L的Na2SO4溶液1.5 mL进行锂的反萃。在最佳条件下,锂的一次萃取率和反萃率分别为95.5% 和99.8%,富集倍数超过50倍。
2.5 共存组分对锂萃取与测定的影响
在植物样品中主要的共存组分是钙、镁、钾和钠,它们不能与4-甲基-10-羟基苯并喹啉形成螯合物故无法萃取进入离子液体,对锂的萃取不产生干扰。尽管4-甲基-10-羟基苯并喹啉也能同铍和锌离子形成稳定的螯合物而被萃取进入离子液体相,但这并不降低体系对锂的萃取能力。研究表明,在水相中加入100 μg/mL锌离子锂的萃取率几乎没有明显变化,这表明锌的存在不干扰锂的富集萃取。由于火焰原子吸收法具有好的选择性,少量锌离子的存在对测定锂不会产生不良影响。
2.6 离子液体的循环利用
实验表明,当锂的萃取与反萃次数小于50次时,离子液体重复使用对锂的萃取率没有明显影响;但当重复利用次数超过50次时,锂的萃取率将略有降低。这是因为在萃取过程中4-甲基-10-羟基苯并喹啉有部分氧化,其氧化产物不能再与锂反应形成稳定的螯合物,从而导致锂的萃取率减小。
然而,将使用后的离子液体加入强酸使4-甲基-10-羟基苯并喹啉完全溶解到水中,再重新加入新的4-甲基-10-羟基苯并喹啉,离子液体相又重新用于锂的萃取,锂的萃取率与初次萃取相当。可见,离子液体可循环使用。
2.7 工作曲线的绘制
配制一系列锂标准溶液,按1.3方法进行萃取、反萃,最后用原子吸收法测定反萃液的吸光度。以吸光度为纵坐标锂浓度为横坐标,绘制工作曲线得到回归方程:
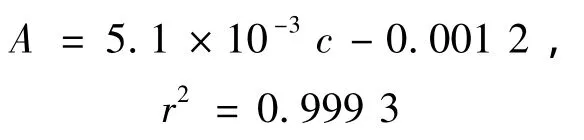
其中:A为吸光度;c为样品中锂的质量分数(μg/g)。
由该曲线可知,其线性范围在0~100 μg/g之间,与ICP-AES,MS相比测定结果偏差较小。配置11个试剂空白样品,测得方法的检出限为0.1 μg/g。
2.8 蔷薇叶中痕量锂的测定
取处理后的蔷薇叶样品100 mL,按照1.4方法操作并测定吸光度,代入回归方程计算蔷薇叶中锂的含量,重复测定6次取平均值,结果列于表2。同时,做相应的标准加入回收实验,锂的回收率在97.0% ~102.5%,这一数据显示方法具有较好的准确性和稳定性。
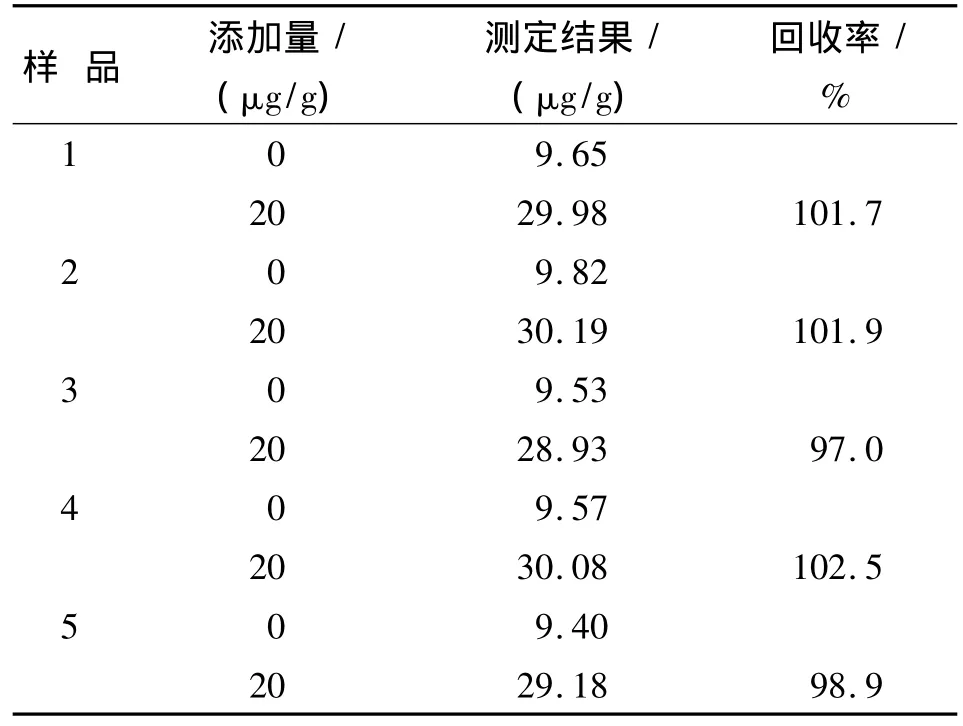
表2 蔷薇叶中锂的测定Tab.2 Determination of lithium in Rosa multi-flora samples
3 结语
憎水性离子液体[D(C8)Im)][PF6]在水中溶解度低且表面活性较低,文中以亲水性离子液体[CnMim]Br作为缔合剂,4-甲基-10-羟基苯并喹啉作为螯合剂,实现了对复杂的植物样品中的痕量锂元素的富集。结合火焰原子吸收系统应用于测定样品中的痕量锂,降低了传统分析方法的检测限。该萃取体系具有高萃取效率,对金属离子的选择性强,共存金属离子不干扰锂的测定。
双离子液体萃取体系,可用于样品中痕量组分的分离与富集,操作简便,减少了传统有机溶剂对环境的污染。
[1]王夔,魏慧娟,罗贤愁.生命科学中的微量元素[M].2版.北京:中国剂量出版社,1996:362-373.
[2]秦俊法.锂的生物必需性及人体健康效应[J].广东微量元素科学,2000,7(3):1-15.QIN Jun-fa.Lithium biological necessity and human health effects[J].Guangdong Trace Elements Science,2000,7(3):1-15.(in Chinese)
[3]Mogens Schou.Lithium in psychiatric therapy[J].Psychopharmacologia,1959,1(1):65-78.
[4]Lovkova M Y,Sokolova S M,Buzuk G N.Lithium-concentrating plant species and their pharmaceutical usage[J].General Biology,2007,412(5):713-715.
[5]芮玉奎,郝彦玲,张福锁,等.应用ICP-MS/ICP-AES鉴定榆钱中22种微量元素的含量[J].光谱学与光谱分析,2007,27(10):2111-2113.RUI Yu-kui,HAO Yan-ling,ZHANG Fu-suo,et al.ICP-MS/ICP-AES applicate to identify 22 trace elements in atriplex[J].Spectroscopy and Spectral Analysis,2007,27(10):2111-2113.(in Chinese)
[6]Stefan Baunack,Andreas John,Stanislav Kúdela.In-situ characterization of MgLi composite materials by means of AES and factor analysis[J].Mikrochimica Acta,1997,125:245-249.
[7]赵飞,郭俊明,张虹,等.荷叶中锂的光谱测定[J].广西热带农业,2009(3):1-2.ZHAO fei,GUO Jun-ming,ZHANG Hong.Spectrometry detection lithium in lotus leaf[J].Tropical Agriculture,2009(3):1-2.(in Chinese)
[8]YANG Hong-jun,LI Qing-hai,LI Bing.Optimization of operation conditions for extracting lithium ions from calcium chloridetype oil field brine[J].International Journal of Minerals,Metallurgy and Materials,2012,19(4):290-294.
[9]宋贤菊,王仕芳,李在均.离子液体作为绿色介质应用于盐湖卤水中锂提取的研究[J].稀有金属,2011,35(3):434-439.SONG Xian-ju,WANG Shi-fang,LI Zai-jun.Application of ionic liquid as green medium for extraction of lithium from salt lake brine[J].Chinese Journal of Rare Metals,2011,35(3):434-439.(in Chinese)
[10]徐徽,孙锡良,侯立松.从盐湖卤水萃取锂的影响因素分析[J].湖南有色金属,2005,21(1):9-10.XU Hui,SUN Xi-liang,HOU Li-song.Effect factor analysis of solvent extraction lithium from Bittern[J].Hunan Nonferrous Metals,2005,21(1):9-10.(in Chinese)
[11]贠玺.苏丹I-N263体系萃取锂的研究[J].新疆有色金属,1981(2):27-33.YUN Xi.Study on Sudan I-N263lithium extraction system[J].Xinjiang Nonferrous Metals,1981(2):27-33.(in Chinese)
[12]赵彦玲,袁彦超,张秀玲.绿色离子液体的合成与应用[J].化学工程师,2010,179(8):38-41.ZHAO Yan-ling,YUAN Yan-chao,ZHANG Xiu-ling.Systhesis and application of green ionic siquids[J].Chemical Engineer,2010,179(8):38-41.(in Chinese)
[13]LI Zai-jun,WEI Qin,ZHOU Xia,et al.A new temperature ionic liquid 1-butyl-3-trimethylsilylimidazolium hexafluorophosphate as a solvent for extraction and pvvconcentration of mercury with determination by cold vapor atomic absorption spectrometry[J].Talanta,2007,71(1):68.
[14]GUO Zhi-qiang,DONG Zhen-ming,ZHU Rui-tao,et al.Synthesis and photophysical properties of complexes of Be(II)and Zn(II)with 10-hydroxybenzo[h]quinoline ligand[J].Spectrochimical Acta Part A,2007,68:337-340.
[15]单海霞.新型烷基咪唑离子液体的合成及应用[D].无锡:江南大学,2010.
[16]单海霞,陆杨,李在均,等.新型温控离子液体介质中脂肪本科催化合成乙酸苯乙酯[J].催化学报,2010,31(3):289-294.SHAN Hai-xia,LU Yang,LI Zai-jun,et al.A novel temperature-controlled ionic liquid as the medium for phenylethyl acetate synthesis catalyzed by lipase[J].Chinese Journal of Catalysis,2010,31(3):289-294.(in Chinese)

