阿托伐他汀预处理对非ST抬高急性冠脉综合征患者行冠脉支架置入术后炎性因子和预后的影响*
许春平,赵献明,曾 波,黎素军,梁伟东
(广西南宁市第一人民医院,广西 南宁 530022)
冠状动脉内粥样硬化斑块破裂及在病变部位的血栓形成是导致急性冠脉综合征(ACS)的主要原因,而斑块局部的炎症细胞浸润及一些具有生物学活性的介质的释放是导致斑块不稳定的重要因素之一。血清C反应蛋白(CRP)、肿瘤坏死因子α(TNF-α),白介素-1(IL-1)和白介素-6(IL-6)均为血管炎症反应的标记物,其血清水平的高低有助于区分高危心血管病患者[1]。近来他汀类调脂药物的抗炎作用备受关注[2]。本研究检测了非ST段抬高的ACS患者行冠脉支架置入术(PCI)前后血清CRP、TNF-α、IL-1和IL-6水平的变化及阿托伐他汀预处理对其的影响,初步探讨阿托伐他汀预处理对非ST抬高ACS患者PCI后炎性因子和预后的影响。
1 资料与方法
1.1 临床资料:选择2007年6月至2009年12月在我院住院的非ST抬高的急性冠脉综合症(ACS)患者76例,其中男性患者49例,平均年龄(53.6±12.8)岁,女性患者27例,平均年龄(52.9±14.6)岁。所有患者均符合世界卫生组织的诊断标准,其中非ST段抬高型急性心肌梗死的患者为33例,不稳定型心绞痛的患者为43例。排除4周内服用降脂药物,以及伴有严重肝脏及肾脏疾病患者。将76例患者随机分组为阿托伐他汀预处理组(共38例)和对照组(共38例)。两组间年龄、性别及心脑血管主要相关危险因素(吸烟、高血压病、糖尿病)的比较差异无统计学意义(P>0.05),见表1。
表1 两组临床资料和相关实验室检查资料的比较(±s)
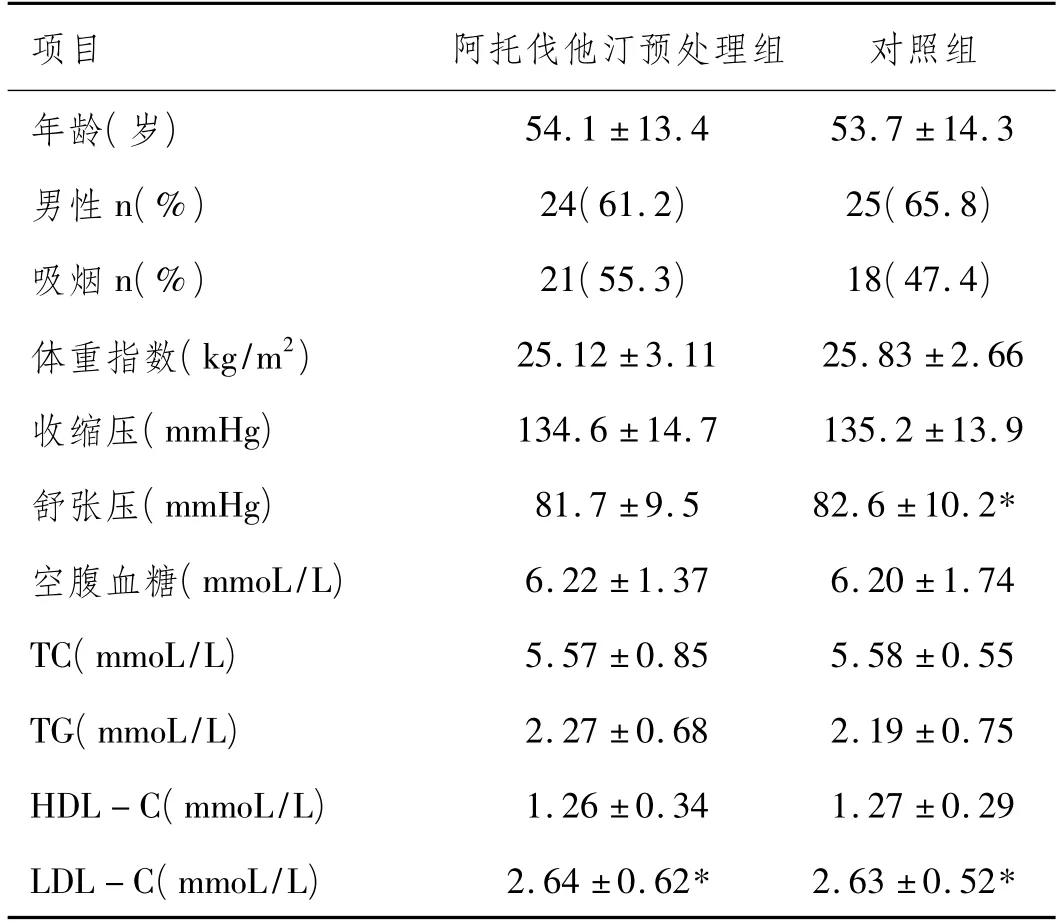
表1 两组临床资料和相关实验室检查资料的比较(±s)
项目 阿托伐他汀预处理组 对照组年龄(岁)54.1±13.4 53.7±14.3男性n(%) 24(61.2) 25(65.8)吸烟n(%) 21(55.3) 18(47.4)体重指数(kg/m2) 25.12±3.11 25.83±2.66收缩压(mmHg) 134.6±14.7 135.2±13.9舒张压(mmHg) 81.7±9.5 82.6±10.2*空腹血糖(mmoL/L) 6.22±1.37 6.20±1.74 TC(mmoL/L) 5.57±0.85 5.58±0.55 TG(mmoL/L) 2.27±0.68 2.19±0.75 HDL-C(mmoL/L) 1.26±0.34 1.27±0.29 LDL-C(mmoL/L) 2.64±0.62* 2.63±0.52*
1.2 方法:阿托伐他汀预处理组于PCI前24h内服用80mg阿托伐他汀,对照组于PCI前24h内未服用阿托伐他汀。所有的患者在术前都常规服用600mg负荷剂量的氯吡格雷,并于48h内行PCI治疗。两组术后均长期服用常规剂量阿托伐他汀(每日20mg)、阿司匹林、氯吡格雷。于手术前及术后6h、12h、1周取患者静脉血10mL注入EDTA抗凝管,混合均匀后进行指标检测。CRP,肿瘤坏死因子α(TNF-α),IL-1和IL-6均采用双抗体夹心酶联免疫吸附法(ELISA法)测定,试剂盒均由美国博适(Biosite)公司提供。上述三个指标在标本收齐后同时进行一次性测定。同时在30d和60d内观察患者主要心脏不良事件发生例数,包括显著心力衰竭(EF<35%)、ST段抬高的心肌梗死、死亡。
2 结果
2.1 两组术后血清炎性因子的变化:与术前相比,阿托伐他汀预处理组和对照组术后的血清CRP、TNFα、IL-1β和IL-6水平均逐渐下降,差异有统计学意义(统计结果未标注)。术后12h和1周中,阿托伐他汀预处理组的血清CRP、TNF-α、IL-1β和IL-6水平显著低于对照组,差异有统计学意义;而术后6h的两组血清炎性因子比较无统计学的差异,见表2。
表2 两组术前术后的相关血清炎性因子的比较(±s)

表2 两组术前术后的相关血清炎性因子的比较(±s)
注:与对照组比较,#P<0.01,*P<0.05
时间 阿托伐他汀预处理组 对照组术前CRP(mg/L) 44.25±13.31 48.06±12.38 TNF-α(pg/mL) 132.46±41.78 138.33±49.05 IL-1β(pg/mL) 97.44±35.23 103.85±41.92 IL-6(pg/mL) 57.42±15.28 59.63±18.34术后6h CRP(mg/L) 38.12±11.28 37.66±12.68 TNF-α(pg/mL) 128.25±42.46 125.37±37.08 IL-1β(pg/mL) 86.37±31.32 87.68±35.65 IL-6(pg/mL) 50.11±30.35 48.93±31.43术后12h CRP(mg/L) 30.62±10.34* 31.28±11.57 TNF-α(pg/mL) 112.44±37.23* 115.07±36.25 IL-1β(pg/mL) 73.17±23.45* 78.64±21.08 IL-6(pg/mL) 40.43±21.87 41.23±19.36术后1周CRP(mg/L) 18.43±5.68* 21.42±6.83 TNF-α(pg/mL) 62.45±12.37# 72.43±15.54 IL-1β(pg/mL) 33.02±9.23* 38.45±11.48 IL-6(pg/mL) 25.17±12.84*31.36±10.65
2.2 两组术后心脏不良事件发生例数的比较:术后30d和60d,阿托伐他汀预处理组和对照组的心脏不良事件发生例数无统计学差异,见表3。
表3 两组心脏不良事件发生例数的比较(±s)

表3 两组心脏不良事件发生例数的比较(±s)
注:两组比较无统计学差异
不良事件 阿托伐他汀预处理组 对照组术后30d显著心力衰竭 6 5 ST段抬高的心肌梗死 2 1死亡 1 1术后60d显著心力衰竭 8 6 ST段抬高的心肌梗死 5 6死亡2 3
3 讨论
急性冠脉综合征(ACS)的概念包括不稳定型心绞痛(UA),ST段抬高急性心肌梗死(AMl),非ST段抬高性AMI,其发病的主要机制是在斑块破裂的基础上出现急性血栓形成。研究发现,ACS患者的冠状动脉内存在局部炎症,斑块肩部是炎症的好发部位[3]。研究还提示,并非血管内皮斑块破裂造成炎症细胞激活,而是被激活的炎症细胞促进了血管内皮斑块由稳定转向破裂的进程。ACS的症状消失一段时间后炎症仍可持续存在,并有可能再发急性冠脉事件[4]。
他汀类药物都是3-羟基-3-甲基戊二酸单酰COA还原酶抑制剂,其在临床上的应用尤其是在急性冠脉综合症中的应用创造了冠心病治疗的新时代,不仅仅是它的降血脂相关作用[5],还有其改善血管内皮功能、减少斑块表面张力、抗炎等作用,使斑块趋于稳定。他汀类药物可以抑制核因子B在巨噬细胞及血管平滑肌细胞中的活化作用。消除巨噬细胞对血管内皮的浸润,降低炎性介质、炎性细胞因子和新生内膜、中膜的水平,从而减轻斑块的炎症相关反应[6]。
Schwartz等[4]的MIRACL研究是第一次在ACS早期进行的强化降血脂治疗的国际性的临床研究,3086例急性冠脉综合症患者发病后24-96h内开始接受阿托伐他汀钙片每天80mg或安慰剂共16周。研究结果显示,阿托伐他汀组的心脏停搏、非致死性心肌梗死或死亡、心绞痛恶化住院的所有联合终点与安慰剂组比较下降16%,心绞痛及脑卒中的相对危险性分别下降26%和50%。张霞等[7]研究发现阿托伐他汀可通过改善内皮功能从而改善冠心病介入治疗的预后。陈元立等[8]发现,与对照组相比,阿托伐他汀治疗组缺血事件发生率(包括心源性死亡、心肌梗死、脑血管意外、血管成形术、心绞痛恶化而需要住院)明显下降。本组资料提示了阿托伐他汀预处理对非ST抬高ACS患者PCI后炎性因子在干预12h后和干预1周后有积极作用,从而迅速稳定动脉斑块。但术后30d和60d两组的心脏不良事件发生例数差异无统计学意义。尽管许多研究认为他汀类药物对接受PCI术后的ACS患者有益,如有效降低PCI围手术期心脏不良事件。
[1] 陆治平,黄进.阿托伐他汀对CHF患者血清胱抑素C、心肾及炎性指标的影响[J].中华全科医学,2013,11(4):542,588.
[2] Arita Y,Kihara S,OuchiN,et al.Paradoxical decrease of an adipose-specific protein,adiponectin,in obesity[J].Biochem Biophys Res Commun,1999,257(1):79-83.
[3] Aikawa M,Rabkin E,Sugiyama S,et al.An HMG-CoA reduetase inhibitor,cerivastatin,suppresses growth of maerophages expressing matrix metalloproteinases and tissue factor in vivo and in vitro[J].Circulation,2001,103:276-283.
[4] Schwartz GG,Olsson AG,Ezekowitz MD,et al.Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes:the MIRACL study:a randomized controlled trial[J].JAMA,2001,285:1711-1718.
[5] 余其振.他汀类药物调脂治疗冠状动脉粥样硬化性心脏病39例[J].河北医学,2012,18(12):150-152.
[6] Bustos C,Hernandez-Presa MA,Ortego M,et a1.HMGCoA reductase inhibition by atorvastatin reduces neointimal inflammation in a rabbit model of artherosclerosis[J].Am Coll Cardiol,1998,32:2057-2060.
[7] 张霞,曹艳君,张红雨.阿托伐他汀对冠脉介入治疗术后内皮功能不全的干预研究[J].河北医学,2010,16(12):43-45.
[8] 陈元立,刘宗亮.急性冠脉综合征早期应用阿托伐他汀临床观察[J].赣南医学院学报,2007,27(3):435-436.