手性记忆策略在α-氨基酸不对称烷基化反应中的研究进展
刘 洋,黄龙江,滕大为
(青岛科技大学化工学院,山东 青岛266042)
非天然的手性α-烷基化α-氨基酸是具有重要用途的一类物质,它们不仅是合成很多活性天然产物的重要砌块单元[1],同时也是很多生物活性物质研究中的重要成员,尤其是在蛋白质组学和遗传基因工程研究中。由于引入了稳定的手性季碳原子,将会显著影响由其所形成的蛋白质的构象,从而决定了所形成蛋白质和多肽的性质[2-5],因此,手性α-烷基化α-氨基酸可以用于制备功能化的蛋白质和多肽,同时还可以用于研究酶及酶抑制剂等反应机理。
众所周知,手性氨基酸α位的烷基化过程要经历SP3碳原子转化为SP2碳原子,从而导致其发生消旋化,为了得到对映体过量的烷基化α-氨基酸,研究者采用了多种诱导控制手性的方法,如通过引入手性辅基、使用手性相转移催化剂[6]、形成刚性环[7]等提供手性环境,再与卤代烷反应从而得到对映体过量的氨基酸,但这些辅助基团在反应后要经历水解等手段处理,不符合绿色化学的发展方向。因此,寻找更绿色和原子经济性的不对称合成方法十分重要。近年来,随着烯醇化学的快速发展,人们发现在某些特殊的条件下不采用任何其它手性辅助条件,手性羰基类化合物在烷基化过程中仍然可以保持其手性,化学家们称之为“手性记忆”,手性记忆是指与羰基相邻的具有手性中心的α-碳原子在遇碱形成烯醇时具有短暂的轴手性,无论分子中是否含有其它手性中心,在后续反应中重新形成中心手性的现象[8]。手性记忆首次从烯醇化学中提出,迄今为止,烯醇化学也是手性记忆应用最为广泛的领域[9]。由于原子经济性高、方法简单,随着手性记忆策略的提出,其得到了快速的发展,尤其是由于氨基酸是非常易得的手性原料,因此手性记忆策略在手性α-氨基酸的不对称烷基化领域发展得更为充分和完善。对于具有光学活性的α-氨基酸的不对称烷基化反应,已有许多报道[10,11]。作者在此根据反应类型的不同综述了近些年来手性记忆策略在α-氨基酸不对称烷基化反应中的应用。
1 含多个手性中心的α-氨基酸进行不对称烷基化反应
Kawabata等[8]报道了含有2个手性碳原子的非对映异构体化合物1与化合物2的不对称烷基化反应(图1)。
化合物1与化合物2在C3有相同的手性构型、在C2有不同的手性构型,在相同的条件下进行烷基化反应可得到非对映异构体化合物5(93%d.e.)和化合物6(86%d.e.)。由此可见,C2对反应产物的构型起到控制作用,如果在形成烯醇中间体4时,C2的手性丢失,那么化合物1和化合物2在进行烷基化时可得到相同构型的产物。表明邻位手性碳原子对α-氨基酸烷基化反应无影响。此结论也印证了其它永久的手性原子存在对手性记忆无影响。
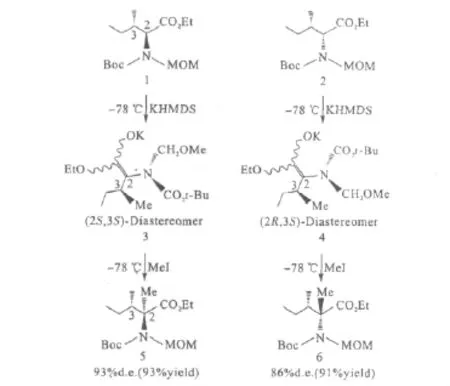
图1 含2个手性中心的α-氨基酸进行不对称烷基化反应Fig.1 Asymmetric alkylation reaction ofα-amino acids containing two chiral centers
2 含不同N原子保护基的手性α-氨基酸进行不对称烷基化反应
与羰基相连且具有手性的α-碳原子遇碱时SP3杂化四面体构型的手性碳原子形成SP2杂化的平面构型,形成的烯醇手性会丢失,即便是采用手性酮类化合物通过亲电试剂进攻烯醇也会得到消旋产物(图2)。而氨基酸由于N原子上的保护基的作用会保持动力学手性。
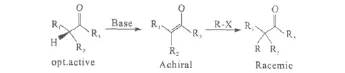
图2 与羰基相连的手性α-碳进行不对称烷基化反应Fig.2 Asymmetric alkylation reaction ofα-carbon adjacent to the carbonyl
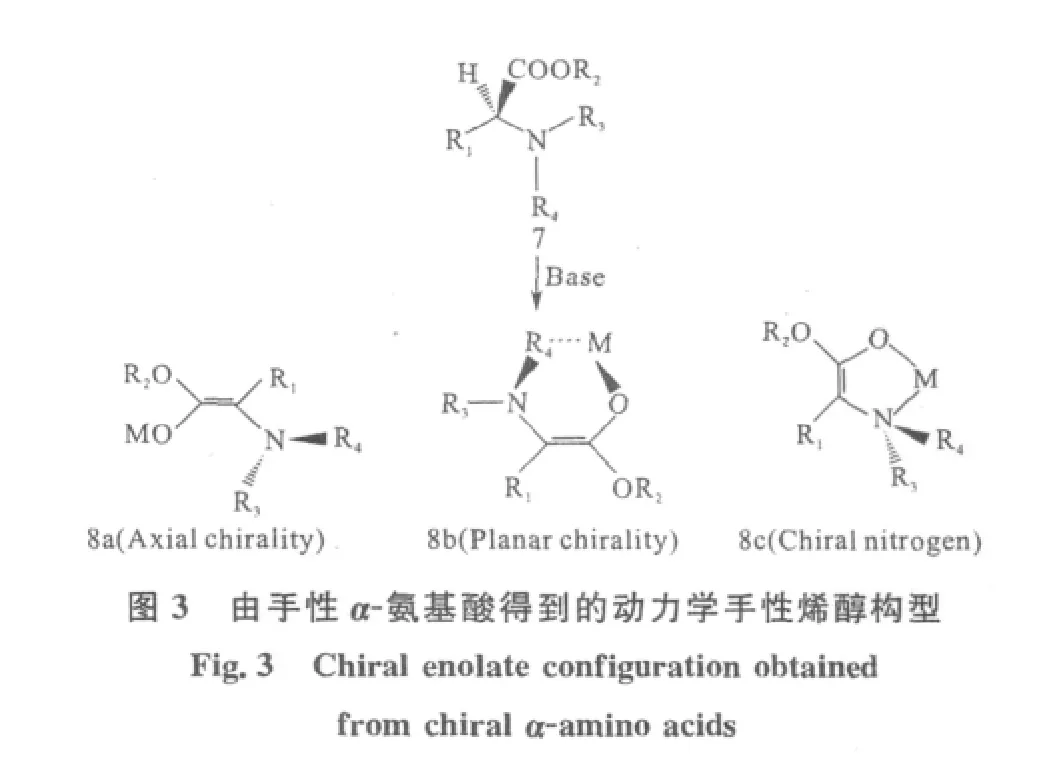
Fuji等[12]报道氨基酸7与碱反应可生成烯醇中间体8(图3)。化合物8a具有C-N轴形成的轴手性;化合物8b是由烯醇平面和金属原子M与N取代相互协调形成的平面手性;化合物8c具有手性N原子中心。大部分的α-氨基酸在进行不对称烷基化反应时,主要是形成化合物8a轴手性烯醇,为后续的手性记忆反应奠定基础。
Kawabata等[13]报道当α-氨基酸的取代基 R3=R4时,在最终的烷基化取代产物中将会得到消旋产物。因为此时形成的烯醇8a将不再具有轴手性。因此选择合适的N保护基是十分重要的[14-16]。化合物9、10(图4)进行烷基化后将会得到消旋的产物。
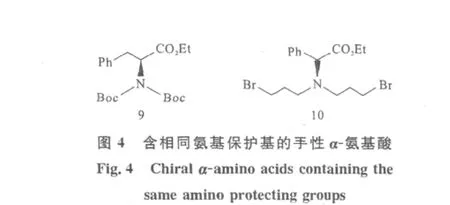
Kawabata等[17]报道在α-氨基酸进行分子内烷基化时引入叔丁氧羰基(Boc)保护基团十分重要。在氨基酸中引入Boc不仅可以起到对氨基的保护作用,而且还能保持原氨基酸的手性纯度大于99%。化合物11中引入Boc保护基团可起到对氨基的保护作用,而且不会降低化合物的对映体纯度(图5)。为后续的不对称烷基化反应奠定了基础。
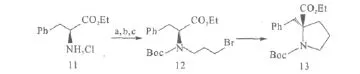
图5 含Boc保护基的手性α-氨基酸进行分子内烷基化反应Fig.5 Intramolecular alkylation reaction of chiral α-amino acids containing N-Boc
烯醇的寿命十分短暂,不能为后续的烷基化反应提供足够的时间,所以选择合适的取代基十分重要。Fuji等[12]报道选择合适的 R1、R2、R3、R4可延长烯醇中间体的寿命。
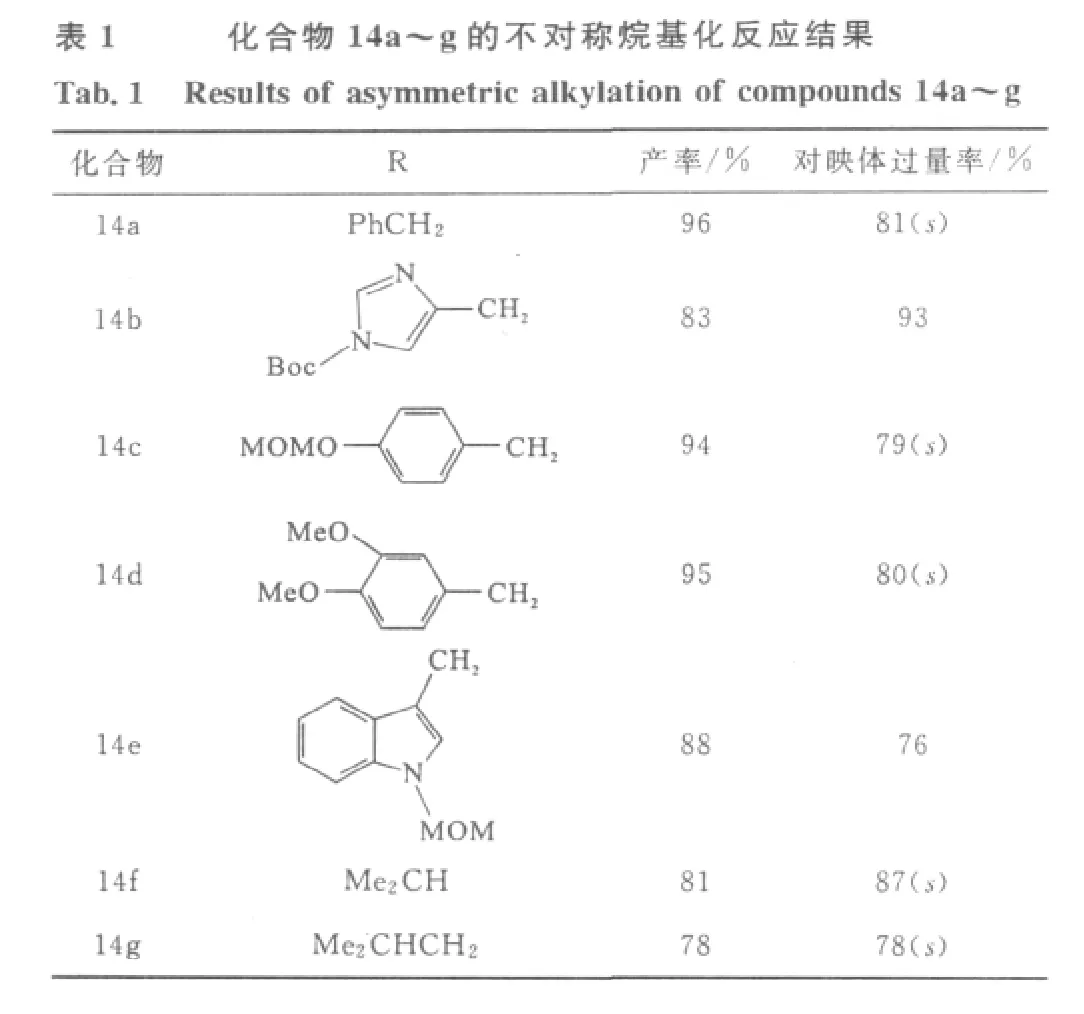
Zhao等[9]发现了较优的氨基保护基 N-Boc、NMOM。氨基酸在Boc和MOM保护下的不对称烷基化产率为78%~96%、对映体过量率为76%~93%。这两个保护基团不仅提供了较好的产率和对映体选择性,而且非常容易除去(图6、表1)。

3 α-氨基酸的分子内烷基化反应
3.1 β-烷氧基-α-氨基酸分子内烷基化反应
Moriyama等[18]研究发现,β-烷氧基-α-氨基酸在进行不对称烷基化反应时β-消除反应与α-烷基化反应相互竞争进行(图7)。当以KOH/DMSO体系为碱时,产生的烯醇活性较高,使得K1>K2,反应以烷基化为主。
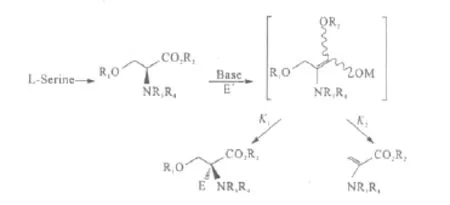
图7 β-烷氧基-α-氨基酸的不对称烷基化反应Fig.7 Asymmetric alkylation ofβ-alkoxy-α-amino acids
作者将此合成方法首次应用于四氢呋喃类氨基酸的合成中(图8),以化合物16为原料,在KOH/DMSO碱体系中于20℃进行不对称烷基化反应合成手性四氢呋喃氨基酸17(81%e.e.,产率58%)。
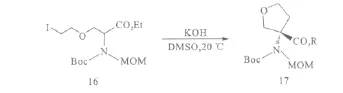
图8 不对称烷基化反应合成手性四氢呋喃氨基酸Fig.8 Synthesis of chiral tetrahydrofuran amino acids via asymmetric alkylation
Eyring报道轴手性烯醇化合物的消旋能垒为16 K·mol-1时,在25℃下仅0.03s就可消旋,而使用KOH/DMSO碱体系在20℃可迅速进行烷基化反应避免消旋,而且可得到较高的对映体选择性,优于其它体系[19]。
3.2 通过不对称烷基化合成4-羟基-α-甲基脯氨酸
Kolaczkowski等[20]采用不对称烷基化方法合成4-羟基-α-甲基脯氨酸(图9)。首先通过手性中间体18合成主要构型为(2R,4S)的化合物19;以中间体21进行手性记忆合成(2R,4R)构型时却意外得到化合物22与23(1∶1);将化合物21的羟基保护基换作MOM,相同反应条件下可得到主产物(2R,4R)。作者认为较小的羟基保护基可降低原子的拥挤程度,使目标构型的比例增大。
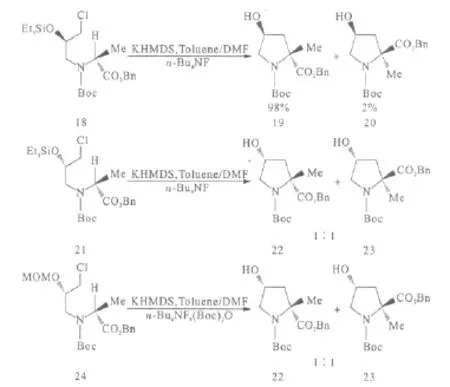
图9 通过手性记忆合成化合物19、22、23Fig.9 Synthesis of compounds 19,22,23 by memory of chirality
4 结语
通过不对称合成非天然α-氨基酸来模拟蛋白质、多肽的功能,是近些年基因工程和医药领域的研究热点。手性记忆策略是不对称合成领域的重大发现,它使氨基酸的不对称合成不仅更易于实现,而且原子经济性高,随着对其研究的不断深入,其应用领域将会越来越广泛。
[1]Cheng H,Keitz P,Jones J B.Design and synthesis of a conformationally restricted cysteine protease inhibitor[J].Journal of Organic Chemistry,1994,59(25):7671-7676.
[2]Balaram P.Non-standard amino acids in peptide design and protein engineering[J].Current Opinion in Structural Biology,1992,2(6):845-851.
[3]Giannis A,Kolter T.Peptidmimetica für rezeptorliganden-entdeckung,entwicklung und medizinische perspektiven[J].Angewandte Chemie,1993,105(9):1303-1326.
[4]Burgess K,Ho K K,Pal B.Comparison of the effects of(2S,3S)-2,3-methanomethionine,(2R,3R)-2,3-methanomethionine,and(2R,3R)-2,3-methanophenylalanine on the conformations of small peptides[J].Journal of the American Chemical Society,1995,117(13):3808-3819.
[5]Paradisi M P,Torrini I,Zecchini G P,et al.γ-Turn conformation induced byα,α-disubstituted amino acids with a cyclic six-membered side chain[J].Tetrahedron,1995,51(8):2379-2386.
[6]钟益宁,崔建国.α-氨基酸的不对称C-烷基化[J].化工技术与开发,2007,36(4):15-21.
[7]李振江,万红贵,韦萍,等.手性辅基法不对称合成特殊结构α-氨基酸——甘氨酸等当体途径[J].有机化学,2005,25(8):881-892.
[8]Kawabata T,Yahiro K,Fuji K.Memory of chirality:Enantioselective alkylation reactions at an asymmetric carbon adjacent to a carbonyl group[J].Journal of the American Chemical Society,1991,113(25):9694-9696.
[9]Zhao H W,Hsu D C,Carlier P R.Memory of chirality:An emerging strategy for asymmetric synthesis[J].Journal of Synthetic Organic Chemistry,2005,(1):1-15.
[10]Shioiri T,Arai S.Stimulating Concepts in Chemistry[M].New York:Wily-VHC Weinheim,2000:123-124.
[11]Ooi T,Uematsu Y,Kameda M,et al.Conformationally flexible,chiral quaternary ammonium bromides for asymmetric phasetransfer catalysis[J].Angewandte Chemie International Edition,2002,41(9):1551-1554.
[12]Fuji K,Kawabata T.Memory of chirality:A new principle in enolate chemistry[J].Chemistry.A European Journal,1998,4(3):373-376.
[13]Kawabata T,Matsuda S,Kawakami S,et al.Stereochemical diversity in asymmetric cyclization via memory of chirality[J].Journal of the American Chemical Society,2006,128(48):15394-15395.
[14]Kawabata T,Wirth T,Yahiro K,et al.Direct asymmetricα-alkylation of phenylalanine derivatives using no external chiral sources[J].Journal of the American Chemical Society,1994,116(23):10809-10810.
[15]Kawabata T,Suzuki H,Nagae Y,et al.A chiral nonracemic enolate with dynamic axial chirality:Direct asymmetricα-methylation ofα-amino acid derivatives[J].Angewandte Chemie International Edition,2000,39(12):2155-2157.
[16]Kawabata T,Chen J,Suzuki H,et al.Memory of chirality in diastereoselectiveα-alkylation of isoleucine and allo-isoleucine derivatives[J].Organic Letters,2000,2(24):3883-3885.
[17]Kawabata T,Kawakami S,Majumdar S.Asymmetric cyclization via memory of chirality:A concise access to cyclic amino acids with a quaternary stereoceneter[J].Journal of the American Chemical Society,2003,125(43):13012-13013.
[18]Moriyama K,Sakai H,Kawabata T.Direct asymmetric intramolecular allkylation ofβ-alkoxy-α-amino esters via memory of chirality[J].Org Lett,2008,10(17):3883-3886.
[19]Kawabata T,Moriyama K,Kawakami S,et al.Powdered KOH in DMSO:An efficient base for asymmetric cyclization via memory of chirality at ambient temperature[J].Journal of the American Chemical Society,2008,130(12):4153-4157.
[20]Kolaczkowski L,Barnes D M.A memory of chirality approach to the stereoselective synthesis of 4-hydroxy-α-methylprolines[J].Org Lett,2007,9(16):3029-3032.

