L-抗坏血酸没食子酸酯的酶催化合成及抗氧化性
范广璞,刘菊香,刘长春
(江苏食品药品职业技术学院生物与化学工程学院,江苏 淮安,223003)
没食子酸(GA)广泛存在于葡萄、茶叶、五倍花、刺云实豆荚等植物中,具有抗菌、抗病毒、抗肿瘤的药理作用和较强的抗氧化作用[1-3],主要用于食品、医药、有机合成等领域。没食子酸酯类化合物具有优良的抗氧化性能[4],其中没食子酸丙脂经FAO/WHO组织批准已用作食品抗氧化剂,其抗氧化性能较BHT(二丁基羟基甲醚)和BHA (丁基羟基茴香醚)等强,耐热性好,广泛用于肉腌制品、罐头制品、鱼类制品、饼干、糕点、油脂以及油炸食品等。
L-抗坏血酸(LAA)是一种具有抗氧化作用的水溶性维生素,可用作食品的抗氧化剂、护色剂等,但是其水溶性限制了它在油脂行业中的应用。L-抗坏血酸酯不仅保持了L-抗坏血酸的抗氧化性能和生理活性,而且在非水体系中的溶解性和稳定性均有显著提高,增加了对自由基的清除能力,已经成为一种高效、安全、无毒的抗氧化剂[5]。L-抗坏血酸酯主要通过化学法和酶法合成。化学法合成是在浓硫酸、SO42- /ZrO2等催化剂作用下将L-抗坏血酸和羧酸或羧酸酯经直接酯化或酯交换得到L-抗坏血酸酯[6-8],反应产率低,环境污染严重。酶法合成则是采用脂肪酶作催化剂合成L-抗坏血酸酯[9-11],反应条件温和,产物选择性高,安全无毒。根据没食子酸的抗菌性能和较强的抗氧化作用,我们将没食子酸活性结构单元引入L-抗坏血酸分子中,采用脂肪酶催化合成具有良好脂溶性的L-抗坏血酸没食子酸酯,并考察了其抗氧化性能,希望获得一种兼具抑菌活性和抗氧化活性的多功能食品添加剂。
1 材料与方法
1.1 原料
没食子酸、L-抗坏血酸、4Å 分子筛,上海国药集团化学试剂有限公司;固定化脂肪酶Novozym435,诺维信(中国)生物技术有限公司;其他所用试剂均为市售分析纯或化学纯。
1.2 主要仪器设备
Nicolet 5-DX 红外光谱仪,KBr 压片,美国Nicolet公司;AVANCE 400 核磁共振仪,TMS 作内标,CDCl3作溶剂,瑞士Bruker 公司;X-4 型显微熔点仪,北京泰克仪器有限公司;722S 型分光光度计,上海精密科学仪器有限公司。
1.3 实验方法
1.3.1 L-抗坏血酸没食子酸酯的合成
1.3.1.1 合成方法
将没食子酸1.7 g (10 mmol)、L-抗坏血酸3.5 g(20 mmol)、环己酮20 mL 和固定化脂肪酶Novozym435 0.25 g 依次加入三口烧瓶中,水浴加热至50 ℃,搅拌反应12 h 后,加入4Å 分子筛15 mg 继续反应12 h。冷却至室温,过滤,滤液用饱和食盐水洗涤(10 mL×3),减压蒸馏除去溶剂,残留物用环己烷重结晶,得到白色固体L-抗坏血酸没食子酸酯,m. p.155 ~157 ℃。1H NMR(CDCl3)δ:3.55(s,1H,OH),4.28 ~4.53(m,3H,OCH2,OCH),5.01(d,1H,COOCH),5.38(s,3H,ArOH),6.95 (s,2H,ArH),11.06(s,2H,= COH);IR(KBr,cm-1)υ:3370,2955,1713,1648,1451,1169。
1.3.1.2 反应条件的确定
(1)反应溶剂:在没食子酸10 mmol、L-抗坏血酸20 mmol、脂肪酶0.25 g、50 ℃反应24 h 的条件下,分别以甲苯(toluene)、氯仿(chloroform)、叔丁醇(tertbutyl alcohol)、叔戊醇(tert-pentyl alcohol)和环己酮(cyclohexanone)作溶剂,按1.3.1.1 中方法进行试验。
(2)反应物用量:在没食子酸10 mmol、脂肪酶0.25 g、环己酮20 mL、50 ℃反应24 h 的条件下,改变L-抗坏血酸用量为10、15、20、25 mmol,按1.3.1.1 中方法进行试验。
(3)脂肪酶用量:在没食子酸10 mmol、L-抗坏血酸20 mmol、环己酮20 mL、50 ℃反应24 h 的条件下,改变脂肪酶用量为0.15、0.20、0.25、0.30 g,按
1.3.1.1 中方法进行试验。
(4)反应温度:在没食子酸10 mmol、L-抗坏血酸20 mmol、脂肪酶0.25 g、环己酮20 mL、反应24 h 的条件下,改变反应温度为30、40、50、60 ℃,按
1.3.1.1 中方法进行试验。
(5)反应时间:在没食子酸10 mmol、L-抗坏血酸20 mmol、脂肪酶0.25 g、环己酮20 mL、50 ℃的条件下,改变反应时间为12、18、24、30、36 h,按1.3.1.1中方法进行试验。
1.3.2 抗氧化性能的测定
按文献[12]测定L-抗坏血酸没食子酸酯对羟基自由基和DPPH 自由基的清除活性,并与L-抗坏血酸的清除活性进行比较。
1.3.2.1 清除DPPH 自由基活性测定
将样品用无水乙醇配制成浓度为1.0 mmol/L 溶液,分别吸取10、20、40、60、80、100 μL 加入1.5 mL离心管中,用无水乙醇稀释至650 μL,混合均匀后加入0.16 mmol/L DPPH 无水乙醇溶液350 μL,放置30 min,用1 cm 比色皿于517 nm 处测量各样品溶液(浓度分别为10、20、40、60、80、100 μmol/L)的吸光度(A)。以不含样品的溶液为空白,根据测得的吸光度(A)按下式计算目标化合物对DPHH 自由基的清除率,平行测定3 次,计算平均值和标准偏差。按同样方法测定L-抗坏血酸对DPHH 自由基的清除率。
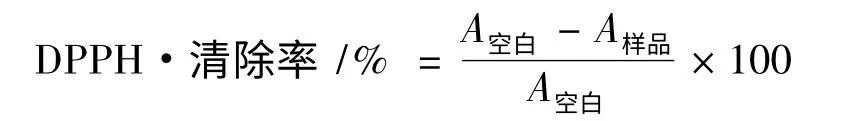
1.3.2.2 清除羟基自由基活性测定
将样品用无水乙醇配制成浓度为50 mmol/L 溶液,然后在1.5 mL 离心管中加入7.5 mmol/L 邻二氮菲无水乙醇溶液100 μL,7.5 mmo l/L FeSO4水溶液100 μL,样品溶液分别取20、40、80、120、160、200 μL,体积分数0.1% 的H2O2溶液100 μL,用0.05 mol/L 磷酸盐缓冲液(pH =7.4)稀释至1.0 mL。在37 ℃下保温1 h,用1 cm 比色皿于536 nm 处测定各样品溶液(浓度分别为1、2、4、6、8、10 mmol/L)的吸光度(A)。以不含样品的溶液为对照,不含样品和H2O2的溶液为空白,根据测得的吸光度(A)计算目标化合物对羟基自由基的清除率,平行测定3 次,计算平均值和标准偏差。按同样方法测定L-抗坏血酸对羟基自由基的清除率。

2 结果与讨论
2.1 L-抗坏血酸没食子酸酯的合成
在不同的有机溶剂中脂肪酶的活力差别很大,由于亲水性的有机溶剂会夺取酶周围微环境的必需水,导致脂肪酶失活,从而不利于反应的进行,所以使用疏水性的有机溶剂较好。不同有机溶剂对非水介质中脂肪酶Novozym 435 催化合成L-抗坏血酸没食子酸酯的影响结果见表1。由表1 可知,脂肪酶Novozyme 435 在环己酮反应介质中有很好的催化活性,所以环己酮是酶催化合成L-抗坏血酸没食子酸酯的最适合有机溶剂。环己酮的用量为20 mL 时,没食子酸的转化率达到最高;环己酮的用量较少,反应中生成的水对反应平衡和酶活性的影响较大,使没食子酸的转化率降低;而环己酮用量过多,没食子酸转化率稍有下降,且溶剂回收处理量大;因此环己酮的适宜用量为20 mL。

表1 溶剂的影响Table 1 Effect of solvent on the yield of conversion rate of gallic acid
图1 反映了反应物用量对没食子酸转化率的影响。可以看出,使用过量的L-抗坏血酸有利于反应的进行,随着L-抗坏血酸用量的增加,没食子酸的转化率逐渐增加,但是当L-抗坏血酸用量增加到20 mmol 后,没食子酸的转化率无显著增加。
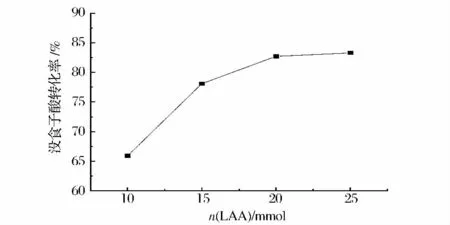
图1 反应物用量对没食子酸转化率的影响Fig.1 Effect of reactant amount on the conversion rate of gallic acid
图2 为脂肪酶用量对没食子酸转化率的影响。由图2 可知,增加脂肪酶的用量可以增加催化活性中心,使反应速度加快,没食子酸的转化率得以提高。当催化剂用量大于0.25 g,可能是过多的酶使反应初始生成的水量增多,不利于反应的进行,同时过多的水还会导致酶失活,使没食子酸的转化率稍有降低。

图2 脂肪酶用量对没食子酸转化率的影响Fig.2 Effect of lipase amount on the conversion rate of gallic acid
反应温度对没食子酸转化率的影响见图3。从图3 可以看出,反应温度对反应的影响较大。反应温度过低,反应不能进行完全,没食子酸的转化率较低。反应温度过高,由于L-抗坏血酸不稳定易氧化,使没食子酸的转化率下降。所以,适宜反应温度为50 ℃。
图4 为没食子酸转化率随反应时间的变化情况。可以看出,延长反应时间有利于酶催化反应进行完全,没食子酸的转化率不断增加。当反应时间达到24 h 后,继续延长反应时间,没食子酸的转化率无明显变化。
2.2 抗氧化活性
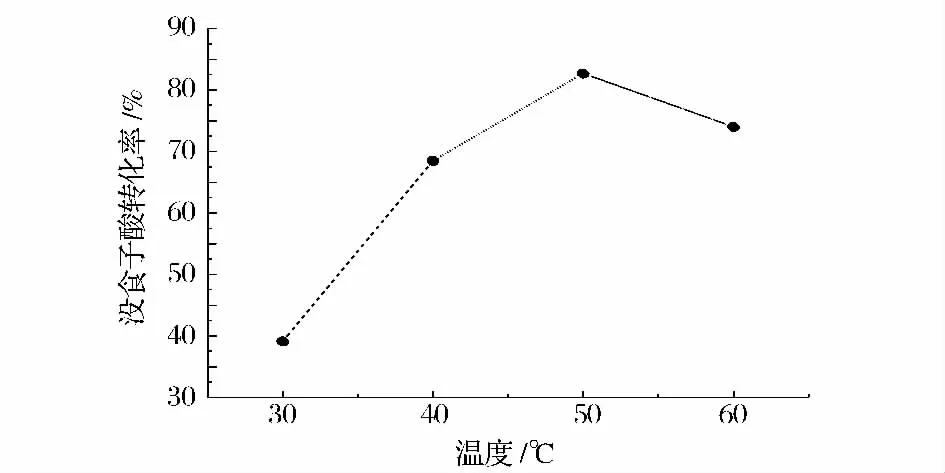
图3 反应温度对没食子酸转化率的影响Fig.3 Effect of reaction temperature on the conversion rate of gallic acid

图4 反应时间对没食子酸转化率的影响Fig.4 Effect of reaction time on the conversion rate of gallic acid
将L-抗坏血酸没食子酸酯配制成不同的浓度,测定其对DPPH 自由基和羟基自由基的清除活性,并与L-抗坏血酸进行比较,结果见图5 和图6。结果表明,随着样品浓度的增加,DPPH 自由基和羟基自由基的清除率均明显增加。L-抗坏血酸没食子酸酯浓度为60 μmol/L 时,对DPPH 自由基的清除率为90.3%。L-抗坏血酸没食子酸酯浓度为8 mmol/L时,对羟基自由基的清除率为92.8%。

图5 L-抗坏血酸没食子酸酯对DPPH 自由基的清除活性Fig.5 DPPH radical scavenging activity of L-ascorbyl gallate
应用Excel 处理实验数据,得到试验样品清除DPPH 自由基和羟基自由基的模拟方程如下:
L-抗坏血酸没食子酸酯清除DPPH 自由基的模拟方程为:

图6 L-抗坏血酸没食子酸酯对羟基自由基的清除活性Fig.6 Hydroxyl radical scavenging activity of L-ascorbyl gallate
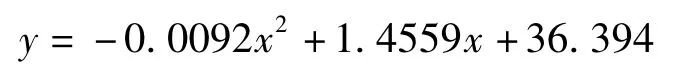
式中:y 为清除率,%;x 为浓度,μmol/L。R2=0.9817,计算得IC50=9.97 μmol/L。
L-抗坏血酸清除DPPH 自由基的模拟方程为:
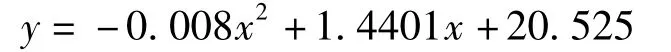
式中:y 为清除率,%;x 为浓度,μmol/L。R2=0.9807,计算得IC50=23.55 μmol/L。
L-抗坏血酸没食子酸酯清除羟基自由基的模拟方程为:
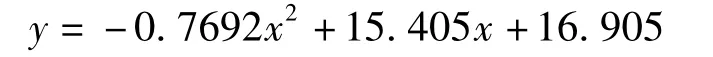
式中:y 为清除率,%;x 为浓度,mmol/L。R2=0.9956,计算得IC50=2.45 mmol/L。
L-抗坏血酸清除羟基自由基的模拟方程为:

式中:y 为清除率,%;x 为浓度,mmol/L。R2=0.9951,计算得IC50=5.14 mmol/L。
从试验样品清除DPPH 自由基和羟基自由基的IC50数据可知,L-抗坏血酸没食子酸酯具有优良的抗氧化活性,能有效清除DPPH 自由基和羟基自由基,清除效果明显好于对照样品L-抗坏血酸,清除DPPH自由基能力比清除羟基自由基强。
3 结论
在固定化脂肪酶Novozym 435 催化下没食子酸和L-抗坏血酸直接酯化合成了L-抗坏血酸没食子酸酯,成功地将没食子酸与L-抗坏血酸两个活性结构单元结合在一起。反应条件温和,产物选择性高,安全无毒,开发了一种合成新型食品添加剂的新方法。抗氧化性测试结果表明,L-抗坏血酸没食子酸酯可以有效清除DPPH 自由基和羟基自由基,清除效果明显好于L-抗坏血酸,L-抗坏血酸没食子酸酯清除DPPH自由基和羟基自由基的IC50分别为9.97 μmol/L 和2.45 mmol/L,L-抗坏血酸清除DPPH 自由基和羟基自由基的IC50分别为23.55 μmol/L 和5.14 mmol/L。因此,L-抗坏血酸没食子酸酯是一种潜在的多功能食品添加剂。
[1] Reddy T C,Reddy D B,Aparna A,et al. Anti-leukemic effects of gallic acid on human leukemia K562 cells:Downregulation of COX-2,inhibition of BCR/ABL kinase and NF-κB inactivation[J]. Toxicology in Vitro,2012,26(3):396 -405.
[2] Roberto D G.,Remigio L S,Elías O S,et al. Comparative antibacterial effect of gallic acid and catechin against Helicobacter pylori[J]. LWT-Food Science and Technology,2013,54(2):331 -335.
[3] Mansouri M T,Farbood Y,Sameri M J,et al. Neuroprotective effects of oral gallic acid against oxidative stress induced by 6-hydroxydopamine in rats[J]. Food Chemistry,2013,138(2 -3):1 028 -1 033.
[4] Zhong Y,Ma C M,Shahidi F. Antioxidant and antiviral activities of lipophilic epigallocatechin gallate (EGCG)derivatives[J]. Journal of Functional Foods,2012,4(1):87 -93.
[5] Kim T S,Decker E A,Lee J. Antioxidant capacities of αtocopherol,trolox,ascorbic acid,and ascorbyl palmitate in riboflavin photosensitized oil-in-water emulsions[J]. Food Chemistry,2012,133(1):68 -75.
[6] 何莉斌,宁正祥,李娜. 甲氧羰基丙烯酸-6-L-抗坏血酸酯的合成及抗氧化活性研究[J]. 食品工业科技,2009,30(2):265 -267.
[7] 吴亚凉,宁正祥. 反丁烯二酸-6-L-抗坏血酸甲酯的合成及抑菌性能的研究[J]. 食品与发酵工业,2009,35(9):58 -61.
[8] 刘菊香,范广璞,刘长春. 咖啡酸维生素C 酯的合成、抑菌活性和抗氧化性研究[J]. 食品工业科技,2012,33(19):218 -221.
[9] Zhao H Z,Zhang Y,Lu F X,et al. Optimized enzymatic synthesis of ascorbyl esters from lard using Novozym 435 in co-solvent mixtures[J]. Journal of Molecular Catalysis B:Enzymatic,2011,69(3 -4):107 -111.
[10] Bezbradica D,Stojanovic M,Velickovic D,et al. Kinetic model of lipase-catalyzed conversion of ascorbic acid and oleic acid to liposoluble vitamin C ester[J]. Biochemical Engineering Journal,2013,71:89 -96.
[11] Moreno-Perez S,Filice M,Guisan J M,et al. Synthesis of ascorbyl oleate by transesterification of olive oil with ascorbic acid in polar organic media catalyzed by immobilized lipases [J]. Chemistry and Physics of Lipids,2013,174:48 -54.
[12] 巫晓琴,乔薇,闫素君,等. L-抗坏血酸-6-对羟基苯甲酸酯的合成及抗氧化活性研究[J]. 中山大学学报(自然科学版),2007,46(4):59 -62.

