载脂蛋白AV水平及-1131T>C基因多态性与脑梗死
许 綪, 肖志杰, 朱元凯
载脂蛋白AV(apolipoprotein AV,apoAV)基因是由两个课题组在2001年通过不同的方法[1,2]在人类染色体IIq23的载脂蛋白基因簇(APOA 1/C3/A4)内同时发现的。ApoAV分子及其基因多态性在体内血脂代谢,特别是甘油三酯(triglyceride,TG)的代谢过程中起着关键作用[3,4]。并有多项研究[5,6]认为血清apoAV水平及其基因变异与代谢综合征明显相关。ApoAV可能与C反应蛋白(Creactive protein,CRP)相似,是一种潜在的炎症因子和急性期反应蛋白(acutephase reactive protein,ARP)[7]。
随着我国人口的老龄化,脑梗死的发病率呈逐年上升的趋势,给社会、家庭带来了沉重的负担。其中脑血栓形成是脑梗死最常见的类型,约占全部脑梗死的60%以上,其主要病理基础是动脉粥样硬化。动脉粥样硬化的主要病理机制是血脂代谢异常[8]和炎症反应[9,10]。ApoAV 对血脂代谢和炎症反应均有影响,因此认为apoAV可能具有血管保护作用,减少动脉粥样硬化相关血管病变(如冠心病、脑卒中等)发生和发展的重要意义。
自从2001年发现apoAV并证实其参与血脂代谢的调节以来,已对 apoAV基因多态性与血脂[11,12]、代谢综合征[5,6]和冠心病[13,14]的关系进行了大量的研究,而对于apoAV-1131 T>C基因多态性与脑梗死之间关系的研究目前还很少。我们通过病例一对照研究比较血清apoAV水平及其与TG的关系在脑梗死患者和正常人群之间的差异,并动态观察脑梗死急性期血清apoAV水平的变化。观察apoAV-1131 T>C基因多态性在脑梗死患者及正常对照人群中的分布差异,并探讨apoAV-1131 T>C基因多态性与血清apoAV水平、TG水平及脑梗死之间的关系。
1 材料与方法
1.1 研究对象
1.1.1 病例组 急性期脑梗死患者组研究对象来自湘雅二医院急诊科及神经内科住院患者,均符合“第四届脑血管病会议的脑血管疾病诊断要点”[17]所确定的缺血性脑卒中的诊断标准,并经头部CT和/或MRI证实,病程均小于1d。共入选123例,男性67例,女性56例,平均年龄 61.6±10.8岁。病例组患者,在入院时均应用美国国立卫生院卒中量表(NIHSS)进行神经功能评分,并采用TOAST分型标准对脑梗死患者进行分型。
1.1.2 对照组 正常对照组为同期湘雅二医院常规体检者。纳入标准:与病例对照组进行年龄、性别匹配,经询问病史,大部分经过CT和/或MRI证实无脑卒中。共入选113例,男性54例,女性59例,平均年龄63.4±11.8岁。两组均常规心电图,胸片检查,必要时行颈部血管彩超和心脏彩超检查。
1.2 研究方法
1.2.1 血生化指标测定
入院后第2天清晨空腹采集外周静脉血,血清TC和TG采用酶法测定,HDL-C和LDL-C采用化学遮蔽法直接测定,同时检测空腹血糖(fasting plasma glucose,FPG)、尿素氮(blood urea nitrogen,BUN)、肌酐(carnine,Cr)和丙氨酸转氨酶(alanine aminotransferase,ALT)。
1.2.2 血清apoAV水平测定 清晨空腹采集外周静脉血,血清apoAV水平采用双抗体夹心酶联免疫吸附试验(ELISA)法,共选取脑梗死急性期(2w内)4 个时间点:24h内、3d、7d及14d。
1.2.3 氯仿法抽提外周血白细胞基因组DNA。
1.2.4 多聚酶链式反应-限制性片段长度多态性测定检测apoAV-1131 T>C基因。
1.3 DNA测序 将apoAV-113T1>C的TT基因型和CC基因型PCR扩增产物进行DNA序列测定,由测序图谱可以看出,TT基因型中的碱基T突变为CC基因型中的C,这与酶切的结果一致,也与文献报道相符[1]。
1.4 统计分析 应用SPSS 13.0软件包进行统计分析。计量统计指标均进行正态性检验,计量资料两组间的比较采用独立样本t检验,两组以上采用单因素方差分析(One-way ANOVA),组间比较采用LSD法。各组间计数资料、基因型和等位基因频率分布比较采用χ2检验。非正态分布的变量间相关性分析采用Spearman等级相关分析。采用Logistic回归单变量分析,筛选出脑梗死的主要危险因素,选择逐步Logistic回归方法(Forward,LR法)筛选出独立危险因素,计算出比值比(odds ratio,OR)及95%可信区间(confidence intervals,CI)。以双侧P<0.05为具有统计学显著性差异。
2 结果
2.1 脑梗死组与对照组在年龄和性别构成上无显著差异(P>0.05),两组之间具有可比性。肝功能指标(ALT)、肾功能指标(BUN及Cr)和血脂指标中TC和LDL-C、apoAV水平在病例组与对照组间无明显差异(P>0.05)。而病例组TG及FPG水平较对照组明显升高(P<0.05及 P<0.01),HDL-C水平较对照组明显降低(P<0.01)。
2.2 血清apoAV水平与TG等生化指标的关系 分析显示血清apoAV水平与TG水平呈负相关(rs=-0.132,P <0.05),相关关系并不密切。血清apoAV 水平与 TC、HDL-C、LDL-C、FPG、BMI及血压水平间无相关关系(P>0.05)。分组后发现血清apoAV水平与TG水平的负相关关系在对照组中更加显著(rs=-0.212,P <0.05),而在病例组中两者无相关关系(P>0.05)。病例组中血清apoAV水平与脑梗死NIHSS评分间有呈正相关的趋势,但无统计学意义(rs=0.161,P >0.05)。
2.3 脑梗死急性期血清apoAV水平变化趋势对病例组脑梗死急性期2w内4个时间点(24h内、3d、7d及14d)进行血清apoAV水平检测,发现在第3天时血清apoAV水平达到高峰,3d及14d内有下降趋势(由各时间点的apoAV浓度平均值±标准差表示),但通过配对t检验分别对血清apoAV水平在4个时问点间进行两两比较,各时间点间差异无显著性(均P>0.05)。
2.4 病例组与对照组apOAV 1131 T>C基因型分布的比较 在研究总人群中apoAV-1131 T>C基因型的频率分布为:TT 41.9%、TC 41.9%、CC 16.1%。等位基因 T、C的频率分别为62.9%和37.1%(见表1)。在对照组和病例组中基因型均以TT型多见,TC型次之,而CC型较少见,其等位基因频率分布均以T等位基因为常见等位基因,C等位基因为少见等位基因。按Hardy-weinberg平衡定律对研究总人群进行了平衡检验,χ2=2.405,df=1,P>0.05,说明我们选择的研究总人群基因频率能够代表群体的基因分布。对组间apoAV-1131 T>C 3种基因型及等位基因分布比较进行卡方检验,两组间有显著性差异(P<0.05),病例组TC及CC基因型频率较对照组更高。
进一步比较C等位基因携带者(TC+CC)与TT纯合子基因型携带者在两组间的分布,差异更具有显著性(P <0.01),结果(见表2),apoAV 1131T >C基因型在TOAST分型各亚型间的分布无明显差异(P >0.05),结果(见表3)。
2.5 ApoAV-1131 T>C基因型与血清apoAV、TG等生化指标的关系 ApoAV-1131 C等位基因携带者TG水平较TT基因型明显升高(P<0.05),apoAV及其它血脂指标(TC、HDL-C及 LDL-C)水平,在两组间无明显差异(均P>0.05)。进一步分别对病例组及对照组中apoAV-1131 T>C各基因型间apoAV水平的差异进行分析,均未发现apoAV-1131 T>C基因多态性与apoAV水平相关(均P>0.05)(见表4、表5)。
2.6 脑梗死危险因素的多因素分析 采用logistic回归单变量分析,筛选出脑梗死的主要危险因素,进一步选择逐步logistic回归方法(Forward,LR法)筛选出独立危险因素。经单变量logistic回归选出的候选变量有:高压病史、糖尿病史、高血脂症史、心脏病史、吸烟史、卒中家族史、FPG、SBP、DBP、BMI、TG、HDL-C及apoAV-1131 C等位基因。然后将所有候选变量引入多因素logistic回归模型,得出脑梗死主要危险因素有高血压病史、apoAV-1131 C等位基因及FPG,而HDL-C具有保护作用。其中apoAV-1131 C 等位基因 OR=1.897,95%CI 1.029~3.499,P <0.05),结果(见表 6)。

表1 病例组与对照组apoAV-1131 T>C基因型分布的比较

表2 病例组与对照组apoAV-1131C等位基因携带者分布的比较
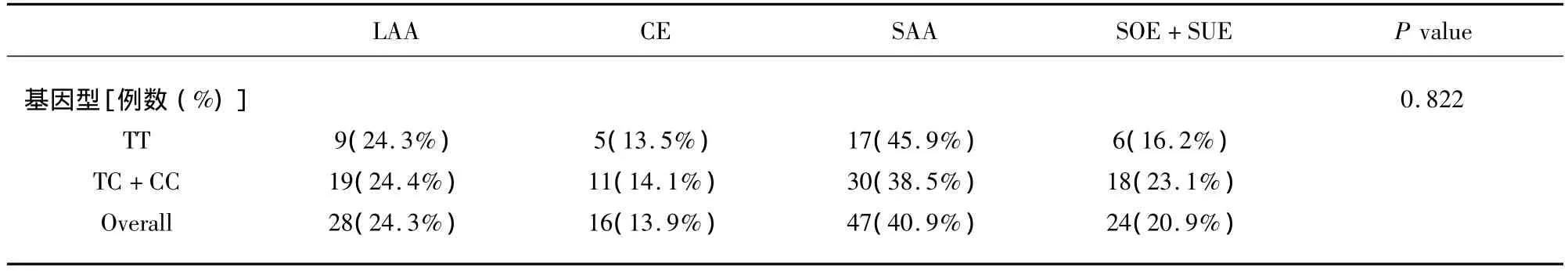
表3 apoAV-1131 T>C基因型在TOAST各亚型间的分布
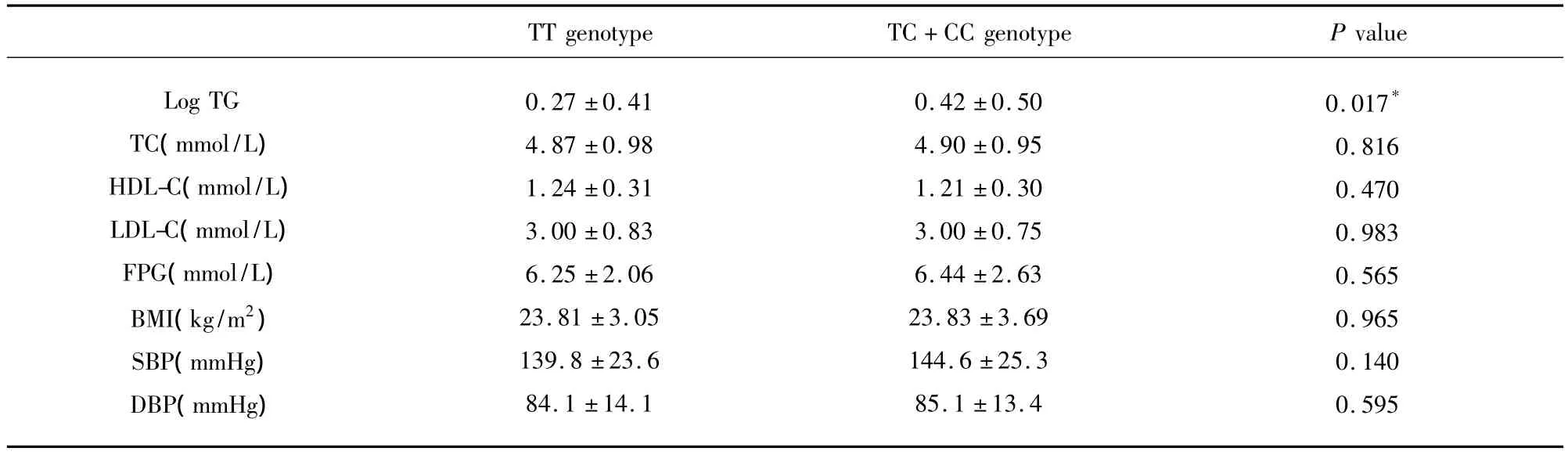
表4 apoAV-1131 T>C基因型与血清TG等指标关系

表5 apoAV-1131 T>C基因型与血清apoAV水平的关系

表6 脑梗死主要危险因素的多因素Logistic回归分析结果
3 讨论
3.1 血清apoAV水平与TG代谢 ApoAV蛋白分子与其他载脂蛋白的氨基酸序列相似,这提示apoAV 同样具有血脂运输功能[1]。Penneacchio等[1]实验发现与对照组相比,表达人apoAV的转基因小鼠血浆TG水平下降66%,而敲除apoAV基因的小鼠TG水平升高了4倍。但是这两种小鼠模型的TC和HDL-C的水平与对照组相比均没有明显差异。随后Vliet等[3]培育出过度表达鼠apoAV基因的小鼠。这种转基因小鼠血浆中的apoAV水平升高了近20倍,而血浆TG和TC浓度分别降低了70%和40%,其中HDL-C在胆固醇变化中降低幅度最大,从而导致血浆TC浓度降低。以上的动物试验表明apoAV对血浆TG水平有负性调节作用。
流行病学研究也得出了相似的结论。Ishihara等[15]通过ELISA技术对196名健康受试者和106名2型糖尿病患者血浆apoAV水平与血脂代谢之间的关系进行了研究。正常组中女性apoAV水平较男性更高。血浆apoAV水平与HDL-C呈正相关(r=0.32,P <0.0001),而与血浆 TG 水平呈负相关(r=-0.22,P=0.021)。另一项研究[16]也表明血清apoAV水平与TG水平呈负相关,并且在女性人群更显著(r=0.496,P=0.001)。本研究亦发现湖南汉族人群中血清apoAV水平与TG水平呈负相关(rs=-0.132,P=0.046),在正常人群中其相关性较研究总人群更显著(rs=0.212,P=0.024)。
但在另一项对2490个受试者的15年随访研究[17,18]则认为,不论是糖尿病患者或是正常人群中血浆apoAV水平均与TG水平呈正相关。ApoAV在TG代谢中起着关键作用,但TG水平尚受到其它因素的影响,如饮食结构、载脂蛋白CIII(apolipoprotein CIII,apoCIII)和脂蛋白酯酶(lipoprotein lipase,LPL)等。ApoAV调节TG代谢的作用机制尚未完全阐明,目前认为apoAV主要通过以下3个途径影响代谢:(1)阻碍肝脏中VLDL的装配,引起VLDL分泌减少[19];(2)LPL是 TG代谢中的关键酶,apoAV可能作为LPL的激活剂促进TG分解[20];(3)促进肝脏摄取脂质颗粒,增强VLDL与低密度脂蛋白受体(low density lipoprotein receptor,LDL-R)的亲和力[4,21]。
3.2 ApoAV与炎症、急性期反应 近来有研究认为在某些情况下,如机体存在急慢性炎症状态时apoAV可能并非起调节TG代谢的作用。Khovidhunkit[7]等发现经腹腔注射内毒素后,小鼠血浆中HDL中的apoAV和apoAIV水平升高,肝脏中apoAV基因mRNA表达水平亦增加,8h可达2~3倍,24h内持续升高,认为apoAV可能是一种正性ARP,在APR中并非起到调节脂质代谢的作用。但在Becker等[22]的研究中却发现人及小鼠在 APR时血浆apoAV和TG水平均是下降的(P<0.01)。通过对HepG2肿瘤细胞进行肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和白介素-1β(intelleukin 1β,IL-1β)的干预,apoAVmRNA表达分别下降为42%和55%(均 P<0.001)。他们认为这是由于 apoAVmRNA稳定性的改变而导致apoAV基因表达减少。虽然这两个试验对APR中apoAV水平变化的结果并不一致,但都认为apoAV并不像在其它研究中观察到的那样与TG水平呈负相关,提示此时apoAV可能并非作为TG调节因子而起作用。这也说明了APR状态下apoAV作用的复杂性,目前急慢性炎症状态下apoAV作用及机制的相关研究并不多,对于其生理学及病理生理学作用仍需进一步的深入研究。
对于脑梗死急性期apoAV与TG水平相关关系的研究国内外尚未见报道。本研究对脑梗死急性期及正常人群分别分析,发现血清中两者的关系在两个人群中有明显差异。血清apoAV水平与TG水平在脑梗死组无关(rs=0.036,P=0.703),而在正常人群中呈负相关(rs=-0.212,P=0.024)。脑梗死急性期(2w)内血清apoAV水平有非显著性动态变化,虽然各时间点间血清apoAV水平的差异无统计学意义,但有在3d时达到高峰,7~14d逐渐下降的趋势。此点与脑梗死急性期病情发展、变化的趋势基本一致。脑梗死急性期,apoAV可能作为一种急性期反应蛋白起作用,而与TG代谢无关。仍需要进一步更加严谨、更大样本量的研究明确apoAV在脑梗死急性期中的角色。
3.3 血清apoAV、TG水平与脑梗死 动脉粥样硬化的主要病理机制是血脂代谢异常[8]和炎症反应[9,10]。而ApoAV在TG代谢中起着重要的调节作用,并且可能与CRP相似,是潜在的一种急性期反应蛋白和炎症因子。因此可以推测apoAV可能具有血管保护作用,能够减少动脉粥样硬化及其相关血管病变(冠心病、脑卒中等)的发生和发展。此点己通过动物实验得到证实[2,23],载脂蛋白 E基因敲除小鼠将引起血脂代谢障碍,通过转基因技术使其表达人apoAV分子。发现人apoAV的表达可以显著降低此种动物模型中血浆TG水平,并且能够延缓动脉粥样硬化病变的发生和发展。进一步对这种基因缺陷小鼠进行过氧化物酶体增生物激活受体-α(peroxisome proliferator-activated receptor-α,PPAR-α)受体激动剂的干预,能进一步加强其血管保护作用。遗憾的是目前尚未见报道对血浆/血清apoAV水平与脑梗死之间的关系进行研究。
本研究为病例对照研究,病例组与对照组间血清apoAV水平无明显差异。对脑梗死患者进行TOAST分型,各亚型间血清apoAV水平亦未见明显差异。对于血清apoAV水平与脑梗死NIHSS评分相关性分析显示两者虽有正相关的趋势,但无统计学意义(rs=0.161,P=0.108)。ApoAV 作用的复杂性及脑梗死病因和分型的复杂性可能影响apoAV与脑梗死之间关系的分析。另一方面,apoAV与脑梗死关系的不明确也可能与TG代谢和脑梗死的关系尚未完全明确有关[24~29]。Labreuche 等[24]认为 TG水平与脑卒中发病呈正相关,支持通过降低血浆TG水平预防脑卒中。最近一项大型前瞻性研究[25]认为餐后TG水平与缺血性脑卒中发病呈正相关,在男女人群中均发现随着TG水平的升高,多因素校正后的缺血性脑卒中发病风险逐渐增加(P<0.001)。此项研究较以往不同,检测的是餐后TG水平,并且采用了更合理的统计学方法。但北美[26]及欧洲[27]的脑卒中防治指南均未将血浆TG水平升高列为脑卒中的危险因素。英国的一项研究[28]发现低水平的TG可能引起脑卒中死亡率增高。对于脑卒中的预后,血浆TG水平的相对危险度(relative risk,RR)=0.84,95%CI=0.77 ~0.91。Dziedzic 等[29]的另一项研究也得出了相似的结论。本研究中发现脑梗死患者血清TG水平较正常人群明显升高,并有统计学差异(P=0.022),血清TG水平升高将增加脑梗死的患病风险。
3.4 ApoAV-1131 T>C基因多态性与血清apoAV,TG水平 英国的一项研究[18]表明 apoAV-1131C等位基因携带者血浆TG水平更高,而apoAV水平与-1131 T>C基因多态性无关。认为apoAV 1131 T>C基因多态性可能与apoCIII基因变异之间存在连锁不平衡,而非直接通过周围循环中apoAV水平的改变而影响TG代谢。Henneman等[30]发现血清apoAV水平与apoAV S19W基因变异相关,而与apoAV-1131 T>C基因多态性无关。同样发现-1131C等位基因携带者血浆TG水平更高。本研究发现-1131C等位基因携带者血清apoAV水平较TT纯合子人群为低,但无统计学差异(P=0.240),分别对两组分析均未见有显著性差异。-1131C等位基因携带者血清 TG水平更高(P=0.017)。提示apoAV-1131 T>C基因多态性不通过改变血清apoAV水平而引起TG水平的变化。可能机制为:(1)ApoAV 1131T>C基因多态与apoCIII基因位点存在连锁不平衡,间接通过apoCIII水平的改变调节TG代谢。(2)肝细胞内apoAV基因的表达相对其它载脂蛋白并不少,只是分泌入血的量极少从而导致其血清中apoAV的水平极低。肝细胞内apoAV同样具有调节脂质代谢的作用,包括细胞内的脂质储存及动员。ApoAV-1131 T>C基因多态可能影响肝细胞内apoAV的浓度而影响细胞内TG代谢,进一步引起血清TG水平的改变。(3)美国弗明汉心脏研究[31]发现apoAV-1131 T>C基因多态可能与饮食习惯结构有关,apoAV-1131 C等位基因携带者脂肪摄入量更高(P=0.047),从而进一步引起TG水平的升高。
3.5 ApoAV-1131 T>C基因多态性与脑梗死美国弗明汉子代研究[32]对2273名受试者apoAV的5个基因多态位点(-1131 T>C、-3A>G、56C>G、IVS3+4766>A和1259T>C)进行了分析。其中56C>G多态位点的G等位基因与颈动脉内膜厚度呈正相关(P<0.05)。在肥胖患者中经过对TG的校正,-1131 T>C等另4个位点的变异型等位基因与颈动脉内膜厚度也呈显著相关(P<0.05)。目前对于apoAV-1131 T>C基因多态性与脑梗死之间关系的研究还很少,但都得出了脑梗死发病与apoAV-1131 T > C 基因多态性有关的结论[33,34],并可能是通过TG水平的升高引起;另一方面脑梗死是一种多基因遗传疾病,不遵循孟德尔遗传法则[35],单基因位点变异并不能引起脑梗死的发病。ApoAV-1131 T>C基因多态位点可能与其它脑梗死相关基因位点存在连锁不平衡,并与环境因素相互作用而增加脑梗死的易感性。仍需要进一步大规模的研究明确它们之间的关系,为脑梗死的早期诊断和预防提供新的依据。
4 结论
(1)在湖南汉族非脑梗死人群中,血清apoAV具有降低血清甘油三酯水平的作用,在急性脑梗死患者中血清apoAV与甘油三酯水平无关;(2)血清apoAV水平在急性脑梗死患者与正常人群之间无明显差异,在脑梗死急性期无显著性动态变化;(3)ApoAV-1131 C等位基因与甘油三酯水平升高有关,但与apoAV水平无关;(4)ApoAV-1131 C等位基因是脑梗死的独立危险因素。
[1]Pennacchio LA,Olivier M,Hubacek JA,et al.An apolipoprotein influencing triglycerides in humans and mice revealed by comparativesequencing[J].Science,2001,294(5540):169-173.
[2]van der Vliet HN,Sammels MG,Leegwater AC,et al.Apolipoprotein A-V:a novel apolipoprotein associated with an early phase of liverregeneration[J].J Biol Chem,2001,276(48):44512-44520.
[3]van der Vliet HN,Schaap FG,Levels JH,et al.Adenoviral overexpression of apolipoprotein A-V reduces serum levels of triglycerides and cholesterol in mice[J].Biochem B7 Ophys Res Common,2002,295(5):1156-1159.
[4]Grosskopf I,Baroukh N,Lee SJ,et al.Apolipoprotein A-V deficiency results in marked hypertriglyceridemia attributable to decreased lipolysis of triglyceride-rich lipoproteins and removal of their remnants[J].Arterioscler Thromb Vasc Biol,2005,25(12):2573-2579.
[5]Mattei J,Demissie S,Tucker KL,et al.Apolipoprotein A5 polymorphisms interact with total dietary fat intake in association with markers of metabolic syndrome in Puerto Rican older adults[J].J Nutr,2009,139(12):2301-2308.
[6]Maasz A,Kisfali P,Horvatovich K,et al.Apolipoprotein A5 T-1131C variant confers risk for metabolic syndrome[J].Pathol Oncol Res,2007,13(3):243-247.
[7]Khovidhunkit W,Duchateau PN,Medzihradszky KF,et al.Apolipoproteins A-IV and A-V are acute-phase proteins in mouse HDL[J].Atherosclerosis,2004,176(1):37-44.
[8]Hordestgaard BG,Zacho J.Lipids,atherosclerosis and CVD risk:is CRP an innocent bystander[J].Nutr Metab Cardiovasc Dis,2009,19(8):521-524.
[9]Libby P,Okamoto Y,Rocha VZ,et al.Inflammation in atherosclerosis:transition from theory to practice[J].Circ J,2010,74(2):213-220.
[10]Orr AW,Hastings NE,Blackman BR,et al.Complex regulation and function of the inflammatory smooth muscle cell phenotype in atherosclerosis[J].J Vasc Res,2010,47(2):168-180.
[11]Perez-Martinez P,Corella D,Shen J,et al.Association betweep glucokinase regulatoryprotein (GCKR)and apolipoprotein A5(APOAS)gene polymorphisms and triacylglycerol concentrations in fasting,postprandial,and fenofibrate-treated states[J].Am J Clin Nutr,2009,89(1):391-399.
[12]Pullinger CR,Aouizerat BE,Movsesyan I,et al.An apolipoprotein AV gene SNP is associated with marked hypertriglyceridemia among A-sian-American patients[J].J Lipid Res,2008,49(8):1846-1854.
[13]Szalai C,Keszei M,Duba J,et al.Polymorphism in the promoter region of the apolipoprotein A5 gene is associated with an increasedsusceptibility for coronary artery disease[J].Atherosclerosis,2004,173(1):109-114.
[14]Hubacek JA,Skodova Z,Adamkova V,et al.The influence of APOAV polymorphisms(T-1131>C and S19>W)on plasma triglyceride levels and risk of myocardial infarction[J].Clin Genet,2004,65(2):126-130.
[15]Ishihara M,Kujiraoka T,Iwasaki T,et al.A sandwich enzyme linked immunosorbent assay for human plasma apolipoprotein A-V concentration[J].J Lipid Res,2005,46(9):2015-2022.
[16]Zhao SP,Hu S,Li J,et al.Association of human serum apolipoprotein A5 with lipid profiles affected by gender[J].Clin Chim Acta,2007,376(1~2):68-71.
[17]中华医学会全国第四届脑血管病学术会议.各类脑血管病诊断要点[J].中华神经科杂志,1996,29(6):379.
[18]Talmud PJ,Cooper JA,Hattori H,et al.The apolipoprotein A-V genotype and plasma apolipoprotein A-V and triglyceride levels:prospective risk of type 2 diabetes.Results from the Northwick Park Heart Study II[J].Diabetologia,2006,49(10):2337-2340.
[19]Merkel M,Loeffler B,Kluger M,et al.Apolipoprotein AV accelerates plasma hydrolysis of triglyceride-rich lipoproteins by interaction with proteoglycan-bound lipoprotein lipase[J].J Biol Chem,2005,280(22):21553-21560.
[20]Priore Oliva C,Pisciotta L,Li Volti G,et al.Inherited apolipoprotein A-V deficiency in severe hypertriglyceridemia[J].Arterioscler Thromb Vasc Biol,2005,25(2):411-417.
[21]Nilsson SK,Lookene A,Beckstead JA,et al.Apolipoprotein A-V interaction with members of the low density lipoprotein receptor gene family[J].Biochemistry,2007,46(12):3896-3904.
[22]Becker S,Schomburg L,Renko K,et al.Altered apolipoprotein A-V expression during the acute phase response is independent of plasma triglyceride levels in mice and humans[J].Biochem Biophys Res Commun,2006,339(3):833-839.
[23]Mansouri RM,Bauge E,Gervois P,et al.Atheroprotective effect of human apolipoprotein A5 in a mouse model of mixed dyslipidemia[J].Circ Res,2008,10(5):450-453.
[24]Labreuche J,Touboul PJ,Amarenco P.Plasma triglycer ide levels and risk of stroke and carotid atherosclerosis:a systematic review ofthe epidemiological studies[J].Atherosclerosis,2009,203(2):331-345.
[25]Freiberg JJ,Tybjaerg-Hansen A,Jensen JS,et al.Nonfasting triglycerides and risk of ischemic stroke in the general population[J].Jama,2008,300(18):2142-2152.
[26]Goldstein LB,Adams R,Alberts MJ,et al.Primary prevention of ischemic stroke:a guideline from the American Heart AssociationiAmerican Stroke Association Stroke Council:cosponsored by the Atherosclerotic Peripheral Vascular Disease Interdisciplinary Working Group;Cardiovascular Nursing Council;Clinical Cardiology Council;Nutrition,Physical Activity,and Metabolism Council;and the Quality of Care and Outcomes Research Interdisciplinary Working Group[J].Circulation,2006,113(24):e873-923.
[27]Graham I,Atar D,Borch-Johnsen K,et al.European guidelines on cardiovascular disease prevention in clinical practice:executive summary[J].Atherosclerosis,2007,194(1):1-45.
[28]Weir CJ,Sattar N,Walters MR,et al.Low triglyceride,not low cholesterol concentration,independently predicts poor outcome following acute stroke[J].Cerebrovasc Dis,2003,16(1):76-82.
[29]Dziedzic T,Slowi k A,Gryz EA,et al.Lower serum triglyceride level is associated with increased stroke severity[J].Stroke,2004,35(6):e151-152.
[30]Henneman P,Schaap FG,Havekes LM,et al.Plasma apoAV levels are markedly elevated in severe hypertrigiyceridemia and positively correlated with the APOA5 S19W polymorphism[J].Atherosclerosis,2007,193(1):129-134.
[31]Corella D,Lai CR,Demissie S,et al.APOA5 gene variation modulates the effects of dietary fat intake on body mass index and obesity risk in the Framingham Heart Study[J].J Mol Med,2007,85(2):119-128.
[32]Elosua R,Ordovas JM,Cupples LA,et al.Variants at the APOA5 locus,association with carotid atherosclerosis,and modification by obesitY:the Framingham Study[J].J Lipid Res,2006,47(5):990-996.
[33]Maasz A,Kisfali P,Jaromi L,et al.Apolipoprotein A5 gene IVS3+G476A allelic variant confers susceptibility for development of ischemic stroke[J].Circ J,2008,72(7):1065-1070.
[34]张 葵,邱 方,李 雷,等.载脂蛋白A5基因多态性与脑梗塞的相关性研究[J].中华医学遗传学杂志,2008,25(3):284-288.
[35]Flossmann E,Schulz UG,Rothwell PM.Systematic review of methods and results of studies of the genetic epidemiology of ischemicstroke[J].Stroke,2004,35(1):212-227.

