发酵木糖产酒精菌株的筛选和驯化
李力群,陈英伟,王德信,姜海静,唐志涛
(1.吉林化工学院环境与生物工程学院,吉林 吉林132022;2.吉林沱牌农产品开发有限公司 技术部,吉林 吉林132000)
生物资源是地球上最丰富的可再生资源.随着矿产资源日渐枯竭,开发高效转化可再生纤维素物质的微生物技术,炼制生物燃料,具有极其重要的意义和广阔的发展前景.我国农业生产中形成的各种秸秆,每年约有7亿吨.在玉米秸秆等植物纤维水解液中木糖约占25% ~30%,木糖的充分利用是植物纤维资源生产酒精经济可行性的关键之一[1].将木糖转化为酒精,在理论上可提高酒精产量25%[2],因此选育优良的木糖发酵酒精菌种势在必行.
本文从土壤中筛选出了可发酵木糖为酒精的菌株M-12#,对其进行了初步研究,为后续研究奠定了基础.
1 材料与方法
1.1 材料
1.1.1 土样
分别采自吉林市九站经济技术开发区农田和吉林化工学院校园.
1.1.2 培养基
YEPD液体培养基:酵母粉10 g/L,蛋白胨20 g/L,木糖 20 g/L,蒸馏水1 L,pH 为 5.0,120 ℃灭菌30 min.
YEPD固体培养基:酵母粉10 g/L,蛋白胨20 g/L,木糖20 g/L,琼脂粉20 g/L,蒸馏水1 L,pH为5.0,120℃灭菌30 min.
发酵培养基:木糖20 g/L,酵母粉10 g/L,蛋白胨 15 g/L,(NH4)2SO41 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,CaCl2·2H2O 1 g/L,H2O 1 L,120℃灭菌30 min.
1.1.3 主要仪器、试剂和测定方法
主要仪器和设备 YP-600型精密电子天平,UV-2000型紫外可见光分光光度计,生化培养箱,高压蒸汽灭菌锅,SW-CJ-2F型生物超净工作台,HYG-A型回转恒温调速摇瓶柜,SA23031型数码生物显微分析系统等.
主要试剂酵母浸粉,蛋白胨,木糖,琼脂粉、酵母膏、磷酸二氢钾、尿素、硫酸镁等试剂.
主要测定方法酒精含量测定采用重铬酸钾比色法[5].木糖含量测定采用直接滴定法.生物量的测定采用血球计数板计数法和比浊法,在比浊法中,将发酵液混合均匀后稀释至一定倍数,测定其吸光度OD600.
2 实验方法与实验结果
2.1 木糖发酵酒精菌株的筛选
2.1.1 菌种初筛
取10 g土样加入到装有90 mL带有玻璃珠的无菌水三角瓶中,震荡30 min,吸取5份10 mL悬浊液分别加入至90 mL YEPD液体培养基中放置摇床培养48 h,摇速140 r/min,温度30℃.富集后的菌液依次稀释至10-6、10-7、10-8浓度,每个稀释度吸取1 mL菌液均匀涂布到YEPD固体平板上,30℃培养48 h,对长出的菌落,进行复筛.
2.1.2 菌种复筛
TTC(2,3,5-氯化三苯基四氮唑)上层培养基:TTC 0.05 g,木糖0.5 g,琼脂1.5 g,H2O 100 mL.
TTC下层培养基:木糖10.1 g,蛋白胨2 g,酵母膏1.5 g,KH2PO41 g,MgSO4·7H2O 0.4 g,柠檬酸 0.27 g,琼脂 20 g,H2O 1 L[3].
将纯化的菌株接入到TTC下层培养基平板,30℃倒置培养两天,在长出的菌落上倒入TTC上层培养基覆盖,于30℃下避光保存3 h,根据不同的菌落颜色等差异进行筛选[4].
将筛选出来的菌株接入装有100 mL发酵培养基的250 mL三角瓶中,在30℃、120 r/min条件下进行发酵,48 h后挑出酒精浓度高的摇瓶,将菌液稀释到相应的浓度,重复TTC法筛选,经过不断的发酵驯化和筛选,选育出酒精产量高的菌落.
2.2 菌种鉴定
经过复筛得到的菌株形态学特征:菌落质地均匀,正反面和边缘、中央部位的颜色均一,乳白色,表面光滑,容易挑起,不透明.液体培养形成菌膜和沉淀,细胞形态为卵圆柱形,主要以出芽方式繁殖,形成假菌丝,初步鉴定为霉菌,见图1~2.

图1 菌株形态

图2 菌落形态
2.3 生长曲线的测定
将菌株接入不同浓度木糖的发酵培养基中,在28℃,120 r/min条件下培养.利用血球计数板法和浊度法测定霉菌浓度.使用UV-2000型紫外可见光分光光度计,以灭菌的培养基为空白,比色皿厚度为5 mm,测定样品的OD600值 (注:空白与样品的稀释倍数一致).菌株的生长曲线测定结果见图3.

图3 菌株在不同木糖浓度培养基中的生长曲线
图3中的曲线表明,木糖浓度变化对霉菌的生长速度有明显的影响.
2.4 木糖发酵菌株的驯化
将菌株接种到木糖浓度30 g/L的100 mL发酵培养基中,在培养温度28℃,摇床转速为120 r/min条件下培养96 h.将TTC法筛选出发酵性能较高的菌株,再次接入木糖质量浓度为30 g/L的液体培养基中,同样条件下连续培养96 h.经过不断的发酵驯化和TTC方法筛选过程,不断提高菌株的木糖发酵酒精能力和发酵效率.
2.5 木糖发酵酒精性能实验
发酵培养基木糖浓度分别为20 g/L、30 g/L、40 g/L、50 g/L、60 g/L、70 g/L、80 g/L.250 mL 三角瓶中装量为100 mL.接种量为2 mL,pH 5.5,28℃,120 r/min摇床培养,每隔24 h测一次酒精度和残糖量.测实结果如图4~5所示.
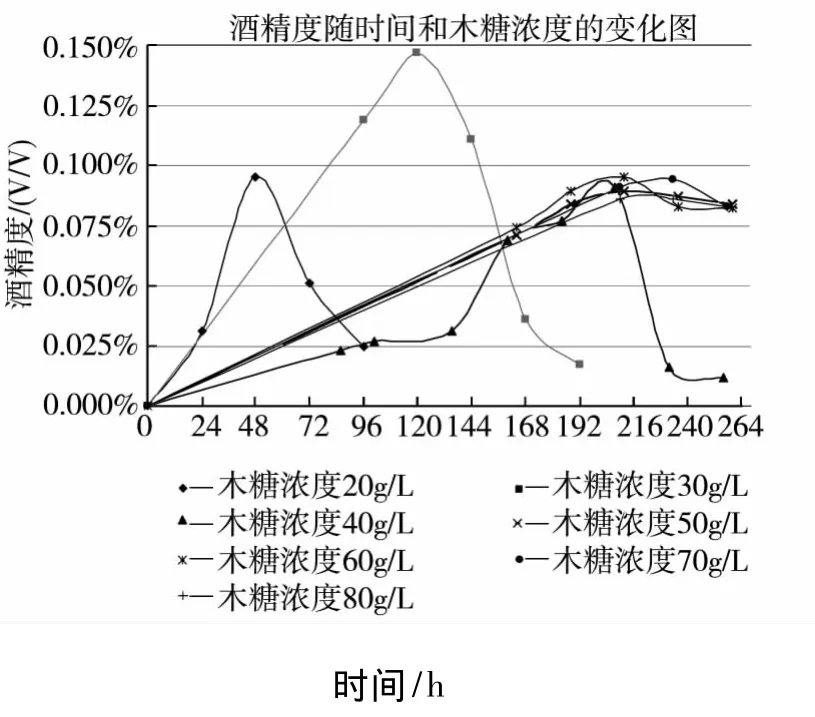
图4 菌株木糖发酵酒精性能曲线

图5 菌株木糖发酵酒精时残糖量变化曲线
图5曲线趋势表明,当发酵液中的木糖浓度不高于3%时,残糖量较少,当木糖浓度高于3%时,残糖量与木糖浓度成正比.
其中木糖浓度30 g/L实验产酒精最多,其主要数据列于表1.

表1 木糖30 g/L时菌株酒精发酵实验数据
表1数据表明,当发酵至120 h时,酒精度达到峰值,为0.147%(v/v),木糖转化率为0.045 g/g,为理论转化率的9.85%.
2.6 主要影响因素的探索实验
2.6.1 实验设计
分别以木糖浓度、发酵温度和发酵液pH值初值为影响因子,设计三因素三水平的正交实验,探索影响酒精发酵的主要因素之间的关系,因素和水平的设计见表2.

表2 因素水平设计表
2.6.2 实验数据
按实验的设计要求,每个实验有五个平行发酵培养基瓶,115℃下灭菌30 min.然后接入菌种进行发酵实验,测定不同时间的残糖量和酒精度,实验结果见图6.
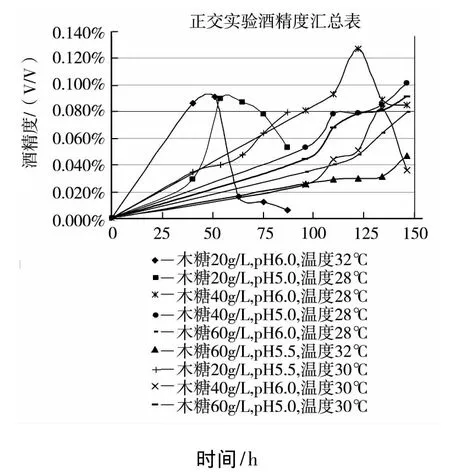
图6 菌株木糖发酵酒精正交实验曲线
2.6.3 正交实验数据处理
采用直观分析法处理对图5中的酒精发酵正交实验数据进行极差分析,得到各因素的极差值:RA=1.908 7,RB=0.284 7,RC=0.078 5.通过比较极差数值的大小可知,最终影响霉菌木糖发酵酒精因素的强弱顺序为:
A(木糖浓度)>B(发酵温度)>C(发酵液pH初值).各因素的R值差异表明:木糖浓度对实验结果的影响最大,木糖浓度过高时有将产生严重的底物抑制;发酵温度的影响次之,而发酵液pH初值对实验结果的影响相对最小.
2.7 选育后的菌株发酵性能实验
采用L9(34)正交实验优化菌株的木糖发酵酒精工艺条件,因素和水平设计列于表3.

表3 因素和水平设计表
发酵温度:28℃;发酵时间:66 h;摇床速度:145 r/min;木糖3%,酵母膏0.1%,磷酸二氢钾0.05%,无水氯化钙0.025%,实验结果列于表4.
表4中实验4的发酵酒份最高,达到0.48%(v/v),残糖 1.8%,摇瓶装量:90 mL/250 mL.木糖转化率为 0.316 g/g,达到理论转化率的68.6%.

表4 驯化后菌株发酵工艺优化正交实验
3 结 论
本工作从土壤是筛选得到了一株霉菌M-12#,其主要性能如下:
(1)该霉菌的菌落呈白色,边缘有缺刻,隆起,表面丝状向外散射,在显微镜下的菌株呈短粗杆状或棒状,两端比较圆滑.
(2)在驯化之前,当木糖浓度为30 g/L,发酵120 h,发酵酒精度达到峰值,为0.147%(v/v),木糖转化率为0.045 g/g,为理论转化率的9.85%.
(3)经过二个月地不断驯化,筛选出来的菌株在木糖浓度为30 g/L的发酵液中,发酵66 h,酒精浓度提高了226%,达到0.48%(v/v),转化率为0.316 g/g,为理论转化率的68.6%.
[1]Rodney JB,NancyN,Brace SD.Fermentations with new recombinant organisms [J].Biotechnol.Prog,1999(15):867-875.
[2]曹秀华,阮奇城,林海红,等.纤维燃料酒精生产中木糖发酵的研究进展,中国麻业科学[J].2010,32(3):166-169.
[3]祖若夫,胡宝龙,周德庆.微生物学实验教程[M].上海:复旦大学出版社,1993.
[4]王梅,张澎湃,帅桂兰.TTC在黄酒酵母选育中的应用[J].酿酒,2001(5):62-64.
[5]林仁权,胡文兰,陈国亮.重铬酸钾氧化分光光度法测定酒中酒精含量[J].浙江预防医学,2006,18(3):78-79.
[6]杜连祥.工业微生物学试验技术[M].天津:天津科学技术出版社.1992,10.

