连续血管内超声评价完全可降解聚-L-乳酸支架置入猪冠状动脉1 个月支架弹性回缩
吴轶喆 葛雷 沈雳 王齐兵 钱菊英 谢建 胡玺 葛均波
自2000 年 以聚-L-乳酸(poly-L-lactic acid,PLLA)为骨架的支架置入人类冠状动脉以来,这种完全可降解支架已完成了长达10 年的随访。无论是Igaki-Tamai 支架(Igaki Medical,Kyoto,Japan)还是雅培公司的BVS 支架(bioresorbable vascular scaffold,BVS,Abbott Vascular,US)均显示了良好的长期疗效[1-6]。完全可降解PLLA 支架作为一种血管支撑物,在置入血管后早期可抵抗血管弹性回缩,在血管负性重构完成后可完全降解为水和二氧化碳,从而使血管重回生理状态,恢复自然的舒缩活动,消除血管炎症[7],具有良好的临床应用前景。然而,PLLA 作为一种聚合物,其结构与金属支架不同。这种聚合物支架是否会发生弹性回缩,能否提供与金属支架同样的径向支撑力始终是研究者关注的问题。
XINSORB 支架系统(上海微特生物科技有限公司)是一种完全可降解球囊扩张式支架系统。本研究选用EXCELTM支架(山东吉威医疗制品有限公司)作为对照,目的在于观察前者的早期支架弹性回缩和支架贴壁情况。
资料与方法
一、实验动物和实验用支架
1. 实验动物:小型猪共16 头,每头小型猪的体质量为20 ~25 kg(雌雄不限),由复旦大学附属中山医院实验动物中心提供。动物实验方案已得到复旦大学附属中山医院动物实验伦理委员会通过,术中动物按动物实验伦理对待。
2. 实验用支架:实验用支架包括两种类型:EXCEL 支架和XINSORB 支架。两种支架均为球囊扩张式。
XINSORB 支架系统由上海微特生物科技有限公司提供。该支架系统由XINSORB 支架和输送系统球囊导管构成。XINSORB 支架由完全可降解PLLA 构成并携带抗增殖药物西罗莫司,支架梁厚度为150 μm,表面涂覆聚-D-L-乳酸(Poly-D-L-lactic Acid,PDLLA),PDLLA 内携带有西罗莫司并可控制药物释放速率。因支架本身在透视下不可见,故在支架两端各设有1 个不透“X”线的标记点,用于指示支架在血管中的位置。支架球囊两端也各有1 个不透“X”线的标记,利于支架释放时定位。XINSORB 支架的规格为3.0 mm×15 mm。
EXCEL 支架购自山东吉威医疗制品有限公司,该支架以316 L 不锈钢作为支架平台,表面涂覆PLLA,携带西罗莫司。规格为3.0 mm×14 mm。
二、支架置入术和影像学检查
1. 实验分组:根据置入的支架类型,将实验动物分为两组:XINSORB 组(8 头)和EXCEL 组(8头)。
2. 支架置入术:术前3 d 起给予拜阿司匹林100 mg/d 和氯吡格雷75 mg/d 双联抗血小板治疗,直至术后随访时。采用氯氨酮10 mg/kg 和地西泮1 mg/kg 肌注麻醉,必要时静脉追加3%戊巴比妥钠1 ~3 ml。常规消毒铺巾,穿刺右侧股动脉,置入6 F鞘。经鞘管给予肝素100 U/kg,送入指引导管行左、右冠状动脉造影。通过即刻定量冠状动脉造影分析选择左前降支和右冠状动脉近段或中段直径为2.5 ~3.0 mm 且较为平直的血管段作为支架置入部位,随机置入两组支架,每支血管仅置入1 枚支架,如血管细小,则放弃对该支血管的支架置入。XINSORB 支架送入体内前先将其浸没于生理盐水中10 s。按照支架/血管直径比(1.1 ~1.2)∶1的比例,以球囊命名压力8 ~10 atm(1 atm = 101.325 kPa)扩张30 s 进行支架释放,记录支架释放的影像。退出球囊后重复造影,确认无血管夹层和血栓形成、前向血流TIMI 3 级视为手术成功。
3. 定量冠状动脉造影(quantitative coronary angiography,QCA):于支架置入后即刻和术后2 h、4 h、6 h 分别复查冠状动脉造影,方法如前所述。所得冠状动脉造影影像由独立于本研究的分析人员在QCA 工作站(CASS Ⅱanalysis system,Pie Medical BV,Maastricht,The Netherlands)进行分析,参数包括支架置入术前靶血管直径、支架释放时球囊直径、支架释放后即刻以及术后2 h、4 h、6 h 支架置入部位的管腔直径。术后即刻支架内无内膜增生,因此此时的支架直径可用管腔直径替代。因术后4 周造影时支架内已有少量增生内膜,故不再计算术后4周的支架直径。早期支架直径弹性回缩量定义为支架释放时球囊平均直径分别与支架术后即刻、2 h、4 h 和6 h 支架置入部位直径之差。早期支架直径弹性回缩百分数定义为支架直径弹性回缩量与球囊平均直径的比值,以百分数表示。
4. 血管内超声(intravascular ultrasound,IVUS)检查和定量分析:采用iLab 血管内超声显像系统(Boston Scientific,USA),IVUS 导管为机械旋转型的Atlantis 导管,可以30 帧/s 的速度成像。
支架置入术即刻和术后2 h、4 h、6 h 及术后4周时分别行IVUS 检查。先经冠状动脉内注入硝酸甘油200 μg,随后将IVUS 导管送入目标血管支架远端,缓慢自动回撤IVUS 导管(0.5 mm/s)。所有IVUS 影像资料均记录保存并由独立于本研究的分析人员进行分析。
支架面积定义为支架梁管腔面所围绕的面积。支架平均面积定义为支架内近、中、远段各取一个截面测量所得支架面积的平均值。支架贴壁不良定义为IVUS 检查发现一个或一个以上支架梁与血管壁发生分离,两者之间存在明显的间隙,在支架后方可看到闪烁的血流相,且发生部位没有分支血管。早期支架面积弹性回缩量定义为术后即刻IVUS 所测量的支架平均面积分别与术后2 h、4 h、6 h 及术后4周时支架平均面积之差。早期支架面积弹性回缩百分数定义支架平均面积弹性回缩量与术后即刻支架平均面积的比值,以百分数表示。
三、统计学分析
所有数据均录入SPSS 20.0 进行统计学分析。计量资料以 珋x±s 表示,采用重复测量的方差分析方法对计量资料进行统计分析;采用One-way ANOVA对单因素多组计量资料进行统计分析,如One-way ANOVA 拒绝无效假设,则采用Bonferroni 校正比较组间差异。以P <0.05 为差异有统计学意义。
结 果
1. 总体研究结果:共有16 头小型猪入选本研究,其中8 头小型猪共置入XINSORB 支架16 枚(前降支、右冠状动脉各8 枚),另8 头小型猪共置入EXCEL 支架16 枚(前降支9 枚、右冠状动脉7 枚)。支架置入过程顺利,术中无猪死亡。
2. QCA 分析结果:支架置入术前,两组所选择的靶血管直径接近,均为2.6 mm 左右,两组间无差异(P=0.56)。支架释放时,两组支架均按支架球囊所标称的压力,以(1.1 ~1.2)∶1的支架/血管直径比释放支架。支架置入后,通过QCA 分析术后即刻、2 h、4 h 和6 h 的造影影像,可见这4 个时间点,支架直径在XINSORB 组和EXCEL 组间差异均无统计学意义。提示完全可降解XINSORB 支架置入猪冠状动脉后即刻、2 h、4 h 和6 h,造影所见的支架直径并不小于EXCEL 支架。进一步计算并比较这4个时间点两组支架的支架直径弹性回缩量和支架直径弹性回缩百分数。XINSORB 组术后即刻、2 h、4 h和6 h 支架直径弹性回缩量和百分数分别为(0.05±0.06)mm、(1.72 ±1.78)%,(0.10 ±0.07)mm、(3.34 ± 2.43)%,(0.08 ± 0.06)mm、(2.59 ±1.89)% 和(0.09 ± 0.05)mm、(2.99 ± 1.69)%。EXCEL 组不同时间点该两项指标分别为(0.02 ±0.06)mm、(0.58 ± 2.02)%,(0.06 ± 0.10)mm、(2. 17 ±3. 30)%,(0. 07 ±0. 08)mm、(2. 19 ±2.72)%和(0.07 ±0.09)mm、(2.41 ±2.76)%。两组间差异也无统计学意义。XINSORB 支架置入术后6 h 内,支架直径最大弹性回缩量为(0.10 ±0.07)mm,直径弹性回缩百分数为(3.34 ±2.43)%,略大于EXCEL 支架的(0.07 ±0.08)mm和(2.41 ±2.76)%,但两组间差异均无统计学意义,提示两组支架在造影随访下置入猪冠状动脉后6 h 内直径弹性回缩程度相似。
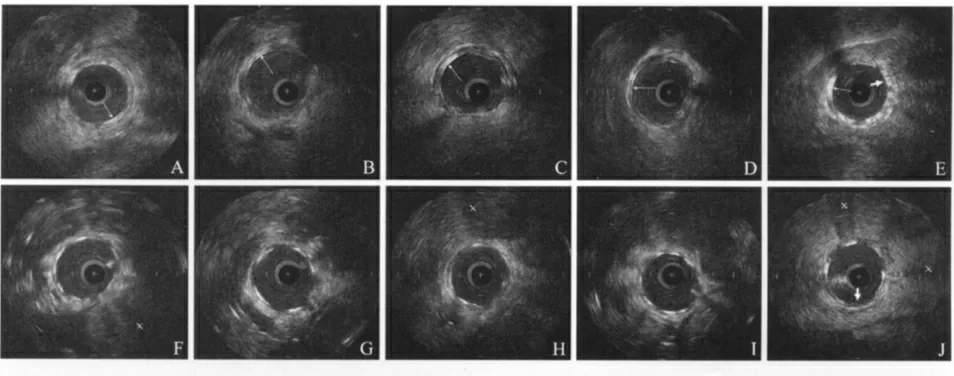
图1 连续IVUS 随访完全可降解PLLA XINSORB 支架弹性回缩。图A ~E 和图F ~J 分别为IVUS 随访XINSORB 支架和EXCEL 支架弹性回缩情况
组内分析,XINSORB 组术后即刻、2 h、4 h 和6 h 这4 个时间点间的支架直径无统计学差异(P =0.82),不同时间点间的支架直径弹性回缩量(P =0.32)、百分数(P =0.30)差异均无统计学意义。EXCEL 组术后即刻、2 h、4 h 和6 h 这4 个时间点间的支架直径(P=0.82)、支架直径弹性回缩量(P =0.42)和百分数(P =0.42)差异也无统计学意义。提示在随访过程中两组支架均未发生明显的直径弹性回缩。
3. IVUS 随访结果:完全可降解PLLA 支架的支架梁在IVUS 下表现为两层平行的回声,其后无声影。而金属支架能完全反射超声波,故在IVUS 下可见支架梁后方的声影。术后即刻、2 h、4 h、6 h 和4 周分别随访IVUS,XINSORB 和EXCEL 两组支架梁均与血管壁紧密贴合,均未见支架贴壁不良征象。此外,术后4 周随访时,两组支架内均可见少量增生的内膜(图1)。
支架置入术后即刻,两组支架平均面积接近(P=0.88),提示基线条件一致。其后IVUS 分别在术后2 h、4 h、6 h 和4 周进行随访,不同时间点时的两组支架平均面积均相似,差异无统计学意义。提示完全可降解XINSORB 支架置入猪冠状动脉后即刻、2 h、4 h、6 h 和4 周,支架平均面积并不小于EXCEL支架。进一步计算早期支架面积弹性回缩量及弹性回缩百分数,在不同随访时间点XINSORB 支架面积弹性回缩量和百分数均略大于EXCEL 支架。XINSORB 组术后2 h、4 h、6 h 和4 周支架面积弹性回缩量和百分数分别为(0.05 ±0.13)mm2、(0.62 ±1.90)%,(0.04 ±0.35)mm2、(0.29 ±4.95)%,(0.22±0.46)mm2、(2.87±6.65)%和(0.31 ±0.27)mm2、(4.30 ±3.66)%。EXCEL 组不同时间点该两项指标分别为(0.01 ± 0.11)mm2、(0.04 ± 1.59)%,(-0.03 ±0.36)mm2、(-0.44 ±5.34)%,(0.08 ±0.23)mm2、(1.02 ±3.41)%和(0.10 ±0.22)mm2、(1.44 ±3.35)%。两组间差异并无统计学意义。提示两组支架在IVUS 随访下置入猪冠状动脉后4 周内早期支架面积弹性回缩程度相似。
组内分析,XINSORB 组支架平均面积在支架置入术后即刻、2 h、4 h、6 h 和4 周均接近,差异无统计学意义(P =0. 78),组内比较这些时间点的支架面积弹性回缩量(P =0. 09)和支架弹性回缩百分数(P =0. 49),差异亦无统计学意义。组内分析EXCEL 组在支架置入术后即刻和术后各随访时间点的支架平均面积(P =0. 87)、支架面积弹性回缩量(P =0. 26)和支架面积弹性回缩百分数也无差异(P =0. 86),该结果也与QCA分析一致,提示支架置入猪冠状动脉4 周内IVUS随访,两组支架面积分别较各自置入后即刻相比,均未发生显著缩小。
讨 论
近年来完全可降解PLLA 支架已通过临床随访显示了不劣于传统金属药物洗脱支架的疗效,被誉为介入心脏病学史上的第四次革命性进展[8]。PLLA 优点在于良好的生物相容性、降解速度可调控、降解产物易于代谢以及材料易于消毒。然而,与金属支架相比,聚合物支架最大的不足就是其机械特性。在相同的支架壁厚度下,聚合物支架无法提供与金属支架相同的支撑力,并且更容易发生早期弹性回缩。早期研究表明,PLLA 支架可承受较高压力而不发生塌缩,这种支撑力与普通不锈钢支架相似,初步显示在机械强度上,PLLA 用于制备冠状动脉支架是可行的[9-10]。Rieu 等[11]在体外实验中考查了17 种冠状动脉金属支架的机械特性,发现在30 kPa 压力内,已扩张的支架无一发生显著的变形;而在30 kPa 以上,部分支架已开始塌陷。由于这17种金属支架均已有效用于临床,Rieu 等认为支架所能承受的最小塌缩压至少为30 kPa。目前所使用的PLLA 材料所能承受的塌缩压至少在200 kPa 以上,因此均能满足用于冠状动脉支架的要求[8,12]。
近年较为成熟、已用于较大规模临床研究的PLLA 支架是雅培公司的BVS。Tanimoto 和Onuma等[13-14]通过对ABSORB 研究和SPIRIT 系列研究进行分析,发现BVS 置入人类冠状动脉后早期弹性回缩程度略大于钴铬合金Xience Ⅴ支架,但该差异无统计学意义。早先的Igaki-Tamai 支架由PLLA 单纤维构成,Tamai 等[1]用这种支架治疗了19 处人类冠状动脉病变,以不锈钢Palmaz-Schatz 支架进行对照,术后即刻和术后24 h 重复进行了QCA 和IVUS检查,未发现即刻支架弹性回缩,长期随访也提示两者良好的远期疗效。
本研究中的XINSORB 支架作为一种新的完全可降解PLLA 支架,不可避免地需要考查其弹性回缩的情况。造影随访发现,XINSORB 支架按球囊命名压释放能达到标称直径,置入术后6 h 内连续造影随访,支架直径与EXCEL 支架相似,早期弹性回缩程度也与后者接近(2% ~3%),两者均未发生明显弹性回缩。由于术后4 周随访造影时发现两组支架内均有不同程度的内膜增生,故造影所见管腔直径不能替代支架直径。IVUS 可清晰显示支架本身而不受新生内膜影响,且可评价支架贴壁情况,故本研究除了QCA 外还同时采用IVUS 测量支架平均面积的方法来评价支架弹性回缩。IVUS 随访发现,两组支架梁均与血管壁紧密贴合,未见两者分离的影像,提示两组支架完全扩张,无支架梁塌陷或脱垂。术后不同时间点无论是支架平均面积,还是由此计算所得的支架弹性回缩程度,XINSORB 支架均和EXCEL 支架相似。XINSORB 支架弹性回缩程度随着时间延长略有增大趋势,但总体来讲差异无统计学意义。虽然XINSORB 支架的弹性回缩程度略大于EXCEL 支架,在4 周随访时最明显,但差异亦无统计学意义。IVUS 随访结果与QCA 一致。
目前认为,影响可降解PLLA 支架机械性能和弹性回缩的相关因素主要包括材料本身的弹性模量和支架厚度两方面。用于制备可降解支架的原材料必须要有足够大的弹性模量,才能具备足够的支撑强度,从而避免支架弹性回缩。如果弹性模量过低,在相同形变下支撑力小,无法完成对血管的支撑作用[15]。现使用的PLLA 弹性模量为2.8 ~4.2 GPa,足以制备冠状动脉支架。支架厚度也对弹性回缩有影响。聚合物本身机械性能有限,在厚度相同的情况下,聚合物支架的支撑力明显弱于金属支架。通过增加支架厚度,可使PLLA 支架达到与金属支架相同的支撑力。通常来讲,PLLA 支架厚度小于150 μm 则无法提供足够的支撑力。另一方面,支架厚度也与再狭窄有关[16-17],支架壁越厚,再狭窄发生率越高。因此,在支架厚度和径向支撑力间应仔细权衡。ABSORB 研究中使用的BVS 及本研究中使用的XINSORB 支架厚度均为150 μm。ABSORB 研究2 年随访结果显示,BVS 内晚期丢失和直径再狭窄分别为(0.48 ±0.28)mm 和(27 ±11)%,与6 个月随访结果相似[5]。该研究结果表明,目前使用的PLLA 支架的厚度可能已经是最优化的结果。
到目前为止,BVS 仍然是唯一用于较大规模临床研究的完全可降解PLLA 支架。具有类似结构的XINSORB 支架置入猪冠状动脉后未见早期支架弹性回缩,表现了良好的早期疗效。下一步研究计划是进一步评价该支架的中、远期疗效和安全性。在XINSORB 支架疗效和安全性被确认后,该支架将作为国产支架对同类进口支架发起强有力的挑战。
[1] Tamai H,Igaki K,Kyo E,et al. Initial and 6-month results of biodegradable poly-l-lactic acid coronary stents in humans.Circulation,2000,102:399-404.
[2] Tsuji T,Tamai H,Igaki K,et al. Four-year follow-up of the biodegradable stent (Igaki-Tamai Stent). Circ J,2004,68:135.
[3] Nishio S,Kosuga K,Igaki K,et al. Long-Term (>10 Years)clinical outcomes of first-in-human biodegradable poly-l-lactic acid coronary stents:Igaki-Tamai stents. Circulation,2012,125:2343-2353.
[4] Ormiston JA,Webster MW, Armstrong G. First-in-human implantation of a fully bioabsorbable drug-eluting stent:the BVS poly-L-lactic acid everolimus-eluting coronary stent. Catheter Cardiovasc Interv,2007,69:128-131.
[5] Serruys PW,Ormiston JA,Onuma Y,et al. A bioabsorbable everolimus-eluting coronary stent system (ABSORB):2-year outcomes and results from multiple imaging methods. Lancet,2009,373:897-910.
[6] Serruys PW,Onuma Y,Dudek D,et al. Evaluation of the second generation of a bioresorbable everolimus-eluting vascular scaffold for the treatment of de novo coronary artery stenosis:12-month clinical and imaging outcomes. J Am Coll Cardiol,2011,58:1578-1588.
[7] Chen C,Chueh J, Tseng H, et al. Preparation and characterization of biodegradable PLA polymeric blends.Biomaterials,2003,24:1167-1173.
[8] Onuma Y,Serruys PW. Bioresorbable scaffold:the advent of a new era in percutaneous coronary and peripheral revascularization?Circulation,2011,123:779-797.
[9] Stack RS,Califf RM,Phillips HR,et al. Interventional cardiac catheterization at Duke Medical Center. Am J Cardiol,1988,62:3F-24F.
[10] Venkatraman S,Poh TL,Vinalia T,et al. Collapse pressures of biodegradable stents. Biomaterials,2003,24:2105-2111.
[11] Rieu R,Barragan P,Masson C,et al. Radial force of coronary stents:a comparative analysis. Catheter Cardiovasc Interv,1999,46:380-391.
[12] Zilberman M,Nelson KD,Eberhart RC. Mechanical properties and in vitro degradation of bioresorbable fibers and expandable fiber-based stents. J Biomed Mater Res B Appl Biomater,2005,74:792-799.
[13] Tanimoto S,Serruys PW,Thuesen L,et al. Comparison of in vivo acute stent recoil between the bioabsorbable everolimuseluting coronary stent and the everolimus-eluting cobalt chromium coronary stent:insights from the ABSORB and SPIRIT trials.Catheter Cardiovasc Interv,2007,70:515-523.
[14] Onuma Y,Serruys PW,Gomez J,et al. Comparison of in vivo acute stent recoil between the bioresorbable everolimus-eluting coronary scaffolds (revision 1. 0 and 1. 1)and the metallic everolimus-eluting stent. Catheter Cardiovasc Interv,2011,78:3-12.
[15] 陈爱宝,罗七一. 可降解支架材料热学、机械性能及与受体的生物相容性. 中国组织工程研究与临床康复,2010,14:5475-5478.
[16] Briguori C,Sarais C,Pagnotta P,et al. In-stent restenosis in small coronary arteries:Impact of strut thickness. J Am Coll Cardiol,2002,40:403-409.
[17] Pache J,Kastrati A,Mehilli J,et al. Intracoronary stenting and angiographic results:Strut thickness effect on restenosis outcome(ISAR-STEREO-2)trial. J Am Coll Cardiol,2003,41:1283-1288.

