新型生物全降解药物释放支架对小型实验猪冠状动脉内膜的影响
贺素媛 李虎 任珊 郑晓新 冯高科 易欣 李晓艳 蒋学俊
近年来,随着人们生活水平的提高和改善,心血管疾病的发病率也越来越高,并且越来越年轻化,冠状动脉粥样硬化性心脏病(冠心病)已逐渐成为影响人们生活质量的一大难题。自从1987 年Sigwart等[1]成功实施了第一例冠状动脉支架术后,支架置入术渐渐成为临床上治疗冠心病的主要手段之一。支架置入术的发展先后经历了裸金属支架置入术及药物洗脱支架(DES)置入术等阶段。目前支架内再狭窄(in-stent restenosis,ISR)仍是困扰心血管工作者的难题,虽然抗增殖药物应用于支架技术使支架内再狭窄的发生率由经皮冠状动脉腔内血管成形术(PTCA)时代的30% ~45% 下降到DES 时代的10%以下[2-3]。然而,由于抗增殖药物在抑制内膜增生的同时亦引起支架置入部位血管内皮化过程延迟,导致内皮化不全,由此引起晚期支架血栓发生率升高至0.7%,因此仍应受到重视[4]。此外,由于现有DES 为金属支架,其本体无可降解特性,因此,其长期安全性及有效性受到挑战。生物可降解支架的研发为冠心病介入治疗提供了新的策略,其支架本体由可降解或可吸收材料构成,置入冠状动脉血管后经过一段时间最终实现体内降解,可起到短期内支撑血管、防止血管再狭窄的作用,同时避免金属支架永久留存所带来的并发症。尽管生物全降解支架前景光明,但其目前仍处于研发阶段。本实验旨在探讨新型生物全降解药物释放支架置入冠状动脉后对于置入部位血管内膜的影响。
资料与方法
一、资料与试剂
1. 支架:本研究对照组所采用的普通聚左旋乳酸(PLLA)支架与实验组采用的新型生物全降解支架均由美国的Vasotech,Inc. 公司自主研发提供,支架规格为:3.0 mm×13.0 mm,对照组以PLLA 作为本体材料并融入抗增殖药物紫杉醇构成,实验组以PLLA 与无定型磷酸钙(amorphous calcium phosphate,ACP)构建纳米颗粒做为本体材料(PLLA/ACP),同样将抗增殖药物紫杉醇融入支架材料本体中构成。见图1。

图1 新型生物全降解药物支架
2. 动物:健康小型实验猪10 只,雌雄各半,体重(30 ±5)kg。将实验动物随机分为对照组(5 只)及实验组(5 只),术前常规喂养,于术前5 天给予口服氯吡格雷75 mg/d 及阿司匹林100 mg/d。动物喂养及实验过程遵照武汉大学人民医院动物伦理委员会相关规定执行。
3. 主要试剂:C 反应蛋白(CRP)免疫吸附试验试剂盒购自美国RB 生物公司。核因子-κB(NFκB)抗体免疫组化试剂盒及α-平滑肌肌动蛋白(α-SM-actin)单克隆抗体购自北京博奥森生物技术有限公司。
二、方法
1. 支架置入术:实验动物术前禁食12 h,以氯胺酮10 mg/kg、东莨菪碱0.3 mg 及咪达唑仑注射液2 mg 耳后肌内注射进行诱导麻醉。术中以0.9%氯化钠注射液200 ml +丙泊酚注射液200 mg +氯胺酮注射液200 mg 静脉滴注维持麻醉。直视下逐层分离右侧股动脉,置入6 F 动脉鞘同时给予肝素6000 U。分别行正中位、左前位及右前位冠状动脉造影后,随机选取左前降支、左回旋支或右冠状动脉置入PLLA 支架或PLLA/ACP 支架,以10 ~14 atm(1 atm=101.325 kPa)撑开支架,持续20 ~30 s 后释放,退出球囊后再次行冠状动脉造影,未见血管夹层及血栓。支架置入术后逐层缝合切口,并给予食饲氯吡格雷75 mg/d、阿司匹林325 mg/d 至实验终点,术后每日给予青霉素200 万U 肌注预防感染,连续3 d。
2. 血液学检测:分别在术前和术后28 d 取实验动物股动脉血,采用免疫吸附法检测血清中的CRP浓度。
3. 病理形态学检查
(1)苏木精-伊红(HE)染色:术后4 周复查冠状动脉造影后处死实验动物,迅速取出心脏以0.9%肝素生理盐水高压灌注至灌流液清亮,再以10%甲醛溶液高灌注至心脏组织完全固定。分离支架置入部位血管并以石蜡包埋切片,行HE 染色,镜下观察置入部位血管有无血栓形成。每张切片取五个视野,在400 倍显微镜下计数淋巴细胞个数,并以炎症积分标准评估其炎症情况:0 分=无内膜炎症;1 分=散在炎性细胞;2 分=25% ~50%血管周径内支架被炎症细胞包绕50%,3 分=25% ~50%血管周径内支架被炎症细胞全部包绕[5]。并使用计算机图像分析系统(Image Pro Plus 6.0)测定计算以下指标:HE 染色切片(×40)新生内膜面积(外弹力板围绕面积-残余管腔面积)、管腔面积及面积狭窄百分比(新生内膜面积/外弹力板围绕面积×100%)。
(2)免疫组化检测:冠状动脉标本经石蜡包埋后用SP 法(具体方法依据试剂盒说明进行)检测NF-κB、α-SM-actin 抗体,并用微波进行抗体修复。NF-κB 抗体:使用计算机图像分析系统测定,用图像分析仪于高倍镜(×400)下在每张切片取五个视野进行计数阳性细胞及平均阳性细胞百分率,取其平均值。α-SM-actin 抗体:使用计算机图像分析系统测定计算免疫组织化学α-SM-actin 染色切片(×200)平均光密度值。
4. 统计学分析:实验数据采用SPSS 17.0 软件进行统计分析,计量资料用 珋x ±s 表示,两组间及组内自身前后差异比较采用t 检验,以P <0.05 为差异有统计学意义。
结 果
1. 一般情况:所有实验动物均正常存活至实验结束。实验组与对照组实验动物行冠状动脉支架置入术后对动物觅食、活动等一般情况无影响。
2. 造影结果:支架置入术后即刻及术后4 周行冠状动脉造影复查,均可见支架置入血管管腔通畅,TIMI 血流达3 级,无急性及慢性支架血栓形成,且无明显管腔狭窄。实验组与对照组无差别。见图2。
3. 血液学检测结果:免疫吸附法检测CRP 浓度显示,术前与术后血液中CRP 浓度比较,对照组[(688.56 ± 128.91)ng/ml 比(757.19 ± 104.46)ng/ml,P >0.05]和实验组[(704.12 ± 142.46)ng/ml比(773.27 ±110.18)ng/ml,P >0.05]差异无统计学意义。两组术后CRP 比较亦无统计学意义[(757.19 ± 104.46)ng/ml 比(773.27 ± 110.18)ng/ml,P >0.05]。
4. HE 染色:(1)炎症反应:支架置入术后4 周,置入部位血管HE 染色切片40 倍显微镜下观察可见:置入部位管腔通畅,未见支架血栓形成,且血管管腔结构正常完整,支架小梁完整,小梁上内皮覆盖完整。病理切片可见:与对照组相比,实验组淋巴细胞数(27.32 ± 1.50 比54.12 ± 3.99,t = 14.06,P <0.05)及炎症积分(1.04 ±0.17 比2.08 ±0.23,t =8.13,P <0.05)明显降低,即实验组炎症反应明显降低。见图3。(2)内膜增生:实验组与对照组支架新生内膜面积[(2.10 ±0.75)mm2比(2.07 ±0.28)mm2,P >0.05]及 面 积 狭 窄 百 分 比[(54.78 ±14.21)%比(53.52±13.85)%,P >0.05]差异均无统计学意义,即实验组支架未引起置入部位血管内膜显著增生。见图4。
5. 免疫组织化学检查结果:(1)NF-κB 免疫组化染色:以免疫组织化学方法检测NF-κB 阳性细胞数,阳性细胞主要分布在血管内皮及内膜的细胞核内,呈棕黄色颗粒。实验组阳性细胞百分比表达明显降低(25.28% ± 0.68% 比44.02 ± 0.95%,t =32.12,P <0.05)。(2)α-SM-actin 免疫组织化学染色:以免疫组织化学技术特异性检测α-SM-actin 阳性光密度值,评估支架置入部位血管平滑肌细胞增殖情况。两组α-SM-actin 免疫组织化学染色平均光密度值相比,差异无统计学意义(1.71% ±0.87%比1.71 ±0.86%,P >0.05)。两组中α-SM-actin 染色阳性细胞多位于血管中膜,血管内膜少见,说明两组均无平滑肌细胞明显内迁,且实验组支架未引起置入部位平滑肌细胞明显增生。见图5。
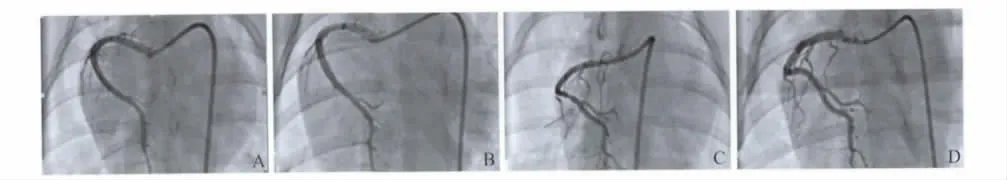
图2 实验组与对照组支架置入后即刻及28 d 后造影结果

图3 术后两组置入部位血管HE 染色结果

图4 术后两组置入部位血管HE 染色
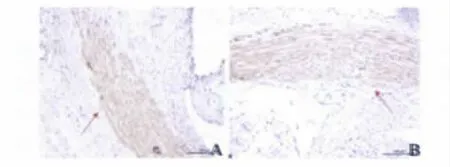
图5 两组术后4 周置入部位α-SM-actin 免疫组织化学染色
讨 论
在冠心病的治疗历程中,DES 的应用是冠心病介入治疗的里程碑之一,其通过携带抗增殖药物,抑制局部平滑肌增殖、迁移及分泌细胞外基质,减少血管内膜过度增生,从而使支架内再狭窄率显著降低[6]。然而,随着临床的应用和研究的进展,DES的弊端也不断暴露,比如其释放模式并不理想,涂层的抗增殖药物在抑制平滑肌增殖的同时也抑制了内皮的修复,从而增加了术后血栓的发生率。药物洗脱后残留的涂层和金属支架本体也容易引起局部炎症反应,延迟内皮愈合,从长远来看并没有降低冠心病心肌梗死的再发率和死亡率[7]。
以聚合物为代表的各种生物全降解支架的出现,有望解决此问题。PLLA 生物材料因其良好的可吸收性及组织相容性,被美国食品药品管理局(FDA)列为可应用于人体的生物工程材料,成为目前最为常用的生物可降解支架的构建材料。PLLA在自然状态下降解速度较慢,完全降解需要2 年左右,且其在生物体内降解的最终产物为对机体无明显毒性的二氧化碳和水[8],因此,PLLA 本身的降解特性即决定了其可以在完成支架早期支撑血管、避免血管急性闭塞及防止再狭窄的作用后,在一定的时间内实现生物体内逐步无害化完全降解,从而避免了支架本身作为一种异物长期存在于病变血管内刺激血管平滑肌细胞增殖,或是支架长期存留触发持续的炎症反应进而导致内膜过度增生及再狭窄形成[9]。
然而,PLLA 构建生物可降解支架应用于临床医疗决策仍存在亟待解决问题。如其在降解过程中可诱发置入部位血管明显的炎症反应[10]。Vogt等[11]观察到,PLLA 生物可降解支架在降解过程中,支架周围有慢性炎症细胞聚集,且通常伴有炎症反应及细胞增殖速度加快。而炎症反应在血管成形术或支架置入术后再狭窄的发生中起关键作用。Kornowski 等[12]观察接受冠状动脉支架置入术的猪证实,炎症反应与内膜增生显著相关,而炎症反应亦与冠状动脉支架置入术后粥样斑块撕裂及血管壁损伤相关。因此,减轻PLLA 降解中产物所诱发的炎症反应程度,逐步成为目前生物降解材料研发的重点之一。
本研究所采用的新型生物全降解支架是由PLLA 与ACP 通过纳米颗粒技术制成并将抗增殖药物紫杉醇融入支架本体而构成的新型生物材料。
紫杉醇是1988 年美国FDA 正式批准用于临床的新型抗肿瘤药物,通过作用于细的微管功能抑制G1/G0和G1/M 期的细胞复制来抑制细胞的增生[13-15],将紫杉醇融入支架本体中可实现药物缓慢释放及高度可控,可能获得既抑制平滑肌细胞增殖,又不会对内膜产生明显损害的作用,有望解除原有DES 对血管内皮和平滑肌双重抑制的弊端[16-17]。
ACP 是采用湿化学法合成羟基磷灰石时出现的磷酸钙的一种无定形中间相,它短暂存在于合成羟基磷灰石的过程中,在水溶液中不稳定[18]。有文献报道,在生物可降解材料中加入ACP 可中和生物材料降解过程中产生的酸性产物,进而可减少由酸性产物所引起的无菌性炎症反应[19]。此外,ACP 尚有利于药物的传递释放及增加支架的机械性能[20-22],使紫杉醇可以更好地抑制平滑肌的增殖以减少局部的炎症反应和冠状动脉的再狭窄。ACP的这些优点为本实验研究提供了丰富的理论基础。
1. 炎症反应:炎症反应在动脉粥样硬化的发生和发展中起着关键的作用,冠状动脉粥样硬化性心脏病其实是一种炎症性疾病,同时炎症反应又是促进冠状动脉支架置入术后新生内膜增生和再狭窄的原因之一[22]。因此,减轻或消除炎症反应是减少支架置入术后再狭窄的关键。CRP 是机体高度灵敏的炎症指标,是在机体受到严重炎症损伤时由白介素(IL)-6 调控,肝合成入血的急性相关蛋白,CRP的升高与炎症反应密切相关。本实验术后4 周血液中CRP 浓度比较结果显示,实验组与对照组术前、术后28 d CRP 浓度比较差异均无统计学意义,两组28 d 后相比,CRP 浓度差异亦无统计学意义,说明支架置入后都没有引起明显的炎症反应。NF-κB 作为一种能调控多种基因的具有多种效应的转录因子,已被证实当局部炎症反应较明显时,其表达也会增强。此外,NF-κB 参与动脉粥样硬化、血管成形术后再狭窄和其他血管增殖性病变等病理生理过程。因此,支架置入部位NF-κB 的表达反应是评价其局部炎症情况的重要指标。免疫组化检测显示,实验组NF-κB 表达数明显少于对照组,且HE 染色显示,实验组支架置入部位炎性细胞明显少于对照组。可见实验组术后在一定程度上减轻了局部的炎症反应,优于对照组,具有良好的组织相容性。
2. 内膜增生:基于既往的研究报道,减轻炎症反应可有一定的抑制内膜增生的作用,因此,据此推测,加入ACP 的新型全降解支架可能通过抑制炎症反应而抑制内膜增生。此外,Kim 等[23]报道ACP 在与细胞接触时具有更好的细胞黏附性,同时可减少细胞凋亡并促进细胞增殖及迁移,因此,ACP 材料的加入除可减轻PLLA 支架降解过程中诱发的炎症反应外,还具有促进内皮细胞增殖及支架置入部位血管内皮化,减少支架晚期血栓发生的可能。然而,加入ACP 的PLLA 支架在促进内皮细胞增殖的同时,是否同样促进血管平滑肌细胞过度增殖而导致内膜过度增生,进而升高再狭窄发生率,目前尚无明确报道。
既往研究表明,α-SM-actin 血管平滑肌细胞来源的标志,其表达增多通常提示血管平滑肌细胞增殖,同时亦提示平滑肌细胞增殖及迁移可能。本研究表明,加入ACP 的PLLA 支架与普通PLLA 支架相比,α-SM-actin 的平均光密度值无明显增高,该结果证实,加入ACP 材料并不会促进血管平滑肌细胞的增殖,且观察发现,实验组α-SM-actin 阳性细胞表达多位于血管中膜部位,而内膜及新生内膜部位表达不明显,说明实验组支架未引起明显平滑肌细胞迁移。同时实验组与对照组在血管内膜增生厚度方面,虽实验组置入部位的血管内膜稍有增生,但两组相比差异同样无统计学意义,该结果也证实加入ACP 材料亦无导致内膜明显增生的可能。因此,基于本研究结果,加入ACP 的PLLA 支架虽不能明显减轻,但亦不会导致置入部位血管内膜增生及平滑肌细胞增殖及迁移。该结论可能与支架材料构建过程中PLLA 与ACP 的合成配比有关,ACP 材料本身虽能在一定程度上减轻由PLLA 降解所引起的无菌性炎症反应,促进内皮细胞增殖及内皮化过程,但同样可能在一定程度上促进平滑肌细胞增殖及内膜增生,因而两种效应叠加最终并未对置入部位血管内膜增生产生明显不良影响。
综上所述,初步证实采用特殊纳米技术加入ACP 的新型生物全降解药物释放支架具有良好的组织相容性。动物实验证实,其可以明显减轻置入部位无菌性炎症反应,且不会导致血管平滑肌细胞明显增生及迁移。该新型生物全降解药物释放支架的研发为冠心病介入治疗策略提供了新思路。
但本研究动物样本量较少,观察时间点较为单一,观察时间较短(28 d),且尚未从细胞及分子水平研究加入ACP 的新型生物可降解支架影响血管内膜增生及平滑肌细胞增殖的作用机制。然而基于本研究的初步结果,样本量更大、术后观察时间更长、涉及内膜增生及平滑肌细胞增殖的分子生物学机制的研究已经进行。另外,针对支架材料构建过程中,ACP 和PLLA 的合成配比、其与血管内膜增生及平滑肌细胞增殖的相关性研究,也将是未来研究的重点之一。
[1] Sigwart U,Puel J,Mirkovitch V,et al. Intravascular stents to prevent occlusion and restenosis after transluminal angioplasty. N Engl J Med,1987,316:701-706.
[2] Szygula J,Puzio B,Poloński L. Restenosis after percutaneous coronary angioplasty--cause,prevention strategies. Wiad Lek,1998,51:76-81.
[3] Moses JW,Leon MB,Popma JJ,,et al. Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery. N Engl J Med,2003,349:1315-1323.
[4] Iakovou I,Schmidt T,Bonizzoni E,et al. Incidence,predictors,and outcome of thrombosis after successful implantation of drugeluting stents. JAMA,2005,293:2126-2130.
[5] Schwartz RS,Huber KC,Murphy JG,et al. Restenosis and the proportional neointimal response to coronary artery injury:results in a porcine model. J Am Coll Cardiol,1992,19:267-274.
[6] Kraitzer A,Kloog Y,Zilberman M. Approaches for prevention of restenosis. J Biomed Mater Res B Appl Biomater,2008,85:583-603.
[7] Finn AV,Nakazawa G,Joner M,et al. Vascular responses to drug eluting stents:importance of delayed healing. Arterioscler Thromb Vasc Biol,2007,27:1500-1510.
[8] 肖越勇,张金山,崔福斋,等. 新型生物可降解高分子支架.中国医疗器械信息,2004,10:12-14.
[9] Kster R,Vieluf D,Kiehn M,et al. Nickel and molybdenum contact allergies in patients with coronary in-stent restenosis.Lancet,2000,356:1895-1897.
[10] Commandeur S,van Beusekom,van der Giessen WJ. Polymers,drug release,and drug-eluting stents. J Interv Cardiol,2006,19:500-506.
[11] Vogt F,Stein A,Rettemeier G,et al. Long-term assessment of a novel biodegradable paclitaxel-eluting coronary polylactide stent.Eur Heart J,2004,25:1330-1340.
[12] Kornowski R,Hong MK,Tio FO,et al. In-stent restenosis:contributions of inflammatory responses and arterial injury to neointimal hyperplasia. J Am Coll Cardio,1998,31:224-230.
[13] Farb A,Heller PF,Shroff S,et al. Pathological analysis of local delivery of paclitaxel via a polymer-coated stent. Circulation,2001,104:473-479.
[14] Sollott SJ,Cheng L,Pauly RR,et al. Taxol inhibits neointimal smooth muscle cell accumulation after angioplasty in the rat. J Clin Invest,1995,95:1869-1876.
[15] Axel DI,Kunert W,Gggelmann C,et al. Paclitaxel inhibits arterial smooth muscle cell proliferation and migration in vitro and in vivo using local drug delivery. Circulation,1997,96:636-645.
[16] Li H,Zhong H,Xu K,et al. Enhanced efficacy of sirolimuseluting bioabsorbable magnesium alloy stents in the prevention of restenosis. J Endovasc Ther,2011,18:407-415.
[17] Patel HJ,Su SH,Patterson C,et al. A combined strategy to reduce restenosis for vascular tissue engineering applications.Biotechnol Prog,2006,22:38-44.
[18] 李延报,李东旭,翁文剑. 无定形磷酸钙及其在生物医学中的应用. 无机材料学报,2007,22:775-782.
[19] Imai Y,Fukuzawa A,Watanabe M. Effect of blending tricalcium phosphate on hydrolytic degradation of a block polyester containing poly(L-lactic acid)segment. J Biomater,1999,10:773-786.
[20] 彭文娟,宋国君,汪学军,等. 纳米羟基磷灰石/左旋聚乳酸纳米纤维复合支架的制备与表征. 科学技术与工程,2008,8:4287-4291.
[21] Kona S,Specht D,Rahimi M,et al. Targeted biodegradable nanoparticles for drug delivery to smooth muscle cells. J Nanosci Nanotechnol,2012,12:236-244.
[22] Takayama T,Todo M, Takano A. The effect of bimodal distribution on the mechanical properties of hydroxyapatite particle filled poly(L-lactide)composites. J Mech Behav Biomed Mater,2009,2:105-112.
[23] Kim I,Kim HJ,Kim HM. Array of amorphous calcium phosphate particles improves cellular activity on a hydrophobic surface. J Biomed Mater Res B Appl Biomater,2010,93:113-121.

