前降支开口病变经皮冠状动脉介入治疗两种不同术式的临床结果观察
莫海亮 吴铿 游琼 何松坚 李上海
开口处病变是指距冠状动脉开口3 mm 范围内的病变,前降支(LAD)开口病变(O-LAD)位于与左主干(LM)、回旋支(LCX)的分叉处,手术难度大、风险高,支架血栓(ST)、支架内再狭窄(ISR)发生率高,相关机制也较为复杂,与血流动力学因素及剪切力密切相关,而血流动力学改变与手术方式有关。目前单纯O-LAD 的经皮冠状动脉介入治疗(PCI)术式主要有两个,前降支支架精确定位术和支架贯穿左主干和前降支术(cross-over),但就其手术的安全性和远期效果两者前瞻性对照研究报道不多。Sung等[1]小样本对比分析及高展等[2]对O-LAD 介入治疗病例进行回顾性分析均显示较好的有效性和安全性,cross-over 有更强的可操作性和降低支架内再狭窄的趋势,但终点事件主要心脏不良事件(MACE)包括死亡、PCI 术后再发心肌梗死、靶血管重建率差异无统计学意义,为进一步了解两种术式的效果,我们于2009 年至2012 年进行随机、前瞻性对照研究,现分析报道如下。
对象与方法
1. 病例选择:选择2009 年10 月至2010 年10月在广东医学院附属医院心内科住院患者87 例,男66 例,女21 例,年龄41 ~75 岁,平均年龄(61.9 ±8.3)岁,经冠状动脉造影证实为O-LAD 并符合PCI指征。入选标准:所有入选病例均为非ST 段抬高急性冠脉综合征患者,狭窄≥70%。排除标准:LM 粗短,长度<10 mm,直径>5 mm;LAD 与LCX 夹角<60°或有粗大的中间支(≥2.0 mm)或LM 与LAD 管径差>1 mm;LAD 近中远段及LCX、右冠状动脉中重度狭窄并需要介入治疗;左主干病变、多支血管病变,急、慢性闭塞病变,心功能Ⅳ级,肝、肾功能不全等。经患者和家属知情同意后,根据随机数字表随机分为A 组(cross-over 术式组)44 例和B 组(前降支支架精确定位术组)43 例,两组患者基本资料对比情况见表1。
O-LAD 判定:常规取右前斜加足位30°和蜘蛛位造影(必要时加正足位或右前斜加头位),将前降支距其开口3 mm 范围内的病变定为O-LAD,并测量LAD 与LCX 夹角,同时观察LCX 开口及LM 是否受累。
2. 方法:均为择期PCI。术前术后按指南使用氯吡格雷(首次负荷量300 mg/d,之后75 mg/d,至少18 个月)与阿司匹林(100 mg/d)等药物。PCI 过程:常规经桡动脉途径,如经桡动脉途径失败改经肱动脉途径;常规切割球囊预扩张LAD 开口病变,按常规方法[3]行单支架置入术,术式分为cross-over(A组)和O-LAD 精确定位术(B 组),两组均置入Firebird 2 支架(上海微创),因是LAD 开口病变,故测量病变远端正常血管直径为参考血管直径,支架释放压力达到膨胀充分贴壁,支架完全覆盖病变,达到正常。
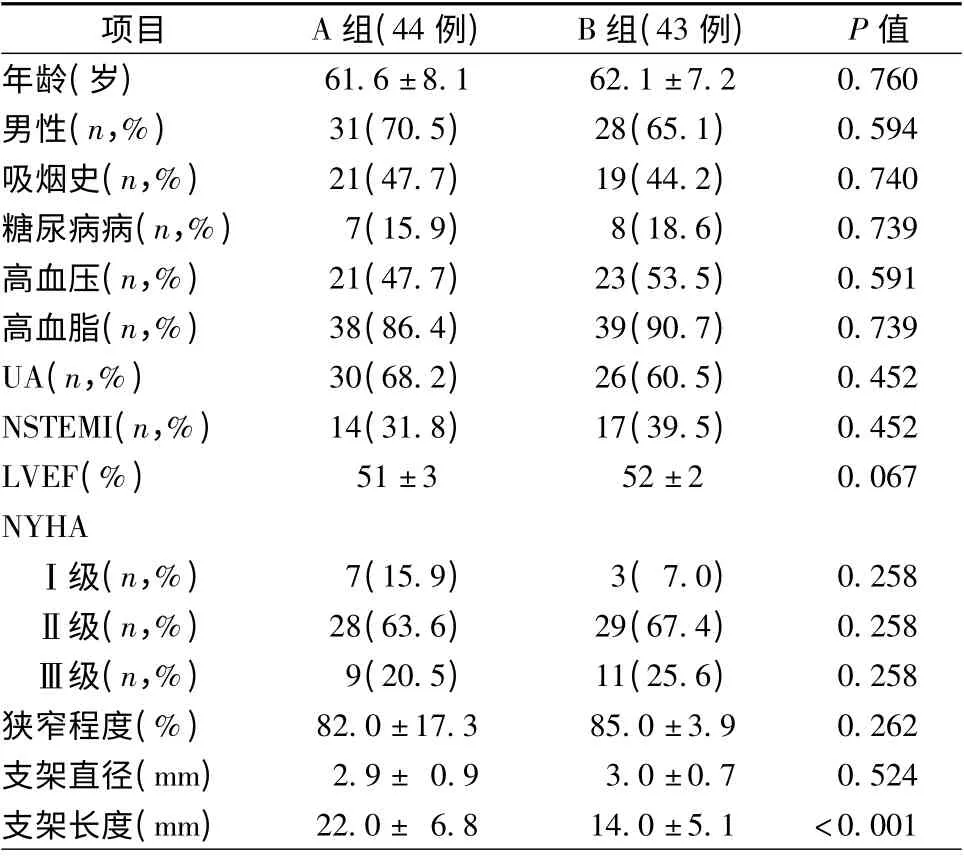
表1 87 例入选患者基线资料比较
3. 疗效判定标准和研究终点:支架置入成功是指支架完全覆盖靶病变并充分扩张至残余狭窄<20%,支架完全覆盖靶病变,LAD 开口无内膜撕裂、夹层;18 个月主要研究终点:MACE,包括心源性死亡、PCI 术后再发心肌梗死、靶血管血运重建率、心绞痛、心功能不全(NYHA Ⅲ~Ⅳ级)、再次住院;次要研究终点包括术后即时TIMI 血流、LCX 开口受累、术后肌钙蛋白I(cTnI)变化、支架血栓、支架内再狭窄。
根据研究目的,对两组随访18 个月的MACE进行生存分析,选取PCI 术为起始事件,手术当天为研究起点,MACE 为终点事件,终点时间为18 个月。支架血栓定义:急性(PCI 后24 h 内发生)、亚急性(PCI 后24 h ~30 d 内发生),晚发(PCI 后30 d ~1 年);支架内再狭窄定义为以节段内再狭窄为标准,包括支架内及支架近端、远端两个边缘5 mm 范围内的再狭窄,狭窄程度≥50%。
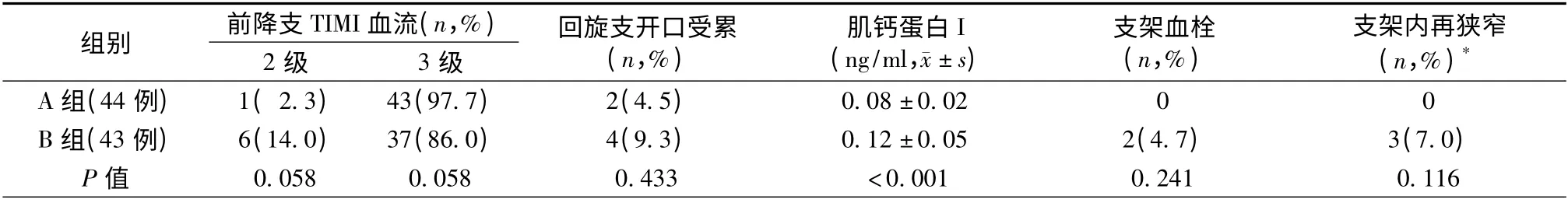
表2 87 例患者PCI 术后疗效对比
4. 随访:术后1、3、6、12、18 个月为随访窗口期,随访方法、内容:(1)门诊及电话随访;(2)术后1、3、6、12、18 个月常规复查心电图;(3)术后3 个月及18 个月复查心脏彩超,由指定的经验丰富医师测量射血分数值;(4)6 ~12 个月复查冠状动脉造影(CAG);(5)如有病情变化,临床评估为急性冠脉综合征,立即予相应处理和再次PCI;(6)登记并统计术后支架血栓、支架内再狭窄及MACE。
5. 统计学分析:采用统计软件SAS 8.0 版处理数据。计数资料的比较采用χ2检验,视检验条件分别采用不同公式或Fisher 精确概率法;计量资料比较采用t 检验,预后随访采用Kaplan-Meier 生存分析,P <0.05 为差异有统计学意义。
结 果
1. 技术对比:A、B 两组球囊数量差异无统计学意义,但对比剂总量[(91 ±12)ml 比(136 ±17)ml,P <0.05]与PCI 耗时[(31 ±6)min 比(50 ±11)min,P <0.05]比较差异有统计学意义。
2. 疗效对比(表2):所有病例成功施行手术并完成随访。在肌钙蛋白I(cTnI)指标,A 组明显优于B 组;在TIMI 血流,两者相比无统计学意义,但A 组LAD 有更好的血流灌注趋势;术后18 个月的随访期内支架血栓和再狭窄B 组有增加趋势。LCX 开口轻度受累A 组2 例,B 组4 例,TIMI 血流均为3级,未予干预;另外,LCX 开口重度受累狭窄B 组1例,TIMI 血流2 级,予相应球囊对吻扩张后LCX 开口狭窄消失,TIMI 血流恢复3 级,两组比较差异无统计学意义。只有B 组发生了支架血栓,其中亚急性、晚发血栓导致急性心肌梗死各1 例,均予再次成功血运重建。共有61 例(70.1%)患者在6 ~12 个月随访期内复查了冠状动脉造影,A 组32 例,B 组29 例,经造影核实支架内再狭窄分别为0 例和3 例(7.0%)(P >0.05),部位在O-LAD,均予再次PCI治疗成功,这3 例患者再随访1 年并造影复查,未再发生支架血栓及再狭窄。
3. 3 个月随访查左心室射血分数(LVEF)值,A、B 组分别为(54 ±3)%、(52 ±2)%,差异无统计学意义(P =0.180);18 个月随访查LVEF 值,A、B组分别为(60 ±2)%、(58 ±4)%,差异有统计学意义(P=0.003);18 个月随访结束时,A、B 两组总的终点事件MACE 分别为:2 例(4.5%)和8 例(18.6%),差异有统计学意义(P <0.05),其中终点事件中心功能不全(NYHA Ⅲ~Ⅳ级)、心绞痛发生、PCI 术后再发心肌梗死、再住院的发生率差异有统计学意义(P <0.05),而PCI 术后再发心肌梗死差异无统计学意义(图1);两组均无心源性死亡,差异无统计学意义(P >0.999)。
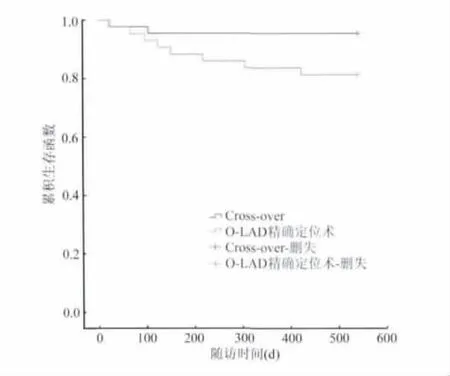
图1 PCI 两种不同术式对MACE 预后生存曲线
讨 论
本研究结果显示:(1)两种术式技术对比:crossover 术式组比前降支支架精确定位术组的对比剂及PCI 耗时少,更简便易行,明显优于后者;(2)两种术式疗效对比:cross-over 术式在cTnI 指标方面明显优于支架精确定位,在TIMI 血流前降支冠状动脉有更好的血流灌注趋势,而支架血栓和再狭窄在前降支支架精确定位术组有增加趋势;(3)两种术式LVEF、MACE 对比:两者均无死亡病例,但前降支支架精确定位术组PCI 术后再发心肌梗死有增加趋势;3 个月时LVEF、心功能不全差异无统计学意义,但在18 个月时有差异有统计学意义(P <0.05);两组总的终点事件MACE 的发生率差异有统计学意义(P <0.05),而且心绞痛、PCI 术后再发心肌梗死、再住院的差异均有统计学意义(P <0.05)。综上所述,cross-over 优于O-LAD 精确定位术。
分析以上结果差异原因,可能为:(1)支架血栓的危险因素与病变特点、介入操作及支架等因素有关,其中急性、亚急性支架血栓多与球囊挤压、扩张损伤动脉等操作因素有关,晚期及极晚期支架血栓被认为与支架贴壁不良、药物支架延迟内皮化等有关[4]。Cross-over 手术方式操作简单、机械性血管损伤较少,支架覆盖左主干至前降支近端病变,避免了支架释放时对LM、LCX 血管的损伤;(2)Ccross-over使LM 至LAD 的血流更为管道化、线性化,减少血流剪切力,避免了单纯在O-LAD 置入支架而LM 无支架稳定支撑引起的过度扭力和梯度剪切力,从而减少血管内皮细胞的损伤,减轻血小板激活、黏附聚集,避免支架血栓和ISR[5]。Koichi 等报道[6]两种术式对比显示临床疗效差异无统计学意义。本研究结果与之不同,对比分析原因发现:(1)在MACE(死亡、血运重建、PCI 术后再发心肌梗死),前者为多中心注册研究,这可能导致入选偏差较大;(2)评估指标主要是临床硬终点(死亡、血运重建、心肌梗死),实验室评估和复查造影等缺乏,例如术后疗效cTnI,超声心动图测定LVEF,而本研究着重以上检测可能更精细全面,研究更易发现差异。本研究结果提示cross-over 术式更为简便和临床疗效更为优越。但本研究入选病例数较少是其不足,尚需更大规模的临床研究支持。
[1] Sung LC,Wang JH,Chen YC. One-year Results of paclitaxel -eluting stent implantation in ostial lesions of the left anterior descending Artery. Acta Cardiol Sin,2009,25:76-84.
[2] 高展,杨跃进,陈纪林,等. 药物洗脱支架精确定位与贯穿左冠状动脉主干治疗冠状动脉前降支口部病变的对照、研究.中华心血管病杂志,2008,36:113-117.
[3] Sidney CS,James TD,Alice KJ,et al. ACC/AHA guidelines for percutaneous coronary intervention. J Am Coll Cardiol,2001,37:2215-2238.
[4] Nakazawa G,Finn AV,Vorpahl M,et al. Coronary responses and differential mechanisms of late stent thrombosis attributed to firstgeneration sirolimus and paclitaxel-eluting stents. J Am Coll Cardiol,2011,57:390-398.
[5] Koskinas KC,Chatzizisis YS,Antoniadis AP,et al. Role of endothelial shear stress in stent restenosis and thrombosis:pathophysiologic mechanisms and implications for clinical translation. J Am Coll Cardiol,2012,59:1337-1349.
[6] Koichi Kishi,Takeshi Kimura, Takeshi Morimoto,et al.Sirolimus-Eluting Stent Implantation for Ostial Left Anterior Descending Coronary Artery Lesions Three-Year Outcome From the j-Cypher Registry. Circ Cardiovasc Interv,2011,4:362-370.

