前列腺癌患者内分泌治疗后代谢异常及生活质量的评价
袁佳奇,徐 涛,张晓威,王晓峰
北京大学人民医院泌尿外科,北京 100044
近年来,随着生活水平的提高和饮食结构的变化,中国男性前列腺癌的发病率显著升高[1]。自Huggins等[2]于1941年证实前列腺癌的雄激素依赖性开始,历经70余年的发展,以雄激素阻断治疗(androgen deprivation therapy,ADT)为代表的内分泌治疗,现已广泛用于局限性或转移性前列腺癌的治疗。贫血、骨质疏松和肠易激综合征是内分泌治疗的副作用之一。本研究旨在比较不同内分泌治疗方案对贫血相关指标、骨密度 (bone mineral density,BMD)和胃肠道功能的影响。
对象和方法
对象 选取2008年9月至2010年9月就诊于北京大学人民医院的125例前列腺癌患者,年龄58~84岁,平均 (72±6)岁。全部患者由针刺活检病理学诊断为局限性前列腺腺癌,无远处转移证据。患有原发性性腺功能减退、慢性萎缩性胃炎、炎症性肠病、消化性溃疡、胃食管反流病、胃肠道恶性肿瘤、造血系统疾病、甲状腺功能异常、甲状旁腺功能异常、代谢性骨病、Cushing综合征及因病长期服用类固醇激素类药物的患者,均未入选。入组患者均为高龄人群,多伴有心肺基础病等内科合并症,接受根治性治疗风险较高,遂行内分泌治疗。
方法 52例患者接受双侧睾丸切除术、73例接受最大限度雄激素阻断治疗 (maximal androgen blockage,MAB),即醋酸戈舍瑞林 (Goserelin,中文名:诺雷德,注册证号:X19990231,生产厂商:Zeneca Limited,U.K.)皮下注射3.6mg/月 +比卡鲁胺 (Bicalutamide,中 文 名:康 士 得, 注 册 证 号:X19990358,生产厂商:Zeneca GmbH,Germany)口服50 mg/d,连续治疗至少12个月。全部患者于治疗前及治疗开始12个月后检测血清总睾酮 (total testosterone,TT)、游离睾酮 (free testosterone,FT)、前列腺特异性抗原 (prostate specific antigen,PSA)、血红蛋白 (hemoglobin,Hb)、红细胞计数 (red blood cell,RBC)、血细胞比容 (hematocrit,Hct)、平均红细胞体积 (mean corpuscular volume,MCV)、平均血红蛋白含量 (mean corpuscular hemoglobin,MCH)、平均血红蛋白浓度 (mean corpuscular hemoglobin concentration,MCHC)和红细胞分布宽度 (red blood cell distribution width,RDW),并评价贫血患病率及分型。采用双能X线吸收法,测定治疗前后的腰椎 (L2~4)及股骨颈BMD,以检测设备自带的5/98 B版本软件内设置的健康成年男性的BMD值 ()作为正常对照值,通过Z评分比较手术治疗组和MAB组与健康同年龄组BMD的差异程度,从而校正BMD值随年龄增加而出现的生理性降低以及性别和体重因素对观察结果的影响,Z评分=(BMD测定值-健康同年龄组预期值/健康同年龄组标准差),并以BMD低于正常值2.5个标准差以上作为骨质疏松的诊断标准。评价治疗前后的胃肠道功能评分 (gastrointestinal symptom rating scales,GSRS),并通过罗马Ⅲ标准下的成人功能性胃肠病诊断性问卷对肠易激综合征 (irritable bowel syndrome,IBS)进行诊断,即“腹痛或腹部不适在最近3个月内每个月发作至少3日,伴有排便频率改变、粪便性状改变、排便后症状改善中的2项或2项以上”。治疗期间,全部患者未接受血制品输注、重组人红细胞生成素、钙剂、双磷酸盐、胃肠动力药物和类固醇激素等治疗。
统计学处理 采用SPSS 17.0统计软件,计量资料均采用表示,同组内治疗前后差异比较采用配对t检验,组间差异性比较采用独立样本t检验,组间贫血、骨质疏松和发生率的比较采用卡方检验,数据间的相关性分析采用二元相关分析得出Pearson系数。P<0.05为差异具有统计学意义。
结 果
治疗前后各项指标变化 治疗开始前,单纯去势组和MAB组患者在血清 PSA、TT、FT、Hb、RBC、Hct、MCV、MCH、MCHC、RDW、BMD和GSRS评分方面差异均无统计学意义。与术前比较,去势组术后12个月的TT(P=0.0007)、FT(P=0.0003)、PSA(P=0.0006)、Hb(P=0.0001)、RBC(P=0.020)、Hct(P=0.016)、腰椎BMD评分 (P=0.008)及股骨颈BMD(P=0.004)评分均显著下降,GSRS评分(P=0.029)显著升高。与治疗开始前比较,MAB组治疗后 12个月的 TT(P=0.0008)、FT(P=0.0006)、PSA(P=0.0006)、Hb(P=0.0003)、RBC(P=0.0001)、Hct(P=0.0002)、腰椎BMD评分 (P=0.002)、股骨颈BMD评分 (P=0.0002)及RDW(P=0.045)均显著下降,GSRS评分 (P=0.010)显著升高。治疗开始12个月后,MAB组的TT(P=0.004)、FT(P=0.012)、PSA(P=0.007)、Hb(P=0.016)、腰椎Z评分 (P=0.033)及股骨颈Z评分 (P=0.015)均显著低于去势组,而GSRS评分 (P=0.027)显著高于去势组 (表1)。
代谢异常发生情况 治疗前后两组患者的贫血(P=0.006)、骨质疏松 (P=0.009)和IBS(P=0.022)的患病率差异均有统计学意义 (表2)。
激素水平与代谢指标的相关性 两组患者的血清睾酮水平与Hb、RBC、Hct及BMD呈正线性相关(P=0.039),与 GSRS评分呈负线性相关 (P=0.021);MAB患者的血清睾酮水平与RDW呈负线性相关 (P=0.044)(表3)。
讨 论
前列腺癌的发生发展与雄激素的相关性早已得到证实[1]。雄激素的分泌受到下丘脑和垂体的激素调节。下丘脑通过分泌促黄体激素释放激素 (luteinizing hormone releasing hormone,LHRH)促使垂体前叶分泌黄体生成素,后者作用于睾丸等器官,刺激睾酮的分泌[2-4]。ADT广泛用于局限性前列腺癌患者和前列腺根治性切除术后生化复发患者的治疗,通过阻断下丘脑-垂体-性腺 (睾丸)轴和肾上腺的雄激素分泌途径或抑制雄激素受体的生物学功能,极大降低血清雄激素浓度,限制肿瘤细胞生长。其中,双侧睾丸切除手术直接去除雄激素的主要分泌器官;LHRH类似物 (LHRH analogue,LHRH-a)可占据垂体表面的LHRH受体,减少黄体生成素的分泌,间接抑制睾丸的分泌功能;抗雄激素药物阻断雄激素与其受体的结合,剥夺雄激素的生物学功能。然而,青年男性的雄激素,90%来源于睾丸,10%来源于肾上腺;但在65岁以上男性,上述比例则分别为60%和40%;因而,单纯去势治疗的局限性愈发明显[3-4]。MAB包括去势和抗雄激素治疗两个环节,通过LHRH-a阻断雄激素来源,联合雄激素受体阻断剂抑制雄激素的生物学功能,同时阻断睾丸和肾上腺来源的雄激素[5]。因此,MAB所致血清雄激素水平的下降幅度与单纯手术去势相比更加显著,患者低雄
激素血症更为严重,性欲减退、贫血、骨质疏松、胰岛素抵抗、肥胖和代谢综合征等并发症的发生率和严重程度相对较高[6-9]。在评价肿瘤疗效的同时,ADT对患者生活质量的影响逐渐得到重视[1-3]。
表1 治疗前后各项评估指标的比较 ()Table 1 Indicators in two groups before and after treatment()
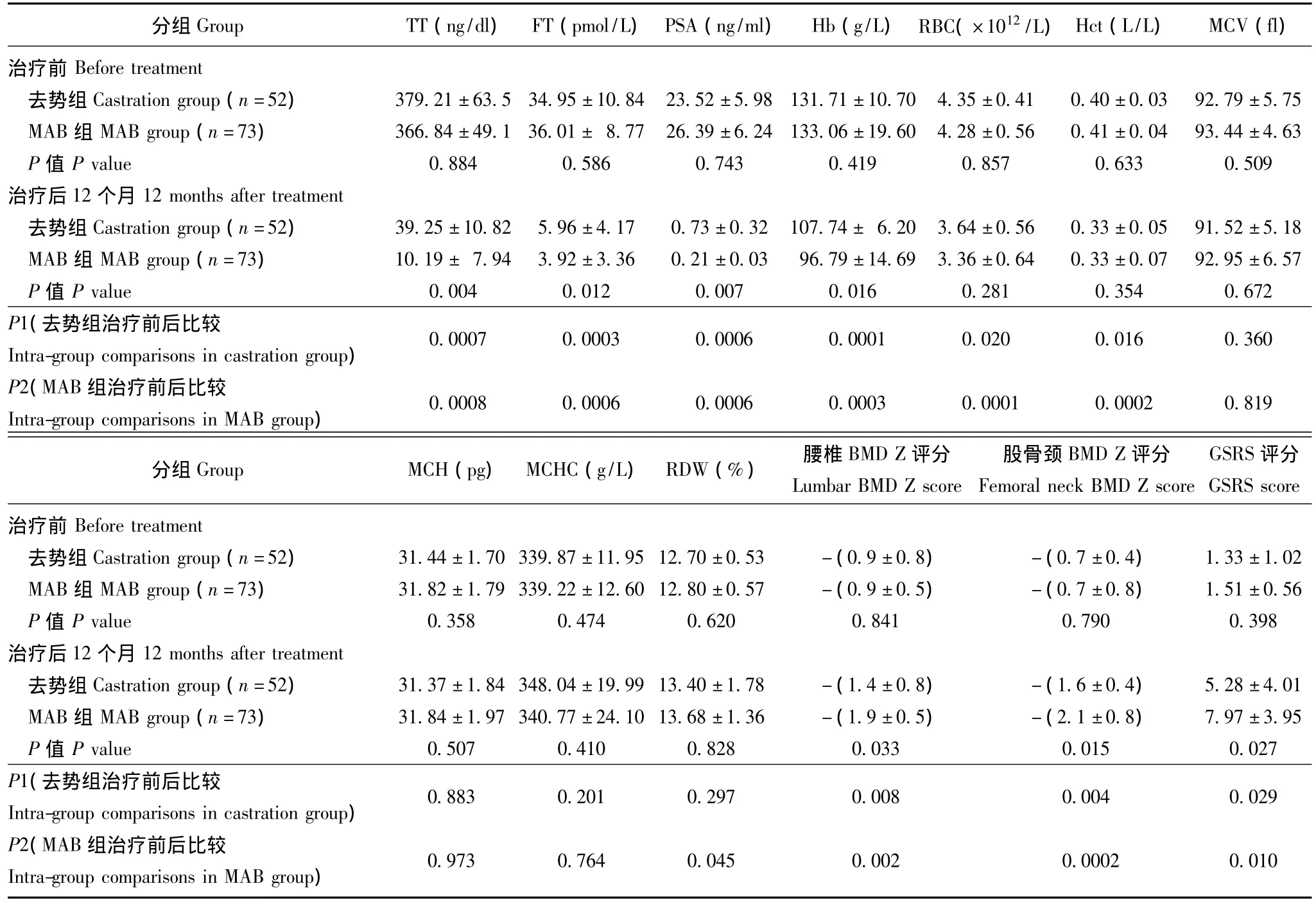
表1 治疗前后各项评估指标的比较 ()Table 1 Indicators in two groups before and after treatment()
TT:血清总睾酮;FT:血清游离睾酮;PSA:前列腺特异性抗原;Hb:血红蛋白;RBC:红细胞计数;Hct:血细胞比容;MCV:平均红细胞体积;MCH:平均血红蛋白含量;MCHC:平均血红蛋白浓度;RDW:红细胞分布宽度;BMD:骨密度;GSRS:胃肠道功能评分TT:total testosterone;FT:free testosterone;PSA:prostate specific antigen;Hb:hemoglobin;RBC:red blood cell;Hct:hematocrit;MCV:mean corpuscular volume;MCH:mean corpuscular hemoglobin;MCHC:mean corpuscular hemoglobin concentration;RDW:red blood cell distribution width;BMD:bone mineral density;GSRS:gastrointestinal symptom rating scales
?

表2 各种代谢异常发病率的比较 (%)Table 2 Incidences of metabolic complications in two groups(%)

表3 激素水平与代谢指标的Pearson相关系数Table 3 Correlation(Pearson value)between hormone levels and metabolic indicators
在血液系统,睾酮通过下丘脑-垂体反馈系统促进促红细胞生成素的分泌,并激活造血干细胞而提高造血功能。这也是男性相对于女性血红蛋白高的原因之一[10]。ADT后低雄激素血症严重削弱了雄激素对机体造血功能的促进作用,从而诱发贫血。贫血引起的肿瘤细胞乏氧状态,可间接阻滞细胞循环周期,诱导基因扩增,增加基因突变,导致染色体不稳定,使肿瘤细胞逃避凋亡,并导致肿瘤细胞产生对放疗的抗拒,削弱肿瘤细胞对放化疗的敏感性[11]。前列腺癌伴有贫血的死亡危险性高达47%[12]。前列腺癌患者ADT后血红蛋白水平的降低,最早可在治疗开始后40 d出现[3];去势术后4年的贫血发病率可高达57%[13];治疗结束后血红蛋白随睾酮水平的恢复而恢复[14]。可见,贫血是前列腺癌患者ADT后的重要并发症之一。
在骨代谢方面,睾酮通过结合成骨细胞表面的雄激素受体,影响成骨细胞增殖、分化,促进细胞因子、生长因子的分泌及基质蛋白 (包括胶原蛋白、骨钙素、成骨蛋白等)的合成[15]。ADT后低雄激素血症导致破骨细胞活化、骨小梁穿孔、连接结构破坏,使雄激素刺激成骨和维持骨量的作用下降,骨形成减少,骨吸收增加,引起骨密度下降和骨质疏松[16-17]。ADT后1年,5.8% ~6.5%的骨质流失发生在腰椎骨松质,1.8%~2.3%发生在股骨颈;ADT后2年,脊柱骨密度减少1.7%,骨盆密度减少5.2%,前臂远端骨密度减少9.4%;ADT后10年,脊柱骨密度减少14%,骨盆骨密度减少28%[18-19]。前列腺癌患者ADT后7年的骨折发病率为13.6%,ADT后15年的骨折发生率高达40%[20]。因此,前列腺癌患者ADT后的骨代谢异常情况也已成为疗效及生存预后评估的独立指标之一[21]。
在胃肠功能方面,雄激素水平的改变在胃肠道功能紊乱的发病过程中扮演着重要角色;ADT后IBS可对前列腺癌患者的生活质量带来严重影响,是最常见的胃肠功能性疾病之一[22-23]。男性IBS患者的血清睾酮浓度显著低于正常值,提示接受ADT的前列腺癌患者可能是IBS的高发群体[24-26]。此外,雄激素受体与T细胞竞争性结合β-连环蛋白因子,雄激素受体的活化能对Wnt/β-连环蛋白/T细胞因子信号通道产生强烈抑制,而上述信号通路的异常表达与结直肠恶性肿瘤的发生密切相关[27],故ADT可能增加结直肠恶性肿瘤的发生风险;同时,低雄激素血症诱发的胰岛素抵抗、2型糖尿病和肥胖均属于结直肠恶性肿瘤的高危因素,而结直肠恶性肿瘤的早期临床表现即包括排便习惯和大便性状的改变。因此,针对ADT治疗后的前列腺癌患者开展胃肠道功能的监测和评估,对改善生活质量和肿瘤预后具有重要意义。
本研究内分泌治疗开始后12个月,去势组及MAB组患者的Hb、RBC、Hct、腰椎BMD评分及股骨颈BMD评分均显著低于各自基础值,GSRS评分显著高于各自基础值,且患者血清睾酮水平与上述指标呈线性相关,证实内分泌治疗与贫血、骨质疏松和功能性胃肠病的发生密切相关。同时,MAB组患者治疗前后Hb、腰椎BMD评分、股骨颈BMD和GSRS评分的变化程度,与去势组相比更为显著,MAB组患者贫血、骨质疏松及IBS的患病率显著高于单纯去势组,提示接受LHRH-a联合抗雄激素药物治疗的患者,血清雄激素水平较单纯接受去势手术的患者更低,其代谢异常及生活质量下降的严重程度更为严重,即上述并发症的患病率和严重程度随雄激素水平的下降而愈发显著。
本研究两组患者治疗前后的MCV、MCH及MCHC的变化均无统计学意义,提示内分泌治疗后低雄激素血症导致的贫血属于正细胞正色素性贫血;同时,前列腺癌患者多为高龄人群,尽管入组时已对贫血相关疾病和危险因素进行控制和排除,仍需认识到老年群体贫血的病因和影响因素复杂多样,前列腺癌患者内分泌治疗后贫血的病因有待进一步证实;治疗期间去势组和MAB组患者骨折的患病率分别为3.85%(2/52)和4.11%(3/73),其中股骨颈骨折2例、腰椎压缩性骨折2例、胫骨平台骨折1例,骨折患病率与当地同龄男性人群差异无统计学意义[28-29],与文献 [19-20]报道有一定差异,考虑本研究样本量有限,观察随访时间较短,尚未能对骨折等生活事件的发生作出全面描述,该领域的临床研究有待进一步完善;由于本研究入组患者例数和IBS确诊例数有限,尚无法详细比较观察组与对照组在IBS分型方面的差异性,有待进一步深入研究。
综上,内分泌治疗与贫血、骨质疏松和功能性胃肠病的发生密切相关。对合并慢性萎缩性胃炎、炎症性肠病、胃肠道恶性肿瘤及造血系统疾病者,应加强随访和监测力度,关注贫血进展;对治疗过程中出现贫血及相关症状 (乏力、活动后气喘、易疲劳等)者,应及时发现并干预,如通过重组人红细胞生成素纠正贫血,改善患者生活质量;前列腺癌高危人群为老年男性,内分泌治疗前即存在不同程度的骨量减少和骨质疏松,而内分泌治疗将显著加剧这一病情,应在治疗前后监测及复查BMD,给予专业指导和诊疗,避免导致骨折和创伤的高危活动;应重视对该人群的胃肠功能和排便习惯的随访,对胃肠道功能异常做到早期诊断和干预,在筛查功能性胃肠病的同时,完善器质性病变的排查,提高生存时间和生活质量[28]。
[1]Oefelein MG.Health related quality of life using serum testosterone as the trigger to re-dose long acting depot luteinizing hormone-releasing hormone agonists in patients with prostate cancer [J].J Urol,2003,169(1):251-255.
[2]Huggins C,Hodges CV.Studies on prostatic cancer.I.The effect of castration,of estrogen and androgen injection on serum phosphatases in metastatic carcinoma of the prostate[J].CA Cancer J Clin,1972,22(4):232-240.
[3]Ornstein DK,Beiser JA,Andriole GL,et al.Anaemia in men receiving combined finasteride and flutamide therapy for advanced prostate cancer[J].BJU Int,1999,83(1):43-46.
[4]Ziaran S,Goncalves FM,Wendl J,et al.Evaluation of bone mass density on patients with prostate cancer prior to the start of androgen deprivation therapy[J].Bratisl Lek Listy,2009,110(9):559-562.
[5]McDermed JE,Strum SB,Scholz MC,et al.Anaemia associated with androgen deprivation in patients with prostate cancer receiving combined hormone blockade [J].Br J Urol,1997,79(6):933-941.
[6]Strum SB,Scholz MC,Lam RY,et al.Primary intermittent androgen deprivation as initial therapy for men with newly diagnosed prostate cancer [J].Clin Genitourin Cancer,2011,9(2):89-94.
[7]Li J,Qian LX,Hua LX,et al.Anemia in patients on combined androgen block therapy for prostate cancer[J].Asian J Androl,2004,6(4):383-384.
[8]Melton LJ 3rd,Lieber MM,Atkinson EJ,et al.Fracture risk in men with prostate cancer:a population-based study[J].J Bone Miner Res,2011,26(8):1808-1815.
[9]Townsend MF,Sanders WH,Northway RO,et al.Bone fractures associated with luteinizing hormone-releasing hormone agonists used in the treatment of prostate carcinoma[J].Cancer,1997,79(3):545-550.
[10]Ferrucci L,Maggio M,Bandinelli S,et al.Low testosterone levels and the risk of anemia in older men and women [J].Arch Intern Med,2006,166(13):1380-1388.
[11]Gardner FH,Besa EC.The onset of a refractory response to androgens in the anemia of bone marrow failure[J].Trans Am Clin Climatol Assoc,1977,88:108-118.
[12]Caro JJ,Salas M,Ward A,et al.Anemia as an independent prognostic factor for survival in patients with cancer:a systemic,quantitative review[J].Cancer,2001,91(12):2214-2221.
[13]Fonseca R,Curtis KK,Pruthi RK,et al.Transfusion-dependent anemia after initiation of androgen deprivation therapy for metastatic prostate cancer[J].Urology,2007,70(4):811.e5-811.e8.
[14]Asbell SO,Leon SA,Tester WJ,et al.Development of anemia and recovery in prostate cancer patients treated with combined androgen blockade and radiotherapy[J].Prostate,1996,29(4):243-248.
[15]Grossmann M,Hamilton EJ,Gilfillan C,et al.Bone and metabolic health in patients with non-metastatic prostate cancer who are receiving androgen deprivation therapy[J].Med J Aust,2011,194(6):301-306.
[16]Hamilton EJ,Ghasem-Zadeh A,Gianatti E,et al.Structural decay of bone microarchitecture in men with prostate cancer treated with androgen deprivation therapy[J].J Clin Endocrinol Metab,2010,95(12):E456-E463.
[17]Nelson DM,Peterson AC.Changes in bone health and skeletal-related events following implementation of a multidisciplinary consensus statement guiding surveillance and treatment of men undergoing androgen deprivation therapy for prostate cancer[J].Aging Male,2010,13(2):120-123.
[18]Preston DM,Torréns JI,Harding P,et al.Androgen deprivation in men with prostate cancer is associated with an increased rate of bone loss[J].Prostate Cancer Prostatic Dis,2002,5(4):304-310.
[19]Kiratli BJ,Srinivas S,Perkash I,et al.Progressive decrease in bone density over 10 years of androgen deprivation therapy in patients with prostate cancer [J].Urology,2001,57(1):127-132.
[20]Ziaran S,Goncalves FM,Breza JS.Bone mineral density,pathological fractures and bisphosphonate therapy in prostate cancer patients on androgen deprivation therapy [J].Endocr Regul,2011,45(4):199-204.
[21]D'Alesio V,Salvig BE,Fourakre TN.Evaluation of osteoporosis risk assessment in veterans receiving androgen-deprivation therapy[J].Consult Pharm,2011,26(1):43-47.
[22]Kim BJ,Rhee PL,Park JH.Male sex hormones may influence the symptoms of irritable bowel syndrome in young men[J].Digestion,2008,78(2-3):88-92.
[23]崔楠,吴保平,吴赛珠.肠易激综合征患者外周血雌激素孕激素及睾酮激素含量分析[J].南方医科大学学报,2006,26(3):367-368.
[24]Houghton LA,Jackson NA,Whorwell PJ,et al.Do male sex hormones protect from irritable bowel syndrome?[J].Am J Gastroenterol,2000,95(9):2296-2300.
[25]Agarwal N,Spiegel BM.The effect of irritable bowel syndrome on health-related quality of life and health care expenditures[J].Gastroenterol Clin North Am,2011,40(1):11-19.
[26]Adeyemo MA,Spiegel BM,Chang L.Meta-analysis:do irritable bowel syndrome symptoms vary between men and women [J].Aliment Pharmacol Ther,2010,32(6):738-755.
[27]Minocha A,Bollineni D,Johnson WD,et al.Racial differences in general health,suicidal thoughts,physical and sexual abuse in African-Americans and Caucasians with irritable bowel syndrome[J].South Med J,2010,103(8):764-770.
[28]Alonso C,Santos J.A closer look at mucosal inflammation in irritable bowel syndrome:sex-and gender-related disparities-quantity,quality,or both?[J].Am J Gastroenterol,2009,104(2):401-403.
[29]Liu M,Wang J,Xu Y,et al.Risk loci on chromosome 8q24 are associated with prostate cancer in northern Chinese men [J].J Urol,2012,187(1):315-321.

