miR-200b靶向调控PKCα表达对胶质瘤细胞增殖和侵袭能力的影响
曾晖,朱明亮,郭远波,闫国防
miR-200b靶向调控PKCα表达对胶质瘤细胞增殖和侵袭能力的影响
曾晖,朱明亮,郭远波,闫国防
目的观察miR-200b能否通过靶向调控蛋白激酶Cα(PKCα)的表达而抑制胶质瘤细胞的增殖及侵袭能力,探讨miR-200b的抑瘤分子机制。方法构建PKCα 3'-UTR-荧光素酶报告载体,通过荧光素酶活性检测观察miR-200b对PKCα 3'-UTR-荧光素酶活性的影响。将miR-200b 模拟物转染胶质瘤细胞U87,采用Western blotting检测PKCα表达水平。将PKCα siRNA转染U87细胞,通过MTS法和Transwell侵袭实验观察细胞生长和侵袭能力的变化。结果双荧光素酶检测显示,miR-200b能特异性地与PKCα mRNA的3'-UTR结合,抑制其荧光素酶活性。过表达miR-200b的U87细胞PKCα mRNA及蛋白表达水平降低。siRNA干扰PKCα表达可抑制U87细胞的增殖和侵袭能力。结论miR-200b可通过靶向调控PKCα的表达而抑制胶质瘤细胞的增殖和侵袭能力。
神经胶质瘤;微RNAs;蛋白激酶Cα;细胞增殖;肿瘤浸润
近年来,miRNA已成为分子生物学研究的热点。人类miRNA通过调控其靶基因的表达及相关信号通路,具有类似于癌基因或抑癌基因的功能,在肿瘤的发生、发展和转归过程中发挥重要作用[1]。研究表明,miR-200在多种肿瘤组织和细胞中表达下调[2-3],其中miR-200b可通过靶向Ras鸟苷酸结合蛋白超家族新成员(RND3),阻滞宫颈癌Hela细胞周期的进展[4]。下调miR-200b表达可促进支气管上皮细胞的上皮间叶转化(EMT)及肿瘤形成[5],miR-200b在EB病毒感染的胃癌组织及胃癌细胞系中表达均下降。miR-200b可通过上调ZEB1/ZEB2的表达,促进胃癌细胞的侵袭转移[6],也可通过调控其靶基因ZEB2抑制胃癌细胞的生长、侵袭和转移[7]。但miR-200b在胶质瘤发生发展中发挥作用的分子机制尚不清楚。本研究通过分子生物学方法观察miR-200b靶向调控蛋白激酶Cα(PKCα)表达对胶质瘤细胞增殖和侵袭能力的影响,旨在进一步了解miR-200b的抑瘤机制。
1 材料与方法
1.1 主要材料 恶性胶质瘤细胞U87为第四军医大学神经科学研究所惠赠,培养于含10%小牛血清的DMEM中。T4DNA连接酶、SpeⅠ和Hind Ⅲ限制性内切酶为大连宝生物公司产品。miR-200b 模拟物为Ambion公司产品。PKCα siRNA由Invitrogen公司合成,序列为5'-GGGATCGAACAACAAGGAA-3'。双荧光素酶活性检测试剂盒购自Promega公司。PKCα单克隆抗体和GAPDH抗体购自Santa Cruz公司。DMEM培养基为Hyclone公司产品。MTS细胞增殖/毒性检测试剂盒购自美国Sigma公司。铺有基质胶的Transwell侵袭小室购自BD Biosciences公司。
1.2 野生型PKCα 3'-UTR-荧光素酶报告载体的构建 通过Targetscan 6.2软件预测出miR-200b可能与PKCα mRNA的3'-UTR片段1319~1325bp结合。根据PKCα 3'端非翻译区(3'-UTR)序列设计末端带SpeⅠ和Hind Ⅲ酶切位点的特异性引物,其序列为正向5'-AGAACTAGTGAGTGTTGGGTGAATCTG-3',反向5'-GTCAAGCTTCTATCACGTAAACTAGCC-3'。将PCR产物及pMIR荧光报告载体分别用SpeⅠ和Hind Ⅲ双酶切后纯化,连接,转化,鉴定。构建野生型PKCα 3'-UTR-荧光素酶载体,命名为PKCα-Wt。突变型PKCα 3'-UTR-荧光素酶报告载体构建由Invitrogen公司合成,命名为PKCα-Mt。
1.3 荧光素酶活性检测 将荧光素酶报告载体与miR-200b模拟物(处理组)或无关序列(对照组)共转染U87细胞,以转染pRL-TK的细胞作为内参照,转染36h后收获细胞,按Promega公司双荧光素酶活性检测试剂盒说明书采用单光子检测仪检测细胞荧光素酶活性。相对荧光素酶活性=萤火虫荧光素酶活性值/海肾荧光素酶活性值×100%。
1.4 MTS法检测细胞增殖活性 取转染miR-200b模拟物或si-PKCα后的U87细胞,消化后接种细胞于96孔板中,每孔1×103个细胞,miR-200b模拟物组、si-PKCα组以及对照组各设6个平行复孔,置37℃、5% CO2培养箱中培养。在未接种细胞的孔中加入DMEM培养基作为调零孔。分别于培养24、48、72、96h后进行检测。检测时每孔加20μl MTS试剂,37℃孵育2h,用酶标仪测定492nm处的吸光度值。实验重复3次。
1.5 Transwell侵袭实验 先将铺有基质胶的Transwell板预热至37℃。消化PKCα siRNA 或miR-200b模拟物转染的U87细胞,用无血清培基洗涤2次,再用无血清培养基重悬细胞,调整细胞密度为1×105/ml。在Transwell下室加入800μl含15% FCS的培养基,上室加入250μl细胞悬液,37℃培养48h。取出Transwell小室,擦掉靠上室侧膜的细胞,PBS清洗,14%甲醛溶液固定10min,结晶紫染色,显微镜下观察、照相,随机选取5个高倍视野(×100)进行细胞计数,并计算平均值。实验重复3次。
1.6 Western blotting检测miR-200b对PKCα蛋白表达的影响 将miR-200b 模拟物或si-PKCα转染U87细胞,48h后提取细胞总蛋白,BCA法测定蛋白浓度。取等量样本,行SDS-PAGE凝胶电泳分离,然后将蛋白转移至PVDF膜上,1%BSA封闭后,加入PKCα抗体或GAPDH抗体,4℃过夜。TBST洗膜10min,加入二抗室温孵育1h,TBST洗膜10min,加入ECL发光剂,X线曝光、显影、定影。
1.7 统计学处理 采用SPSS 13.0软件进行统计分析。数据结果以表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 miR-200b对PKCα mRNA的3'-UTR荧光素酶活性的影响 miR-200b模拟物或无关序列与pPKCα-Wt、PKCα-Mt共转染到U87细胞中,以转染pRL-TK的细胞作为内参照。双荧光酶活性检测结果显示,miR-200b模拟物可明显抑制野生型PKCα-Wt报告载体的荧光素酶活性(为内参照的58.7%,P<0.05),而miR-200b 模拟物对突变型PKCα-Mt载体的荧光素酶活性无明显抑制作用(为内参照的99.6%,P>0.05),表明miR-200b能特异性地与PKCα mRNA的3'-UTR结合。
2.2 miR-200b对PKCα蛋白表达的影响 miR-200b模拟物转染胶质瘤U87细胞48h后,以转染无关序列的细胞为阴性对照,转染PKCα siRNA的细胞为阳性对照。Western blotting检测显示,转染miR-200b后U87细胞PKCα蛋白表达与对照组比较明显降低(图1),表明miR-200b能靶向调控PKCα的表达。
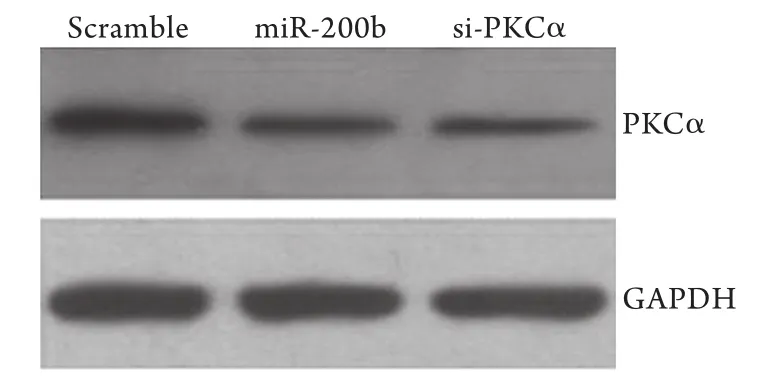
图1 miR-200b对U87细胞PKCα蛋白表达的影响(Western blotting)Fig. 1 Effect of miR-200b on the expression of PKCα protein in U87 cells (Western blotting)
2.3 PKCα siRNA对胶质瘤U87细胞增殖和侵袭能力的影响 将PKCα siRNA转染到U87细胞中,MTS法检测显示,细胞增殖速度自48h开始明显减慢,与无关序列对照比较差异有统计学意义(P<0.05,图2)。Transwell侵袭实验显示,转染PKCα siRNA后的U87细胞侵袭能力(侵袭细胞数为69±12)明显降低,与无关序列对照(侵袭细胞数为113±26)比较差异有统计学意义(P<0.01)。表明PKCα siRNA可抑制胶质瘤U87细胞的增殖和侵袭能力。

图2 PKCα siRNA对胶质瘤细胞增殖能力的影响Fig. 2 Effect of PKCα siRNA on the proliferation of glioma cells
3 讨 论
神经胶质瘤也称胶质细胞瘤,简称胶质瘤,是发生于神经外胚层的肿瘤,起源于神经间质细胞和神经实质细胞,占原发性脑肿瘤的50%~60%。目前胶质瘤的临床疗效欠佳,尤其是多形性胶质母细胞瘤的预后很差。因此寻找神经胶质瘤新的治疗靶点与治疗方法是临床上亟待解决的问题。
MicroRNA是一类内源性的具有调节作用的非编码RNA。近年来研究发现miRNA参与多种调节途径,包括细胞增殖、凋亡、分化、发育和代谢等[8]。蛋白激酶C(protein kinase C,PKC)是存在于细胞质内,由钙活化的磷脂依赖性丝/苏氨酸蛋白激酶家族,广泛参与调节多种生物学事件,如转录调节、免疫介导、学习与记忆、受体脱敏、细胞代谢、细胞生长、分化、增殖、癌变及细胞凋亡等[9],迄今已从不同种属的生物中分离、纯化出12种不同的PKC亚型。PKCα与肿瘤基因的不稳定性和肿瘤细胞的增殖、抗凋亡、侵袭、药物抵抗有关[10],在肿瘤发生发展中起着重要作用。本研究结果证实PKCα是miR-200b调控的直接靶基因,并通过siRNA干扰实验证实下调PKCα表达可抑制胶质瘤细胞的增殖和侵袭能力,PKCα能部分模拟miR-200b的抑瘤功能,表明miR-200b可通过靶向调控PKCα的表达抑制胶质瘤细胞的增殖和侵袭能力,进一步揭示了miR-200b的抑瘤分子机制。
综上所述,miRNA作为癌基因或抑癌基因功能的发现为肿瘤发生机制的研究提供了新思路,也为肿瘤的预防、诊断、预后判断提供了新策略,继续深入研究miR-200b参与胶质瘤发生发展的分子机制,可为胶质瘤的防治提供理论依据及实验基础。
[1] Iorio MV, Visone R, Di Leva G,et al. MicroRNA signatures in human ovarian cancer[J]. Cancer Res, 2007, 67(18): 8699-8707.
[2] Elson-Schwab I, Lorentzen A, Marshall CJ. MicroRNA-200 family members differentially regulate morphological plasticity and mode of melanoma cell invasion[J]. PLoS One, 2010, 5(10): e13176.
[3] Adam L, Zhong M, Choi W,et al. miR-200 expression regulates epithelial-tomesenchymal transition in bladder cancer cells and reverses resistance to epidermal growth factor receptor therapy[J]. Clin Cancer Res, 2009, 15(16): 5060-5072.
[4] Xia W, Li J, Chen L,et al. MicroRNA-200b regulates cyclin D1 expression and promotes S-phase entry by targeting RND3 in HeLa cells[J]. Mol Cell Biochem, 2010, 344(1-2): 261-266.
[5] Wang Z, Zhao Y, Smith E,et al. Reversal and prevention of arsenic-induced human bronchial epithelial cell malignant transformation by micoRNA-200b[J]. Toxicol Sci, 2011, 121(1): 110-122.
[6] Shinozaki A, Sakatani T, Ushiku T,et al. Downregulation of microRNA-200 in EBV-associated gastric carcinoma [J]. Cancer Res, 2010, 70(11): 4719-4727.
[7] Kurashige J, Kamohara H,et al. MicroRNA-200b regulates cell proliferation, invasion, and migration by directly targeting ZEB2 in gastric carcinoma[J]. Ann Surg Oncol, 2012, 3(1): S656-S664.
[8] Li Y, Guessous F, Zhang Y,et al. MicroRNA-34a inhibits glioblastoma growth by targeting multiple oncogenes[J]. Cancer Res, 2009, 69(19): 7569-7576.
[9] Ruan BF, Zhu HL. The chemistry and biology of the bryostatins: potential PKC inhibitors in clinical development[J]. Curr Med Chem, 2012, 19(16): 2652-2664.
[10] Kang JH, Toita R, Kim CW,et al. Protein kinase C (PKC) isozyme-specific substrates and their design[J]. Biotechnol Adv, 2012, 30(6): 1662-1672.
Influence of target regulation of PKCα by miR-200b on proliferation and invasion of glioma cells
ZENG Hui, ZHU Ming-liang*, GUO Yuan-bo, YAN Guo-fang
Department of Neurosurgery, 169 Hospital of PLA, Hengyang, Hunan 421001, China
*
, E-mail: mingliang915@yahoo.com.cn
ObjectiveTo survey whether miR-200b suppresses proliferation and invasiveness of glioma cells by targeted regulation of protein kinase Cα (PKCα) expression, and to investigate the molecular mechanism of antitumor effect of miR-200b.MethodsPKCα 3'-UTR-luciferase vector was constructed and dual-luciferase reporter gene assay was employed to examine the effect of miR-200b on PKCα 3'-UTR-luciferase activity. U87 cells were transfected with miR-200b mimics, and the expression of PKCα protein was determined by Western blotting. U87 cells were transfected with PKCα siRNA, and then the changes in cellular proliferation and invasiveness were observed by MTS method and Transwell assay, respectively. ResultsDual-luciferase reporter gene assay showed that miR-200b could bind to 3'-UTR of PKCα mRNA specifically and inhibited the luciferase activity. Expression of PKCα mRNA and protein decreased significantly in U87 cells overexpressing miR-200b. siRNA-mediated down-regulation of PKCα could suppress the potentials of proliferation and invasiveness of U87 cells.ConclusionmiR-200b could inhibit the proliferation and invasion of glioma cellsviatargeted regulation of PKCα expression.
glioma; microRNAs; protein kinase C-alpha; cell proliferation; neoplasm invasiveness
R739.41
A
0577-7402(2013)10-0834-03
10.11855/j.issn.0577-7402.2013.10.011
2013-03-10;
2013-07-16)
(责任编辑:胡全兵)
曾晖,主治医师。主要从事神经外科疾病的诊断与治疗工作
421001 湖南衡阳 解放军169医院神经外科(曾晖、朱明亮、郭远波、闫国防)
朱明亮,E-mail:mingliang915@yahoo.com.cn

