O型糖链合成阻滞对肠上皮细胞MUC2表达及细菌黏附的抑制作用
宋丽丽,叶钧,刘韵,潘琼,钟小莉,李姗姗,田音,彭志红,汪荣泉
O型糖链合成阻滞对肠上皮细胞MUC2表达及细菌黏附的抑制作用
宋丽丽,叶钧,刘韵,潘琼,钟小莉,李姗姗,田音,彭志红,汪荣泉
目的探讨肠上皮细胞O型糖链的合成阻滞对该细胞肠分化标记物MUC2表达及细菌黏附的影响。方法采用O型糖链抑制剂benzyl-α-GalNAc抑制结肠上皮细胞HT-29及其分化型细胞(HT-29-Gal)O型糖链的合成,经benzyl-α-GalNAc处理的HT-29和HT-29-Gal细胞分别命名为HT-29-OBN和HT-29-Gal-OBN。采用Real-time PCR和Western blotting方法检测上述4种细胞中MUC2基因的转录和蛋白表达水平,并将上述细胞与致病性大肠埃希菌(EPEC)和肠出血性大肠埃希菌(EHEC)O157:H7共培养,采用系列稀释菌落计数法观察细菌在上述细胞表面的黏附情况。结果Realtime PCR和Western blotting结果显示,经benzyl-α-GalNAc处理后,HT-29和HT-29-Gal细胞MUC2的mRNA和蛋白表达均明显减少(P<0.05)。HT-29-OBN和HT-29-Gal-OBN细胞与致病性大肠埃希菌EPEC和EHEC O157:H7的黏附明显少于HT-29和HT-29-Gal细胞(P<0.05)。结论抑制肠上皮细胞O型糖链的合成可阻碍细菌黏附及MUC2的表达。
肠黏膜;细菌黏附;大肠埃希菌
肠道除具有消化吸收及蠕动功能外,还有分泌激素、免疫调节和黏膜屏障功能,肠黏膜屏障在肠功能维护中扮演着重要角色[1-2]。肠黏膜表面覆盖着一层由黏蛋白组成的黏液,目前已经发现的黏蛋白有21种,分为分泌性和跨膜性两种。由于肠黏液屏障中黏蛋白分子质量的80%是由O-glycans组成,因此黏蛋白的功能与其分子上的O型糖链密切相关[3-4]。近年来,人们对病原菌的黏附机制进行了系统深入的研究,发现黏液黏蛋白为进入肠道内的细菌黏附定植提供了受体位点[5],部分特定的糖链成为病原微生物定植黏液层的位点以及联结细胞与环境相互交通信号的生物平台[6-7]。研究黏蛋白分子上决定其生物学功能的O-glycans与病原微生物之间的相互作用,有助于理解宿主与病原微生物之间的关系。本研究探讨肠上皮细胞O型糖链的合成阻滞对细胞肠分化标记物MUC2表达及细菌黏附的影响。
1 材料与方法
1.1 主要材料与仪器 人结肠癌细胞株HT-29购自中国科学院上海细胞库,致病性大肠埃希菌EPEC和肠出血性大肠埃希菌EHEC O157:H7由第三军医大学微生物免疫教研室毛旭虎教授赠送。Macoy's 5A和无糖Macoy's 5A培养基购自Sigma公司,葡萄糖和半乳糖、Trizol试剂购自Invitrogen公司,O糖链抑制剂benzyl-α-GalNAc购自Santa公司,胎牛血清(FBS)购自Hyclone公司,反转录及荧光定量PCR试剂购自大连宝生物工程有限公司,CO2恒温培养箱购自美国Thermo公司,PCR仪和凝胶成像系统均购自美国Bio-Rad公司。MUC2多克隆抗体采用脱糖基化的肠黏蛋白免疫新西兰兔获得。
1.2 细胞培养 将结肠癌HT-29细胞用含10% FBS的Macoy's 5A完全培养液进行常规培养;待细胞生长融合至60%后再继续培养48h;用含10% FBS的Macoy's 5A培养液(以5nmol/L半乳糖取代葡萄糖)培养,诱导得到结肠癌HT-29细胞的分化型细胞HT-29-Gal[8-9]。当上述两种细胞处于对数生长期时消化、离心,调整细胞浓度至30%,接种至6孔板,接种第2天当细胞生长融合至50%~60%时,加入2nmol/L的benzyl-α-GalNAc[10-11],培养7d,分别获得O型糖链合成抑制的细胞:HT-29-OBN和HT-29-Gal-OBN。
1.3 细菌黏附实验 将处于对数生长期的HT-29、HT-29-Gal、HT-29-OBN、HT-29-Gal-OBN 4种细胞接种于24孔板直至细胞生长融合至70%~80%;将新鲜接种的MacConkey平板上的致病性大肠埃希菌EPEC和EHEC O157:H7,分别挑单菌落于Penassay肉汤培养基中于37℃过夜培养增殖;细胞与细菌共孵育前1h,将含血清的细胞培养液换成无血清无抗生素的Macoy's 5A培养液(含葡萄糖)或无血清无抗生素的Macoy's 5A培养液(含半乳糖)。将孵育的EPEC和EHEC O157:H7细菌分别按106cfu/ml加入24孔板中,37℃共孵育3h;用冷PBS清洗共孵育的细胞,去除未黏附的EPEC或EHEC O157:H7细菌并抑制黏附的细菌;用胰酶消化黏附了细菌的细胞,将得到的细菌按梯度稀释法涂在MacConkey琼脂板上,37℃过夜。用菌落计数法定量黏附细菌数。
1.4 Real-time PCR检测肠分化标志物MUC2 mRNA的表达 按照Trizol试剂说明书提取细胞总RNA,Real-time PCR引物由大连宝生物工程有限公司合成,退火温度60℃。按照试剂盒说明书进行反转录,反应条件为:37℃ 15min,85℃ 5s。Real-time PCR反应体系20μl,反应条件为:95℃ 10s;95℃ 5s,60℃ 20s,40个循环;55℃ 10s,80个循环。MUC2上游引物:5'-GGGGAGTGCTGTAAGAAGTGTGA-3';下游引物:5'-GTTGGAGACGGACGAGATGAG-3',扩增片段长度165bp。
1.5 Western blotting检测肠分化标志物MUC2蛋白的表达 获得HT-29、HT-29-Gal、HT-29-OBN和HT-29-Gal-OBN全细胞裂解液,BCA法定量;取20μg按照4:1比例加入0.5mol/L DTT,煮沸5min变性,上样、电泳、电转;加入5% BSA室温封闭2h;加入MUC2一抗(1:1000),4℃过夜;洗膜,加入辣根过氧化物酶标记的二抗(1:10 000),室温孵育1h;洗膜,化学发光显色,凝胶成像仪成像。采用Quantity-One软件对条带的光密度(A)值进行分析,蛋白的相对定量结果以实验条带A值/β-actin条带A值表示。
1.6 统计学处理 采用SPSS 13.0软件进行数据处理。计量资料以表示,各组间比较采用单因素方差分析,进一步两两比较采用SNK-q法。P<0.05表示差异有统计学意义。
2 结 果
2.1 细菌黏附实验 对于同一浓度下的细菌EPEC和EHEC O157:H7,肠分化细胞HT-29-Gal的细菌黏附数目少于结肠上皮HT-29细胞(P<0.01);HT-29-OBN细胞的细菌黏附数目少于HT-29细胞(P<0.01);HT-29-Gal-OBN细胞的细菌黏附数目明显少于HT-29-Gal细胞(P<0.05);HT-29-Gal-OBN细胞的细菌黏附数目少于HT-29-OBN细胞(P<0.01,图1)。

图1 致病性大肠埃希菌(EPEC和EHEC O157:H7)对肠上皮细胞的黏附能力检测Fig.1 Adhesion of EPEC and EHEC O157:H7 to intestinal epithelial cells
2.2 肠分化标志物MUC2 mRNA的表达情况Real-time PCR检测结果显示,HT-29-OBN细胞中的MUC2 mRNA水平明显低于结肠上皮HT-29细胞(P<0.05);HT-29-Gal-OBN细胞MUC2 mRNA水平明显低于肠分化的HT-29-Gal细胞(P<0.05);HT-29-Gal细胞中的MUC2 mRNA表达明显高于HT-29细胞,而HT-29-Gal-OBN细胞中的MUC2 mRNA表达高于HT-29-OBN细胞(P<0.05,图2)。
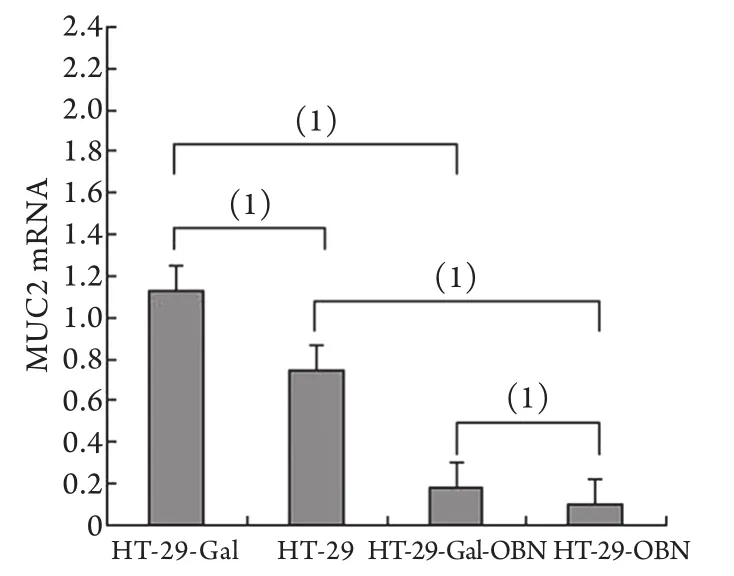
图2 Real-time PCR检测细胞MUC2 mRNA表达水平Fig.2 MUC2 mRNA expression detected by real-time PCR
2.3 MUC2蛋白的表达情况 Western blotting检测结果显示,HT-29-OBN细胞MUC2蛋白表达水平明显低于HT-29细胞;HT-29-Gal-OBN细胞MUC2蛋白表达水平明显低于HT-29-Gal细胞(P<0.05);HT-29-Gal细胞中MUC2蛋白的表达明显高于HT-29细胞(P<0.05);而HT-29-Gal-OBN细胞MUC2蛋白表达水平高于HT-29-OBN细胞,差异有统计学意义(P<0.05,图3)。
3 讨 论
肠黏液屏障是组成肠黏膜屏障的重要成分,肠道黏蛋白VNTR内的O-glycans含有丰富糖链,在肠道黏液层内是直接与肠道微生物、病毒、毒素相互作用的一线屏障,并直接成为后者结合、参与代谢、抑制细菌生长的靶点[12-13]。因此,研究黏蛋白分子上决定其生物学功能的O-glycans与病原微生物之间的相互作用,可更好地理解宿主与病原微生物之间的联系。
本研究结果显示,相对于HT-29和HT-29-Gal细胞,HT-29-OBN和HT-29-Gal-OBN细胞中的MUC2 mRNA和蛋白质表达水平均下降,考虑原因为MUC2转录、翻译过程中所涉及的酶、转录因子或共激活因子存在O型糖基化。benzyl-α-GalNAC不仅抑制了黏蛋白的O型糖基化,同时也抑制了培养细胞中所有蛋白的O型糖基化。benzyl-α-GalNAC通过与黏蛋白分子O-glycan的核心GalNAC结构(GalNAC-O-Ser/Thr)竞争结合干扰黏蛋白O-glycan的延长,因此,分化程度高的HT-29-Gal中的MUC2蛋白表达明显高于分化程度低的HT-29细胞。肠杯状细胞标志物MUC2蛋白表达在HT-29-OBN和HT-29-Gal-OBN细胞中低于相应的HT-29和HT-29-Gal,提示抑制肠上皮细胞黏蛋白分子O型糖链的合成可抑制细胞MUC2的表达。
由于在体内评价尚存在一定困难,目前多应用体外培养肠上皮细胞和细菌共孵育的方法来检测候选菌株的黏附力[14],该方法也可应用于细菌对肠黏膜上皮的黏附[15]。将HT-29-OBN、HT-29-Gal-OBN、HT-29和HT-29-Gal细胞与细菌共孵育发现,EPEC和EHEC O157:H7在HT-29-Gal细胞的黏附数量少于HT-29细胞;HT-29-Gal-OBN细胞的细菌黏附数量少于HT-29-OBN细胞,提示分化程度高的细胞有阻碍细菌黏附的作用。HT-29-OBN和HT-29-Gal-OBN细胞的细菌黏附数量明显少于未经处理的HT-29和HT-29-Gal细胞,表明O型糖链的合成与细菌对肠上皮细胞的黏附有关。
综上所述,我们认为O-glycans的合成参与了肠黏液屏障的形成,以及肠道病原体对肠黏膜上皮细胞的黏附过程。
[1] Goulet O, Ruemmele F, Lacaille F,et al. Irreversible intestinal failure[J]. J Pediatr Gastroenterol Nutr, 2004, 38(3): 250-269.
[2] Yang DZ, Zhou QQ, Li SZ,et al. Intestinal mucosal barrierdysfunction injury induced by altitude hypoxia in rats and the protective effect of glutamine[J]. Med J Chin PLA, 2008, 33(5): 521-523. [杨定周, 周其全, 李素芝, 等. 高原缺氧致大鼠肠黏膜屏障功能损伤及谷氨酰胺的保护作用观察[J]. 解放军医学杂志, 2011, 36(3): 301-306.]
[3] Ju T, Brewer K, D'Souza A,et al. Cloning and expression of human core 1 beta 1,3-galactosyltransferase[J]. J Biol Chem, 2002, 277(1): 178-186.
[4] Xia L, Ju T, Westmuckett A,et al. Defective angiogenesis and fatal embryonic hemorrhage in mice lacking core 1-derived O-glycans[J]. J Cell Biol, 2004, 164(3): 451-459.
[5] Sajjan SU, Forstner JF. Characteristics of binding ofEscherichia coliserotype O157:H7 strain CL-49 to purified intestinal mucin[J]. Infect and Immun, 1990, 58(4): 860-867.
[6] Celli JP, Turner BS, Afdhal NH,et al.Helicobacter pylorimoves through mucus by reducing mucin viscoelasticity[J]. Proc Natl Acad Sci U S A, 2009, 106(34): 14321-14326.
[7] Lindén SK, Sheng YH, Every AL,et al. MUC1 limitsHelicobacter pyloriinfection both by steric hindrance and by acting as a releasable decoy[J]. PLoS Pathog, 2009, 5(10): e1000617.
[8] Zanetta JP, Gouyer V, Maes E,et al. Massivein vitrosynthesis of tagged oligosaccharides in 1-benzyl-2-acetamido-2-deoxy-α-D-galactopyranoside treated HT-29 cells[J]. Glycobiology, 2000, 10(6): 565-575.
[9] Ricciuto J, Heimer SR, Gilmore MS,et al. Cell surface O-glycans limitStaphylococcusaureusadherence to corneal epithelial cells[J]. Infect Immun, 2008, 76(11): 5215-5220.
[10] An G, Wei B, Xia B,et al. Increased susceptibility to colitis and colorectal tumors in mice lacking core 3-derived O-glycans[J]. J Exp Med, 2007, 204(6): 1417-1429.
[11] Pan Q, Tian Y, Li X,et al. Enhanced membrane-tethered Mucin3 (MUC3) expression by a tetrameric branched peptide with conserved TFLK motif inhibits bacteria adherence[J]. J Biol Chem, 2013, 288(8): 5407-5416.
[12] Gill DJ, Clausen H, Bard F. Location, location, location: new insights into O-GalNAc protein glycosylation[J]. Trends Cell Biol, 2011, 21(3): 149-158.
[13] Pan Q, Peng ZH, Chen WS,et al. Influence of MSAA3 protein fragment and modified peptide thereof on the MUC3 expression of HT29 cells[J]. Med J Chin PLA, 2011, 36(10): 1062-1064. [潘琼, 彭志红, 陈文生, 等. MSAA3蛋白功能片段及其修饰肽对HT29细胞MUC3表达的影响[J]. 解放军医学杂志, 2011, 36(10): 1062-1064.]
[14] Elina M, Tuomola L, Salminen SJ. Adhesion of some probiotic and dairy Lactobacillus strains to Caco-2 cell cultures[J]. Int J Food Microbiol, 1998, 41(1): 45-51.
[15] Tuomola E, Crittenden R , Playne M,et al. Quality assurance criteria for probiotic bacteria[J]. Am J Clin Nutr. 2001, 73(2Suppl): 393S-398S.
Inhibitory effect of O-glycosylation inhibition on human intestinal epithelial cells Mucin 2 expression and bacteria adherence
SONG Li-li, YE Jun, LIU Yun, PAN Qiong, ZHONG Xiao-li, LI Shan-shan, TIAN Yin, PENG Zhi-hong, WANG Rongquan*
Institute of Gastroenterology of PLA, Southwest Hospital of Third Military University, Chongqing 400038, China
*
, E-mail: rongquanw@hotmail.com
This work was supported by the National Natural Science Foundation of China (81170340)
ObjectiveTo investigate the effect of O-glycosylation inhibition in intestinal epithelial cells on the expression of Mucin 2 (MUC2) and bacterial adherence.MethodsIntestinal epithelial cells HT-29 and differentiated HT-29 cells (HT-29-Gal) were treated with an inhibitor of O-glycosylation (benzyl-α-GalNAc), and then named as HT-29-OBN and HT-29-Gal-OBN, respectively. The mRNA and protein expression of MUC2 in HT-29, HT29-Gal, HT-29-OBN and HT-29-Gal-OBN were detected by real-time PCR and Western blotting. Then the four kinds of above cells were incubated with enteropathogenicEscherichia coli(EPEC) or enterohemorrhagicEscherichia coliserotype O157:H7 (EHEC O157:H7). The bacteria were quantified by determining the colony forming unit (CFU) following the plating of serial dilutions of the bacteria to evaluate the effect of benzyl-α-GalNAc on bacteria adherence.ResultsThe results of real-time PCR and Western blotting showed that the mRNA and protein expression levels of MUC2 in HT-29-OBN and HT-29-Gal-OBN cells were significantly lower than those in the untreated cells HT-29 and HT-29-Gal (P<0.05). The bacterial adherence assay showed that the adherence of EPEC and EHEC O157:H7 to HT-29-OBN and HT-29-Gal-OBN cells significantly decreased compared with that to HT-29 and HT-29-Gal cells (P<0.05). ConclusionInhibition of O-glycosylation in intestinal epithelial cells may reduce the bacteria adherence and MUC2 expression.
intestinal mucosa; bacteria adhesion;Escherichia coli
R34
A
0577-7402(2013)10-0826-04
10.11855/j.issn.0577-7402.2013.10.009
2013-04-27;
2013-08-22)
(责任编辑:熊晓然)
国家自然科学基金(81170340)
宋丽丽,硕士研究生。主要从事肠黏蛋白方面的研究
400038 重庆 第三军医大学西南医院全军消化病研究所(宋丽丽、叶钧、刘韵、潘琼、钟小莉、李姗姗、田音、彭志红、汪荣泉)
汪荣泉,E-mail: rongquanw@hotmail.com

