血管紧张素(1-7)在高盐高脂饮食诱导的代谢综合征小鼠肾脏损伤中的作用
朱男,韩雅玲,闫承慧,张效林,赵昕,张玉婕,李洋
·基础研究·
血管紧张素(1-7)在高盐高脂饮食诱导的代谢综合征小鼠肾脏损伤中的作用
朱男,韩雅玲,闫承慧,张效林,赵昕,张玉婕,李洋
目的采用高盐高脂饮食喂养C57BL/6小鼠建立代谢综合征(MS)模型,探讨血管紧张素转换酶2(ACE 2)及血管紧张素(1-7)[Ang(1-7)]在MS导致的肾脏损伤中的作用。方法56只SPF级C57BL/6小鼠随机分为7组(每组8只),分别给予正常饮食(ND),高盐(HSD)饮食,高脂(HFD)饮食,高盐高脂(HSFD)饮食,以及分别采用依那普利20mg/ (kg·d)+高盐高脂饮食(HSFD-E),缬沙坦50mg/(kg·d)+高盐高脂饮食(HSFD-V),缬沙坦50mg/(kg·d)+Ang(1-7)Mas受体抑制剂A-779 150ng/(kg·d)+高盐高脂饮食(HSFD-VA)。16周后检测血压、体重、血糖及尿蛋白排泄率等基础代谢指标,然后颈动脉取血,ELISA法检测血清中Ang Ⅱ及Ang(1-7)水平,Western blotting检测肾脏中ACE 2及Ⅲ型胶原的表达,HE及Masson染色观察肾脏病理学改变。结果高盐高脂饮食喂养16周后,C57BL/6小鼠血压、内脏脂肪重量与体重比、血脂、血糖以及尿蛋白排泄率等各项代谢指标均明显升高(P<0.05);肾脏出现明显纤维化改变;血清AngⅡ水平升高,Ang(1-7)水平降低(P<0.01);肾脏组织中ACE2表达降低(P<0.05)。给予缬沙坦干预可明显缓解高盐高脂引起的代谢异常,肾脏损伤程度减轻,肾脏和血清中ACE2及Ang(1-7)表达增加(P<0.05)。给予依那普利或缬沙坦+A-779干预后上述指标与未干预组比较均无明显变化。结论应用高盐高脂饮食喂养C57BL/6小鼠可成功建立MS模型。AngⅡ受体1阻滞剂缬沙坦能够缓解高盐高脂导致的代谢异常和肾脏损伤,其对肾脏的保护机制可能与Ang(1-7)表达增加有关。
代谢综合征X;肽基二肽酶A;血管紧张素Ⅱ 1型受体拮抗剂;血管紧张素(1-7);肾病
代谢综合征(metabolic syndrome,MS)是以血压升高、腹型肥胖、糖耐量异常(2型糖尿病、空腹血糖异常)、胰岛素抵抗(insulin resistance,IR)和血脂异常为主要特征的一组临床症候群[1-2]。它不仅受到遗传因素的影响,环境因素对其发生也起着同样重要的作用。目前已知有多种环境因素可引起或促进MS发生,其中高盐高脂饮食是最为常见的致病因素,但其致病机制仍有待探讨。以往研究认为,肾素-血管紧张素-醛固酮系统(renin-angiotensinaldosterone system,RAAS)异常激活是MS及靶器官损伤的重要病理基础[3]。血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)作为重要的体液调节分子,在多种血管疾病的发生及发展中起着至关重要的作用[4]。近年研究证实,血管紧张素转换酶2(angiotensin converting enzyme Ⅱ,ACE2)能够将AngⅡ降解为血管紧张素(1-7)[angiotensin 1-7,Ang(1-7)][5-6],其生理作用与AngⅡ相反,因此能够抑制由于AngⅡ增加引起的多种病理损伤[7-9]。但是,AngⅡ-ACE2-Ang(1-7)系统在高盐和高脂引起的MS及靶器官损伤中的作用机制尚存在争议。肾脏损伤在MS的最早期即可出现,也是预后最严重的MS靶器官损伤。为此,本研究采用高盐高脂饮食喂养C57BL/6小鼠建立代谢综合征模型,并尝试通过血管紧张素转换酶抑制剂依那普利,AngⅡ1型受体(AT1R)拮抗剂缬沙坦,以及Ang(1-7)特异性Mas受体阻滞剂A-779进行干预,观察小鼠肾脏改变及AngⅡ-ACE2-Ang(1-7)的表达变化,以探讨RAS系统在高盐高脂诱发的MS肾脏损伤中的作用及机制。
1 材料与方法
1.1 主要试剂及仪器 缬沙坦(山东益健药业有限公司),依那普利(扬子江药业集团),A-779(RyBiotech)、AngⅡ、Ang(1-7)ELISA试剂盒(武汉优尔生公司),ACE2抗体(美国Novus公司),皮下包埋渗透式微量泵(美国Alzer公司),新陈代谢笼(苏杭科技器材有限公司),自动生化分析仪(Olympus AU600),微量血糖仪(德国罗氏诊断有限公司),鼠尾血压仪(Softron,BP2010AUL),图片采集显微镜(德国Leica公司),酶标仪(Bio-Rad)。
1.2 实验动物及分组 雄性SPF级C57BL/6小鼠56只,10~12周龄,体重20~25g,由沈阳军区总医院动物实验科提供。饲养条件为室温25℃,空气湿度35%,昼夜以12h为交替。将56只小鼠随机分为7组(每组8只):①正常饮食(normal diet,ND)组,给予标准普通饮食(0.3%氯化钠,10%脂肪);②高盐饮食(high salt diet,HSD)组,给予单纯高盐饮食(8%氯化钠,10%脂肪);③高脂饮食(high fat diet,HFD)组,给予单纯高脂饮食(0.3%氯化钠,60%脂肪);④高盐高脂饮食(high salt and high fat diet,HSFD)组,给予高盐高脂饮食(8%氯化钠,60%脂肪);⑤高盐高脂饮食+依那普利(Enalapril)20mg/ (kg·d)干预(HSFD-E)组;⑥高盐高脂饮食+缬沙坦(Valsartan)50mg/(kg·d)干预(HSFD-V)组;⑦高盐高脂饮食+缬沙坦50mg/(kg·d)+血管紧张素(1-7)受体Mas抑制剂A-779 150ng/(kg·d)联合干预(HSFD-VA)组。上述各组小鼠均持续喂养16周。
1.3 基础代谢指标测定 采用大小鼠无创血压仪(softron,BP2010)连续检测各组小鼠尾动脉血压,血压值采用小鼠清醒状态下稳定5min后,5~10个成功测定的血压值的平均值。将小鼠置于新陈代谢笼中收集24h尿液,检测尿蛋白。禁食6~8h后,采集小鼠尾静脉血进行血糖测定;腹腔注射水合氯醛麻醉,颈动脉取血,采用全自动生化分析仪检测血钠、甘油三酯及总胆固醇。称量小鼠肠系膜、附睾旁及肾周脂肪作为内脏脂肪重量。
1.4 肾脏纤维化检测 小鼠处死后,留取肾脏行石蜡包埋,切片后行常规HE染色及Masson染色,光镜下观察,对肾脏损伤程度进行对比分析。
1.5 肾脏组织ACE2蛋白及Ⅲ型胶原的表达 将小鼠肾脏组织剪碎后加入蛋白裂解液和蛋白酶抑制剂,在研磨器中研磨成匀浆;将匀浆置于4℃离心机离心(13 000×g,10min),留取上层蛋白,采用Western blotting检测肾脏组织中ACE2和Ⅲ型胶原的表达,以β-actin作为内参。电泳90~120min,转膜30~60min,用5%牛奶封闭60min,加入ACE2(Novus公司)、Ⅲ型胶原(Abcom公司)抗体,4℃孵育过夜;洗膜,加入二抗孵育120min;再洗膜3次,加入发光液,压片显影。
1.6 血清AngⅡ及Ang(1-7)水平检测 取小鼠颈动脉血,1000×g离心15min,收集血清。取待测血清50μl加入ELISA试剂盒检测孔中,根据说明书进行操作,于450nm波长下酶标仪测量光密度(A)值,结合标准曲线计算出待测血清中AngⅡ及Ang(1-7)浓度。
1.7 统计学处理 采用SPSS 17.0软件进行统计学分析,计量资料以表示。多组间比较采用单因素方差分析,进一步两两比较采用Tukey多重比较法。P<0.05为差异有统计学意义。
2 结 果
2.1 高盐高脂饮食对C57BL/6小鼠代谢的影响 喂养16周后,HSFD组小鼠代谢指标均显著高于正常饲料及单纯高盐饲料喂养的小鼠(P<0.05),并且与其他饮食组比较,HSFD组小鼠出现明显的蛋白尿(P<0.05)。HSFD组小鼠的收缩压及内脏脂肪重量/体重较HFD组明显增高(P<0.05),但两组间总胆固醇、甘油三酯及血糖差异无统计学意义(P>0.05,表1)。
表1 各饮食组小鼠基础代谢指标的比较(±s,n=8)Tab.1 Comparison of basal metabolic index in different diet groups of mice (±s,n=8)
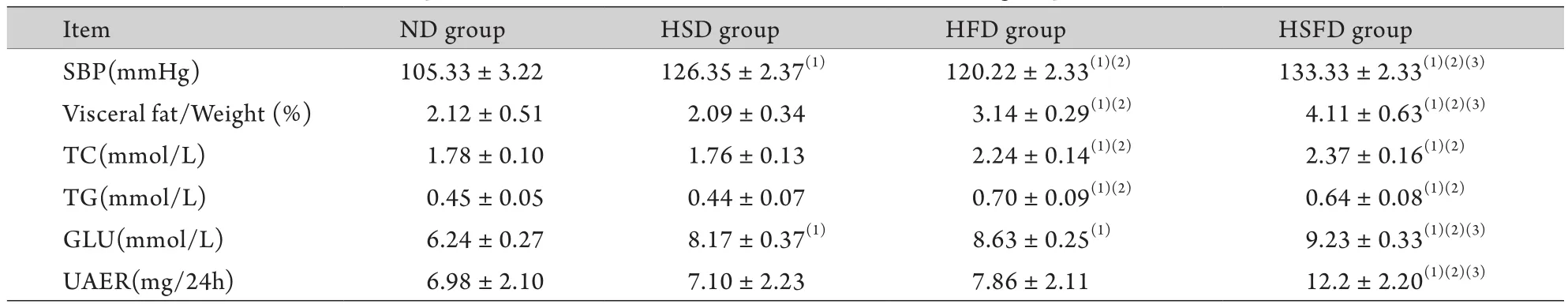
表1 各饮食组小鼠基础代谢指标的比较(±s,n=8)Tab.1 Comparison of basal metabolic index in different diet groups of mice (±s,n=8)
SBP. Systolic blood pressure; TC. Total cholesterol; TG. Triglyceride; GLU. Blood glucose; UAER. Urinary albumin excretion rate. (1)P<0.05 compared with ND group; (2)P<0.05 compared with HSD group; (3)P<0.05 compared with HFD group
ItemND groupHSD groupHFD groupHSFD group SBP(mmHg)105.33±3.22126.35±2.37(1)120.22±2.33(1)(2)133.33±2.33(1)(2)(3)Visceral fat/Weight (%)2.12±0.512.09±0.343.14±0.29(1)(2)4.11±0.63(1)(2)(3)TC(mmol/L)1.78±0.101.76±0.132.24±0.14(1)(2)2.37±0.16(1)(2)TG(mmol/L)0.45±0.050.44±0.070.70±0.09(1)(2)0.64±0.08(1)(2)GLU(mmol/L)6.24±0.278.17±0.37(1)8.63±0.25(1)9.23±0.33(1)(2)(3)UAER(mg/24h)6.98±2.107.10±2.237.86±2.1112.2±2.20(1)(2)(3)
2.2 高盐高脂饮食对小鼠肾脏病理损伤的影响HE染色结果显示,连续喂养16周后,HSFD组小鼠肾小球及肾小管肿胀,并伴有炎细胞浸润。Masson染色结果显示,喂养16周后HSD组、HFD组及HSFD组小鼠肾脏均出现不同程度纤维化,以HSFD组最明显,表现为Masson染色呈蓝色部分(即Ⅲ型胶原表达)明显增多。
2.3 不同饮食组小鼠AngⅡ、Ang(1-7)及ACE2蛋白表达水平 ELISA检测结果显示,喂养16周后,与ND组比较,HSFD组小鼠血清AngⅡ水平明显增高,Ang(1-7)水平明显降低(P<0.01)。HSD组、HFD组小鼠血清AngⅡ水平与ND组比较轻度增加,Ang(1-7)水平呈轻度下降,但差别无统计学意义(P>0.05)。Western blotting检测发现,HSFD组小鼠肾脏组织中ACE2蛋白表达与ND组比较显著降低(P<0.05)。
2.4 不同药物干预后小鼠的基础代谢情况 高盐高脂饮食同时给予不同药物干预后,检测各组基础代谢指标发现,给予依那普利(HSFD-E组)、缬沙坦(HSFD-V组)和缬沙坦+A779(HSFD-VA组)后小鼠血压均较未治疗(HSFD组)小鼠明显降低(P<0.05)。HSFD-V组各个代谢指标均有显著改善作用(P<0.05),而HSFD-E组和HSFD-VS组小鼠仅尿蛋白排泄率显著下降(P<0.05),其他代谢指标未见明显缓解(表2)。
表2 干预后各组小鼠基础代谢指标的比较(±s,n=8)Tab.2 Comparison of basal metabolic index in different drug groups of mice after intervention (±s,n=8)

表2 干预后各组小鼠基础代谢指标的比较(±s,n=8)Tab.2 Comparison of basal metabolic index in different drug groups of mice after intervention (±s,n=8)
(1)P<0.05 compared with HSFD group; (2)P<0.05 compared with HSFD-E group; (3)P<0.05 compared with HSFD-V group
ItemHSFD groupHSFD-E groupHSFD-V groupHSFD-VA group SBP(mmHg)133.33±2.33114.32±1.12(1)115.33±2.17(1)115.01±1.37(1)Visceral fat/Weight(%)4.11±0.634.08±0.203.00±0.33(1)(2)4.12±0.30(3)TC(mmol/L)2.37±0.162.21±0.052.01±0.11(1)(2)2.12±0.10(3)TG(mmol/L)0.64±0.080.59±0.010.55±0.03(1)(2)0.60±0.05(3)GLU(mmol/L)9.23±0.338.78±0.237.98±0.33(1)(2)8.98±0.30(3)UAER(mg/24h)12.20±2.209.00±0.84(1)8.22±1.22(1)11.22±1.33(2)(3)
2.5 不同药物干预后小鼠的肾脏病理改变 病理学检测发现,高盐高脂饮食联合不同药物干预后,HSFD-V组肾脏损伤程度较HSFD组明显减轻,而HSFD-E及HSFD-VS组小鼠肾脏损伤与HSFD组比较未见缓解(图1)。
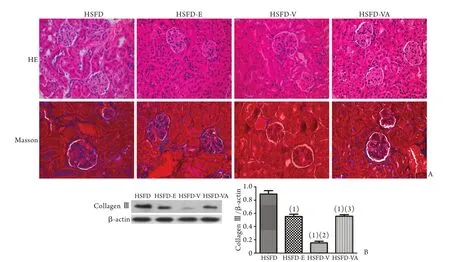
图1 不同药物干预后小鼠的肾脏病理变化Fig.1 Renal pathological changes in different drug groups of mice
2.6 不同药物干预后小鼠AngⅡ、Ang(1-7)及ACE2蛋白表达水平 HSFD-V组小鼠血清及肾脏组织中AngⅡ、Ang(1-7)及ACE2表达水平与HSFD组比较均明显增加(P<0.05),HSFD-E和HSFD-VS组AngⅡ表达水平与HSFD组比较明显降低(P<0.05),而ACE2和Ang(1-7)表达水平与HSFD组比较无明显改变(图2)。
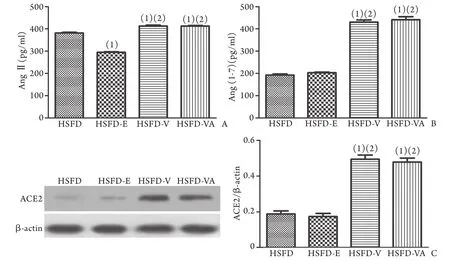
图2 不同药物干预组小鼠AngⅡ(A)、Ang(1-7) (B)、ACE2(C)表达水平Fig. 2 Expression of angiotensin Ⅱ (A), angiotensin (1-7) (B) and ACE2 (C) in different drug groups of mice
3 讨 论
高脂、高盐饮食在生活水平日益提高的今天普遍存在,随之而来的是各种代谢异常性疾病,如高血压、高血脂及糖调节受损等,严重危害着人类的健康[10-11]。在MS中较为重要的病理生理基础是血管病变[12]。毛细血管团组成的肾小球是肾脏的主要组成部分之一,也是MS的重要靶器官[13]。因此,寻找MS肾脏损伤的发生机制,有针对地的进行预防和治疗已成为代谢性疾病的研究重点[12,14-16]。本研究发现,高盐高脂饮食喂养16周后,C57/BL6小鼠出现代谢异常,同时肾脏出现明显纤维化损伤,证实通过长期饲喂高盐高脂饮食能够成功建立MS及肾脏损伤的小鼠模型。进一步研究发现,MS小鼠肾脏中AngⅡ表达明显升高,ACE2及Ang(1-7)表达明显下降。根据上述指标变化,为明确RAS信号分子在MS肾脏损伤中的作用,本研究分别选择血管紧张素转换酶抑制剂依那普利,AT1R拮抗剂及ACE2激动剂缬沙坦,以及缬沙坦联合Ang(1-7)特异性Mas受体的拮抗剂A779进行干预,结果发现依那普利可明显降低血压及蛋白尿,但对其他代谢异常指标及肾脏病理损伤无明显改善,同时还发现依那普利仅降低了血清AngⅡ的表达,对ACE2及Ang(1-7)无促进作用。给予缬沙坦干预后,高盐高脂引起的代谢异常和肾脏病理损伤均有明显改善,且ACE2及Ang(1-7)的表达明显增加,提示ACE2和Ang(1-7)可能在对抗高盐高脂引起的MS肾损伤中起重要作用。为检测上述假设,我们同时给予缬沙坦联合Ang(1-7)下游作用RAS的阻断剂A779,以对抗Ang(1-7)的生物学效应,结果发现,抑制Ang(1-7)的生物学作用后,即使ACE2表达增加也不能对MS和肾脏损伤起到保护作用,提示在AngⅡ-ACE2-Ang(1-7)系统中,发挥保护作用最重要的分子是Ang(1-7)。
在RAAS系统中,AngⅡ是主要的核心因子,它能引起血管的异常收缩,促进细胞增生、增殖以及细胞外基质的增多,在多种疾病的发生中起重要作用[17]。然而,近年来ACE2和Ang(1-7)的发现,为RAAS增加了重要成员,它们不仅可对抗ACE诱导的AngⅡ生成,同时又能降解AngⅡ,在机体保护中起到更加重要的作用[5]。高盐高脂饮食上调了血清中AngⅡ的水平,与此同时肾脏中ACE2及Ang(1-7)的表达下降,使肾脏的保护因子减少,这可能是MS合并肾脏损伤的重要机制之一。但是否存在其他相关机制,还有待进一步研究。
综上所述,本研究从生活中常见的高盐高脂饮食出发,成功建立了MS的C57BL/6小鼠模型,并初步阐明了RAS系统中AngⅡ增加伴随Ang(1-7)减少是高盐高脂饮食导致MS和肾脏损伤的相关机制,为今后临床对高盐高脂饮食导致的代谢异常性疾病治疗提供了实验依据。
[1] Despres JP, Lemieux I. Abdominal obesity and metabolic syndrome[J]. Nature, 2006, 444(7121): 881-887.
[2] Zhao D. Dignostic criteria, pathophysiological mechanisms and insulin sensitivity of metabolic syndrome[J]. J Zhengzhou Univ (Med Sci), 2010, 45(5): 705-708. [赵狄. 代谢综合征的诊断标准、病理生理机制及胰岛素敏感性评估[J]. 郑州大学学报(医学版), 2010, 45(5): 705-708.]
[3] Ruggenenti P, Cravedi P, Remuzzi G. The RAAS in the pathogenesis and treatment of diabetic nephropathy[J]. Nat Rev Nephrol, 2010, 6(6): 319-330.
[4] Kobori H, Nangaku M, Navar LG,et al. The intrarenal reninangiotensin system: from physiology to the pathobiology of hypertension and kidney disease[J]. Pharmacol Rev, 2007, 59(3): 251-287.
[5] Ferrario CM, Varagic J. The ANG-(1-7)/ACE2/mas axis in the regulation of nephron function[J]. Am J Physiol Renal Physiol, 2010, 298(6): F1297-F1305.
[6] Wang YZ, Li Y, Fan JQ,et al. Correlation between polymorphism of ACE gene I/D and ACE2 gene A9570G and atrial fibrillation[J]. Med J Chin PLA, 2011, 36(9): 904-908. [王亚珠, 李瑛, 范晋奇, 等. ACE基因I/D和ACE2基因A9570G多态性与心房颤动的相关性研究[J]. 解放军医学杂志, 2011, 36(9): 904-908.]
[7] Pena SR, Chu Y, Miller JD,et al. Impact of ACE2 deficiency and oxidative stress on cerebrovascular function with aging[J]. Stroke, 2012, 43(12): 3358-3363.
[8] Liao K, Sikkema D, Wang C,et al. Development of an enzymatic assay for the detection of neutralizing antibodies against therapeutic angiotensin-converting enzyme 2 (ACE2)[J]. J Immunol Methods, 2013, 389(1/2): 52-60.
[9] Hashimoto T, Perlot T, Rehman A,et al. ACE2 links amino acid malnutrition to microbial ecology and intestinal inflammation[J]. Nature, 2012, 487(7408): 477-481.
[10] Xu XY, Wei YD, Hu DY,et al. Relationship between blood glucose abnormalities and occurrence of cardiocerebral vascular in patients with metabolic syndrome[J]. Clin Med Chin, 2007, 23(4): 310-312. [徐远溪, 魏毅东, 胡大一, 等. 代谢综合征患者糖代谢异常与心脑血管事件关系的研究[J]. 中国综合临床, 2007, 23(4): 310-312.]
[11] Chen FM, Guo ZR, Hu XS,et al. The effects of the different blood lipid components on the T2DM occurrence in metabolic syndrome(MS) versus non-MS patients[J]. Chin J Diabetes, 2011, 19(8): 565-567. [陈冯梅, 郭志荣, 胡晓抒, 等. 代谢综合征与非代谢综合征人群不同血脂成分对2型糖尿病发病风险的影响[J]. 中国糖尿病杂志, 2011, 19(8): 565-567.]
[12] Zhu ZM. Clinical features and pathogenesis of metabolic syndrome[J]. Acta Acad Med Militaris Tertiae, 2009, 31(1): 17-20. [祝之明. 代谢综合征的临床特征与发病机制[J]. 第三军医大学学报, 2009, 31(1): 17-20.]
[13] Singh AK, Kari JA. Metabolic syndrome and chronic kidney disease[J]. Curr Opin Nephrol Hypertens, 2013, 22(2): 198-203.
[14] Czepielewski L, Daruy FL, Brietzke E,et al. Bipolar disorder and metabolic syndrome: a systematic review[J]. Rev Bras Psiquiatr, 2013, 35(1): 88-93.
[15] Perez PM, Moore-Carrasco R, Gonzalez DR,et al. Gene expression of adipose tissue, endothelial cells and platelets in subjects with metabolic syndrome (Review)[J]. Mol Med Rep, 2012, 5(5): 1135-1140.
[16] Zhu ZM. Status and trends of metabolic syndrome[J]. Med J Chin PLA, 2005, 30(8): 680-682. [祝之明. 代谢综合征研究现状和趋势[J]. 解放军医学杂志, 2005, 30(8): 680-682.]
[17] Schmitz U, Berk BC. Angiotensin Ⅱ signal transduction: Stimulation of multiple mitogen-activated protein kinase pathways[J]. Trends Endocrinol Metab, 1997, 8(7): 261-266.
Effects of angiotensin (1-7) on nephrosis of the mice with metabolic syndrome induced by highsalt and high-fat diet
ZHU Nan1, HAN Ya-ling2*, YAN Chen-hui2, ZHANG Xiao-lin2, ZHAO Xin2, ZHANG Yu-jie2, LI Yang2
1Post-graduate School, Liaoning Medical College, Jinzhou, Liaoning 121000, China
2Department of Cardiovascular Disease, General Hospital of Shenyang Command, Shenyang 110840, China
*
, E-mail: yalinghan@gmail.com
This work was supported by the National Basic Research Program of China (973 Program, 2012CB517800)
ObjectiveTo establish a metabolic syndrome model of C57BL/6 mice by high-salt and high-fat diet, and investigate the effects of angiotensin converting enzyme 2 (ACE 2) and angiotensin (1-7) on renal damage in mice.MethodsFifty-six male C57BL/6 mice were randomly divided into 7 groups (8 each), and fed with normal diet (0.3% NaCl, 10% fat), highsalt diet (8% NaCl, 10% fat), high-fat diet (0.3% NaCl, 60% fat), high-salt and high-fat diet (8% NaCl, 60% fat), high-salt and highfat diet with enalapril 20mg/(kg•d), with valsartan 50mg/(kg•d), and with valsartan 50mg/(kg•d) plus Mas receptor antagonist (A-779) 150ng/(kg•d), respectively for 16 weeks. Basal metabolic index including blood pressure, body weight, blood glucose and urinary albumin excretion rate (UAER) were tested. After intraperitoneal anesthesia with chloral hydrate, the blood was collected from the carotid artery. Serum angiotensin Ⅱ and angiotensin (1-7) levels were detected by ELISA; Western blotting was performed to evaluate the expression of ACE 2 protein and collagen Ⅲ in renal tissue; renal pathological changes were observed by HE and Masson staining.ResultsThe blood pressure, ratio of visceral fat weight/body weight, blood lipid, blood glucose and UAER increased significantly in the C57BL/6 mice fed with high-salt and high-fat diet for 16 weeks, and the renal fibrosis change was obvious, serum angiotensin Ⅱ level increased, expressions of ACE 2 and angiotensin (1-7) decreased significantly in renal tissue.In different intervention groups, valsartan obviously alleviated the abnormal metabolism, ameliorated renal injury, promoted the expression of ACE2 and angiotensin (1-7) in the kidney and serum. However, no significant change was observed in the groups with intervention of enalapril or valsartan+A-779 compared with non-intervention group. ConclusionsHigh-salt and high-fat diet can be used to successfully establish the model of metabolic syndrome in C57BL/6 mice. Valsartan, an angiotensin Ⅱ receptor blocker, can alleviate the metabolic abnormality caused by the high-salt and high-fat diet, and the protection mechanism may be related to up-regulation of angiotensin (1-7).
metabolic syndrome X; peptidyl-dipeptidase A; angiotensin Ⅱ type 1 receptor blockers; angiotensin (1-7); nephrosis
R589
A
0577-7402(2013)10-0787-05
10.11855/j.issn.0577-7402.2013.10.001
2013-05-24;
2013-08-13)
(责任编辑:张小利)
国家重点基础研究发展计划(973计划)项目(2012CB517800)
朱男,硕士研究生。主要从事高血压及冠心病的基础研究
121000 辽宁锦州 辽宁医学院研究生院(朱男);110840 沈阳 沈阳军区总医院心内科(韩雅玲、闫承慧、张效林、赵昕、张玉婕、李洋)
韩雅玲,E-mail:yalinghan@gmail.com

