雄黄微生物浸提液稳定性研究
张爽,晏磊,崔玉东,冯丹丹,孙振宇
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
雄黄本身是一种硫化物类矿石,历史十分悠久,因其能够治疗鼠瘘恶疮、疽痔死肌等疾病而在《神农本草经》上有记载[1]。近年发现砷剂可以促进白血病细胞凋亡[2-3],因而引起学术界对含砷中药的高度关注。雄黄的主要成分为不溶于水的硫化砷,还含少量的可溶性砷及其他矿物元素[4]。雄黄的临床运用主要以传统的水飞形式,炮制效率低,不能满足工业化生产的需要。因此,实验引入微生物冶金的成熟技术,利用氧化亚铁硫杆菌(Acidithiobacillμs ferrooxidans,A.f)进行生物炮制[5]。A.f 能够吸附到各种硫化矿表面,并能以其中的低价态的硫作为生长能源物质,将矿物中药雄黄进行微生物的氧化、浸提[6]。
光、热、氧气、pH 及辅料等都会影响药物的稳定性,任何一个药物制剂产品都应在所要求的贮藏条件下,药物含量或效价都应保持在标准要求的限度以上[7-8]。稳定性试验的目的是考察原料或药物制剂在温度、湿度、光线的影响下随时间的变化规律,为对处方组成、制剂工艺、辅料和稳定性附加剂的选用和合适的包装设计提供科学依据,同时通过试验建立药品的有效期。因此,为了增加雄黄在临床上的应用率,对雄黄微生物浸提液的稳定性进行研究。
1 仪器和材料
仪器 电热鼓风干燥箱(上海赛欧试验设备有限公司);250D 光照培养箱(杭州蓝天化验仪器厂);pH S-3C pH 计(意大利哈纳);IRIS Advantage ER/S 型电感耦合等离子体原子发射光谱仪(Thermo Jarrell Ash);YXQ 型XG46-280S 手提式高压蒸汽灭菌锅(上海迅博公司)。
材料 雄黄微生物浸提液;乙二胺四乙酸二钠(EDTA-2Na,AR,北京化工厂);亚硫酸氢钠(NaHSO3,AR,浙江省永嘉县化工试剂厂);重蒸水(自制)。
2 实验方法
2.1 菌株及培养基
A.f 菌株购自美国ATCC,培养基的制备参照Yan 等的方法进行[9]。
2.2 雄黄微生物浸提液制备
雄黄微生物浸提液的制备参照Chen 等的方法进行[1]。
2.3 雄黄微生物浸提液稳定性试验
2.3.1 雄黄微生物浸提液高温稳定性考察
取雄黄微生物浸提液3 批,置60 ℃条件下进行10 d 高温稳定性试验,分别于0、5、10 d 取样[4]。以雄黄浸提液的色泽、溶解情况、pH 值及砷含量为指标,对雄黄微生物浸提液稳定性进行考察。
2.3.2 雄黄微生物浸提液光照稳定性考察
取雄黄微生物浸提液3 批,置照度为4 500±500 lx 条件下放置10 d,分别于0、5、10 d 取样[4]。以雄黄浸提液的溶解情况、色泽、pH 值及砷含量为指标,对雄黄微生物浸提液稳定性进行考察。
2.4 抗氧剂与螯合剂联合应用对雄黄微生物浸提液稳定性的影响
2.4.1 雄黄微生物浸提液高温稳定性考察
取雄黄微生物浸提液3 批,分别按0.03%和0.15%的比例添加EDTA-2Na 和NaHSO3,用0.1M NaOH 调pH 至7.0 后,置于60 ℃条件下进行10 d高温稳定性试验,分别于0、5、10 d 取样。以雄黄浸提液的溶解情况、色泽、pH 值以及砷含量为指标,对雄黄微生物浸提液稳定性进行考察。
2.4.2 雄黄微生物浸提液光照稳定性考察
取雄黄微生物浸提液3 批,分别按0.03%和0.15%的比例添加EDTA-2Na 和NaHSO3,用0.1M NaOH 调pH 至7.0 后,置于照度为4 500±500 lx 条件下放置10 d,分别于0、5、10 d 取样。以雄黄浸提液的溶解情况、色泽、pH 值以及砷含量为指标,对雄黄微生物浸提液稳定性进行考察。
2.5 pH 对雄黄微生物浸提液的影响
取雄黄微生物浸提液3 批,分别按0.03%和0.15%的比例添加EDTA-2Na 和NaHSO3,并分别调节pH 值至5.0、6.0、7.0、8.0、9.0(EDTA-2Na)。将处理好的浸提液均分成2 份,其中1 份置60 ℃条件下进行10 d 高温稳定性试验,另1 份置照度为4 500±500 lx 条件下放置10 d。分别于0、5、10 d 取样,以雄黄浸提液的溶解情况、色泽、pH 值以及砷含量为指标,对雄黄微生物浸提液稳定性进行考察。
3 实验结果
3.1 雄黄微生物浸提液高温稳定性实验结果
雄黄微生物浸提液经第0、5、10 d 取样分析。分析表明:3 批雄黄微生物浸提液的色泽、pH 值无明显变化(见图1),但瓶底有稍许沉淀,使溶液中砷含量降低(见图2)。

图1 雄黄微生物浸提液在60 ℃条件下pH 变化Fig.1 Variation of pH value for realgar bioleachate at 60 ℃

图2 雄黄微生物浸提液在60 ℃条件下砷含量变化Fig.2 Variation of arsenic content for realgar bioleachate at 60 ℃
3.2 雄黄微生物浸提液光照稳定性实验结果
雄黄微生物浸提液经第0、5、10 d 取样分析。分析表明:3 批雄黄微生物浸提液色泽、pH 值无明显变化(见图3),瓶底有少量沉淀,使浸提液中砷含量降低(见图4)。

图3 雄黄微生物浸提液在光照条件下pH 变化Fig.3 Vaiation of pH value for bioleachate at strong light

图4 雄黄微生物浸提液在光照条件下砷含量变化Fig.4 Variation of arsenic content for bioleachate at strong light
3.3 抗氧剂与螯合剂联合应用对雄黄微生物浸提液高温稳定性实验结果
雄黄微生物浸提液经第0、5、10 d 取样分析。分析表明:抗氧剂与螯合剂联合应用后雄黄微生物浸提液澄清,色泽及砷含量(见表1)无明显变化,pH 值呈下降趋势(见图5)。
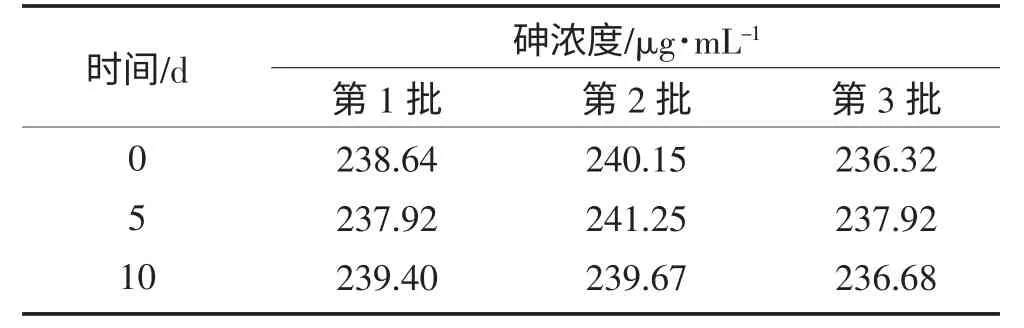
表1 抗氧剂与螯合剂联合应用对雄黄微生物浸提液在60 ℃放置10 d 的砷含量变化Table 1 Variation of arsenic content after laying up at 60 ℃for bioleachate by using antioxidant and chelating agents in 10 d
3.4 抗氧剂与螯合剂联合应用对雄黄微生物浸提液光照稳定性实验结果
雄黄微生物浸提液经第0、5、10 d 取样分析。分析表明:抗氧剂与螯合剂联合应用后雄黄微生物浸提液澄清,色泽及砷含量无明显变化(见表2),pH 值呈下降趋势(见图6)。

图5 抗氧剂与螯合剂联合应用对雄黄微生物浸提液在60 ℃放置10 d 的pH 变化Fig.5 Variation of pH value after laying up at 60 ℃for bioleachate by using antioxidant and chelating agents in 10 d

表2 抗氧剂与螯合剂联合应用对雄黄微生物浸提液在光照条件下放置10 d 的砷含量变化Table 2 Variation of arsenic content after laying up at strong light for bioleachate by using antioxidant and chelating agents in 10 d

图6 抗氧剂与螯合剂联合应用对雄黄微生物浸提液在4 500±500 lx 放置10 d 的pH 变化Fig.6 Variation of pH value after laying up at 4 500±500 lx for bioleachate by using antioxidant and chelating agents in 10 d
3.5 pH 对雄黄微生物浸提液的影响
雄黄微生物浸提液经第0、5、10 d 取样分析,抗氧剂与螯合剂联合应用后,调整浸提液pH 值,雄黄微生物浸提液澄清,色泽及砷含量(见表3、表4)无明显变化,pH 值变化见图7、图8。

图7 高温对雄黄浸提液pH 的影响Fig.7 Effect of high temperature on pH of bioleachate

图8 光照对雄黄浸提液pH 的影响Fig.8 Effect of strong light on pH of bioleachate

表3 抗氧剂与螯合剂联合应用对雄黄微生物浸提液在60 ℃放置10 d 的砷含量变化Table 3 Variation of arsenic content after laying up at 60 ℃for bioleachate by using antioxidant and chelating agents in 10 d

表4 抗氧剂与螯合剂联合应用对雄黄微生物浸提液在光照条件下放置10 d 的砷含量变化Table 4 Variation of arsenic content after laying up at strong light for bioleachate by using antioxidant and chelating agents in 10 d
4 讨论
在A.f 浸提雄黄过程中,A.f 以硫酸亚铁作为能源生长,所以雄黄微生物浸提液中含有三价铁离子。当未加辅料的雄黄微生物浸提液经过高温处理时,高温和光照处理导致三价铁同溶液中的钠离子、铵离子以及钾离子发生反应形成黄钾铁钒沉淀,该沉淀可吸附溶液中的砷[1],导致浸提液砷含量出现了明显的下降(见图2、图4),表明雄黄微生物浸提液不稳定。
为了增加雄黄微生物浸提液的稳定性,我们向雄黄微生物浸提液中加入了抗氧剂和螯合剂。经过高温或光照处理,浸提液的色泽和砷含量无显著变化(见表1、表2),表明加入辅料后,雄黄微生物浸提液稳定性明显增强。这主要是由于三价铁被加入的螯合剂螯合,而抗氧剂能使浸提液中氧含量保持在一个较低的水平。然而,加入抗氧剂和螯合剂后,浸提液的pH 值出现了明显的降低,作为开发雄黄注射剂的原料药,其pH 必须控制在4.0~9.0 间。鉴于此,我们利用EDTA-2Na 调节浸提液的酸碱度后,经过高温或光照处理,结果表明,浸提液的色泽、砷含量及pH 值均无明显变化(见表3、表4、图7、图8),说明加入上述辅料可获得稳定性良好的雄黄微生物浸提液。
5 结论
(1)雄黄微生物浸提液在60 ℃及4 500±500 lx条件下不稳定,在生产、科研及储藏过程中应低温并且避光保存。
(2)螯合剂乙二胺四乙酸二钠和抗氧剂亚硫酸氢钠联合作用于雄黄浸提液,经高温、光照处理后,浸提液色泽及砷含量无明显改变,说明抗氧剂与螯合剂联合应用后,对控制雄黄微生物浸提液的稳定起到积极作用,但浸提液的pH 值出现明显下降,继续加入EDTA-2Na 后,浸提液的pH 值得到了有效控制。
[1]Peng Chen,Lei Yan,Feifan Leng,et al.Bioleaching of realgar by Acidithiobacillus ferrooxidans using ferrous iron and elemental sulfur as the sole and mixed energy sources[J].Bioresour.Technol,2011,102(3):3260-3267.
[2]陆道培,邱镜滢,陈姗姗,等.口服雄黄治疗急性早幼粒细胞白血病(AML-M3)66 例[J].中国实验诊断学,1998(6):319.
[3]宁凝,彭作富,袁兰,等.雄黄纳米微粒对于白血病细胞的诱导凋亡及坏死作用[J].中国中药杂志,2005,30(2):136-140.
[4]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2005.
[5]Jinghong Zhang, Yongqing Ni, Xu Zhang, et al.Bioleaching of arsenic from medicinal realgar by pure and mixed culture [J].Process Biochemistry,2007,42(9):1265-1271.
[6]Peng chen,Lei Yan,Qiang Wang,et al.Surface alteration of realgar (As4S4)by Acidithiobacillus ferrooxidans[J].International Microbiology,2012,15:9-15.
[7]国家食品药品监督管理局.国食药监注[2007]743 中药、天然药物注射剂基本技术要求[S].2007.
[8]崔福德.药剂学[M].5 版.北京:人民卫生出版社,2009.
[9]晏磊,张爽,李雪,等.氧化亚铁硫杆菌的磁性及铁源种类对磁小体合成的影响[J].黑龙江八一农垦大学学报,2012,24(1):23-27.

