高分子抗菌剂的研究现状
左华江,温婉华,吴丁财,符若文
(1 广西工学院生物与化学工程系,广西 柳州 545006;2 中山大学化学与化学工程学院聚合物复合材料及功能材料教育部重点实验室,广东 广州 510275)
致病性微生物严重威胁着人类的生命财产安全。据统计,全球每年约有1700 万人死于细菌感 染[1]。近年来,O-157:H7 致病性大肠杆菌、SARS病毒以及H5N1 病毒的流行,也都曾引起世界性的恐慌。人们在应对这一严峻挑战中发现,研制抗菌制品能有效抵御致病性微生物的侵袭,保障人类健康。与传统的物理、化学灭菌法相比,抗菌制品具有卫生自洁作用,能直接杀死表面的病原性微生物,有效避免交叉感染、抵御传染性疾病;抗菌效果更为长效、广谱、经济、方便;一般不会影响制品以外的空间及微生物环境,安全性能较好。抗菌材料现已成为材料科学中最具活力的领域之一[2-3]。
1 高分子抗菌剂的作用特点
抗菌材料的核心是抗菌剂的研发。经过多年的研究应用,抗菌剂业已形成无机抗菌剂、有机抗菌剂、天然抗菌剂和合成高分子抗菌剂4 大体系。它们的作用方式颇为不同,其中,无机(光催化型的除外)和有机抗菌剂属于释放型抗菌剂,它们被负载在合适的载体中,并被不断释放到周围环境、进入细菌体内以发挥抗菌作用。这会导致活性组分的含量不断下降,抗菌性能也将随之不断降低,直至消失,因此需严格控制释放速率,在满足抗菌需求的同时尽量延长有效期;同时难以避免残余毒性的问题,可能威及人类健康和环境安全[4-8]。由于这些问题的存在,人们不得不寻找更为安全有效的替代品。
开发合成高分子抗菌剂,是人们试图结合天然高分子抗菌剂和有机抗菌剂优点的尝试。人们在深入研究后发现,合成高分子抗菌剂能通过与细菌的直接接触而杀死细菌,并不需要释放活性物质。因此,制品的抗菌性能持久而稳定,残余毒性大大降低,安全性提高。另一个突出的优点是,它们的活性官能团密度远高于有机小分子,这可能使其抗菌性能更为优异。正因如此,高分子抗菌剂的研究在近年来获得极大关注,发展十分迅速[4,8-10]。但需指出的是,由于高分子的尺寸远远大于有机小分子,穿越细胞壁和细胞膜的阻力也将大幅增加,这可能使其难与细菌细胞内部的作用靶位接触。这是部分高分子抗菌剂的活性不如有机小分子的原因[11]。因此,有必要分析归纳不同高分子抗菌剂的特点,从而为后续研究提供参考。
2 高分子抗菌剂的主要类型及其特点
合成高分子抗菌剂的开发至今仅三十余年,研究历史较短。但由于优点突出,它们在近年来获得极大关注,发展十分迅速。目前,已有数量众多的高分子抗菌剂被应用于人类生活的各个方面。根据活性官能团的不同,它们主要可分为聚季铵盐、聚卤胺、聚胍、聚季盐、壳聚糖及其衍生物等多种类别。另外,还有许多高分子抗菌剂是由现有小分子抗菌剂,如万古霉素[12]、丁香酚[13]、诺氟星沙[14]等,经结构改性成可聚合的单体,再经聚合反应而得。它们的抗菌性能各有特点。
2.1 季铵盐类聚合物
在高分子抗菌剂中,季铵盐聚合物的应用研究极为广泛[15]。它们的特点是结构中心为正一价的季铵氮离子(N+),周围有4 个取代基(R1~R4)及抗衡阴离子(如Cl-、Br-、I-等)(图1)[16]。
季铵盐聚合物的制备一般选择“先聚合后季铵化”的路线,如Roy 等先合成甲基丙烯酸二甲基氨基乙酯(DMAEMA)的均聚物PDMAEMA,再采用溴代烷使其季铵化,得到季铵化聚合物[16]。但也有研究采用“先季铵化后聚合”的路线,如鹿桂乾等[17]先采用卤代烷使DMAEMA 季铵化,得到季铵盐单体,再通过自由基聚合制备季铵盐聚合物。相对而言,后者的季铵化程度更高。
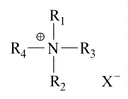
图1 季铵盐化合物的一般结构[16]
季铵盐类聚合物具有抗菌活性高、性能稳定持久、残余毒性及对人体组织的刺激性低等优点,因而备受关注[16,18]。以Calabretta 等[19]开发的聚酰胺- 胺的衍生物为例,它对细菌的半致死量约为LL-37(抗菌肽,属高效抗菌剂)的1/2,毒性却仅约为LL-37 的1/10。Sun 等[20]合成的季铵盐聚合物对S.aureus 和 C.albicans 的MBC 值分别低至20 μg/mL 和50 μg/mL,可与LL-37 等多种市售抗菌剂媲美。
人们普遍认可季铵盐聚合物的抗菌性能依赖于N+的正电性,但对N+的具体作用模式尚未有定论。有研究认为,它们是通过N+与细菌细胞膜(呈电负性)间的静电引力吸附到细菌表面,随后借助于取代烷基的疏水作用,穿透并刺穿细菌细胞膜,进而引起细胞内物质外泄,杀死细菌[17,21-22]。这也是目前最为广泛接受的理论。但也有研究认为,季铵盐聚合物是依靠N+与细胞膜中的Ca2+、Mg2+离子交换,破坏细菌的电荷平衡和结构的完整性,从而发挥抗菌活性[8,23]。
人们对季铵盐聚合物的构效关系进行了大量研究,发现季铵盐聚合物在一定的相对分子质量范围内表现出良好的抗菌活性。相对分子质量偏小时,活性官能团密度低,不足以表现出良好的抗菌活性;相对分子质量偏大时,分子尺寸大,穿透细菌细胞膜的阻力也大,不利于发挥抗菌活性[21,24]。同时,取代烷基链的长度也会明显影响抗菌性能。一般认为,N+的4 条取代烷基链中至少其中一条的碳原子数要达到8~18,以增强与细菌亲脂性磷脂双分子层的相容性,从而更好地破坏细胞膜、杀死细菌[16]。另外,抗衡阴离子和活性官能团与主链的间隔长度等也会影响抗菌性能[22,25-26]。
磷和氮同属第V 族元素,抗菌行为也有很多相似之处。有研究认为,季盐类聚合物的抗菌活性来源于P+的正电荷性质。P+与季铵氮N+相同,均采用sp3杂环轨道与4 个烷基碳连接,形成稳定的四面体结构。不同的是,磷属第三周期元素,离子半径大于第二周期元素氮,所以,季盐的极化作用和正电性更强,抗菌活性也更高[27-29]。例如,Kenawy等[30]合成了结构类似的季盐聚合物(a)、小分子季盐(b)及季铵盐聚合物(c),化学结构见图2。发现季盐聚合物(a)的抗菌活性竟比季铵盐聚合物(c)高两个数量级;同时,季盐聚合物(a)由于活性官能团密度远远高于小分子化合物(b),抗菌活性也明显更高。不过,尽管季盐聚合物在抗菌活性上具有很大优势,但其成本过高,难以规模化应用。
2.3 卤胺类聚合物
高分子抗菌剂中,卤胺类聚合物相对较新[31-32],结构特点是重复单元中含有一个或多个卤胺键[31]。理论上而言,酰胺N 上的氢都可被卤素取代、形成卤胺键。Badrossamay 等[33]就在聚乙烯(PE)的表面接枝丙烯酰胺,经卤化后材料获得抗菌活性。但相对而言,研究更多的是杂环状乙内酰胺。
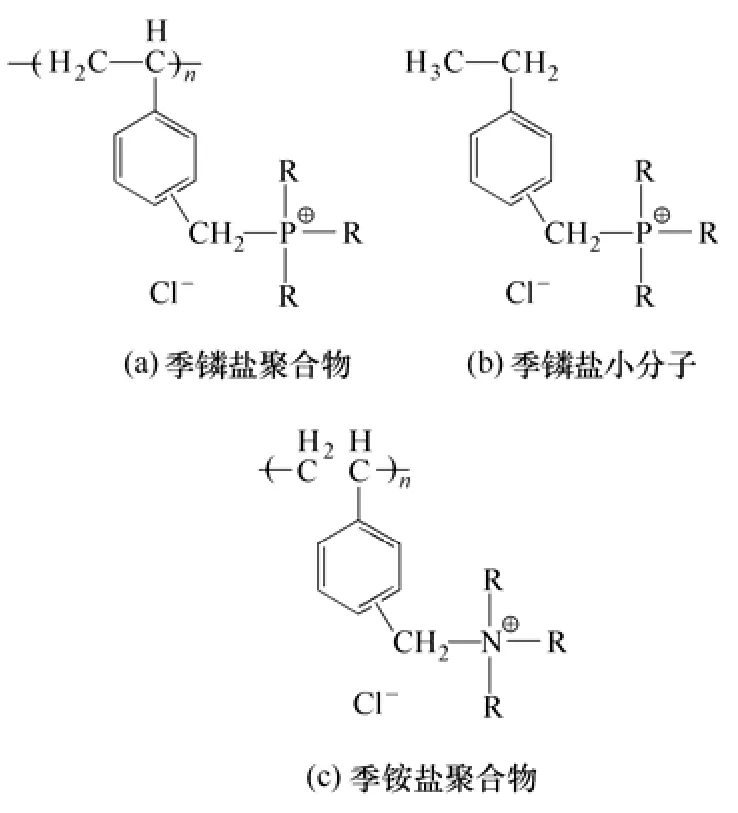
图2 季鏻盐聚合物、季盐小分子和季铵盐聚合物的化学结构[30]

图3 ADMH 单体的合成[37]
图3 是常见的制备杂环状乙内酰胺单体的路 线,Jang 等[34]就据此合成了ADMH 单体[图3(b)]。他们在二氧化硅微球表面引发了ADMH 与甲基丙烯酸甲酯(MMA)共聚,并随后对其进行卤化处理。最终所得微球对革兰阳性菌(G+菌)和革兰阴性菌(G-菌)均有良好的抗菌性能,特别是G+菌。
卤胺类聚合物的抗菌活性较高,它们既能释放强氧化性的卤素阳离子到微生物体内,破坏细胞酶的活性和代谢过程[35],也能通过与细菌的直接接触而发挥抗菌活性[36]。有研究认为,微生物不可能对卤胺聚合物形成耐药性,且它们的抗菌活性可再生。当抗菌性能不能满足需求时,简单的卤化处理就能使卤素存量提高,抗菌性能恢复[37]。但要注意,卤化步骤对抗菌活性影响很大。
研究也发现,一般而言,聚合物的亲水性越好,Tg越低,酰胺化合物越易形成稳定的卤胺结构,且在水中浸泡2月后FT-IR 谱图无明显变化[37];同时,亲水性越好,越容易释放卤素和与细菌接触,抗菌活性也更高,但它们的抗菌时效将会相对缩短[37]。
需要注意的是,卤胺聚合物在抗菌过程中会释放卤素。现有研究已证明,卤素能与水中有机物反应生成致癌致突变的副产物,从而影响到人体健康和环境安全。因此,需要全面评估卤胺聚合物的安全性能,并注意应用领域的选择。
2.4 胍类聚合物
胍类高分子抗菌剂包括聚胍盐(PGs)和聚双胍盐(PBGs)[38]。一般是通过缩聚法制得,对相对分子质量和形状的控制较差。例如,Wei 等[39]通过 己二胺与盐酸胍的缩聚合成盐酸聚六亚甲基胍(PHMG),具有3 种线性和4 种环状或支化结构。但Bromberg 等[40]开发的新路线见图4,即通过乙烯基甲酰胺的聚合、NaOH 催化水解及胍化反应,能制备结构较为规整的、新型线性聚胍盐PVG,化学结构见图4。所得PVG 能有效杀死多种G+菌及G-菌,活性比PVAm(化学结构见图3)高10~40 倍,与商用聚胍类抗菌剂Akacid plus 相当。这可能有利于胍类抗菌剂的大规模应用。

图4 PVG 的合成[40]
胍类高分子属于强阳离子化合物,它们能迅速吸附到带负电的细菌细胞膜上,并与细胞膜内的Ca2+和Mg2+等发生离子交换,破坏细胞膜的电荷平衡;也能破坏磷脂的生物活性和细胞膜的结构,最终杀死细菌[39]。它们的抗菌性能决定于重复单元的结构、相对分子质量、聚合物的结构等因素。研究发现,当PHMG 的相对分子质量为640~956 Da 时,抗菌性能良好;环状或支化聚合物的电荷密度比线性聚合物高,抗菌性能更好[39]; 二元胺的链长度增加,会增大胍基间的距离,导致抗菌性能下降;碳酸胍会与二元胺反应生成脲,不适合制备胍类抗菌聚合物,但盐酸胍适合[9]。
2.5 壳聚糖类聚合物
壳聚糖是天然高分子抗菌剂的代表,具有安全无毒、抗菌活性高的优点。但它的溶解性差、不溶于水和绝大部分的有机溶剂、黏度大、抗菌活性易受pH 值影响、不适宜用于酸碱性较强的环境中,导致应用大大受限[41]。
为了克服上述缺点,人们设计合成了大量壳聚糖衍生物。其中,研究最多的水溶性壳聚糖衍生物可通过以下3 种途径获得:①控制甲壳素的脱乙酰化或壳聚糖的乙酰化反应条件[41];②利用壳聚糖上的氨基或羟基引入亲水基团、改善水溶性,例如,壳聚糖经羧甲基化、酰化、羟乙基化[42]或磺化[43]反应,都能得到水溶性壳聚糖(图5);③降解大相对分子质量的壳聚糖[41]。有些基团不仅能改善壳聚糖的水溶性,还能与它协同抗菌,例如,壳聚糖的季铵化衍生物[44-45]。
人们对壳聚糖及其衍生物的抗菌机理进行了大量研究,并提出了多种理论:①通过静电引力吸附在细菌细胞膜上,形成一层多孔膜,破坏细胞膜的渗透性,使其无法正常吸收营养物质和泵出有害物质[46]以及破坏细胞膜的完整性,引起细胞内物质外渗[47];②相对分子质量小于5000 Da 的壳聚糖能扩散到微生物体内,与DNA 及其它电负性的物质作用会抑制mRNA 的合成,破坏其正常的生理活 动[48];③壳聚糖的氮含量高,螯合能力强,能选择性地与一些痕量金属结合,抑制细菌毒素的产生和细菌的繁殖[41,45]。实际的抗菌过程可能是其中一种或多种机理的组合,而它们的抗菌活性与脱乙酰化程度、相对分子质量、pH 值、金属离子、离子强度等多个因素有关[49]。
2.6 万古霉素类聚合物
人们试图以现有的小分子抗菌剂为模板,合成更多安全有效的高分子抗菌剂。但聚合物的分子尺寸大,难以进入细菌体内与酶、DNA、RNA 等作用靶位结合,因而很难保持原有活性[14]。但万古霉素(结构式见图6)是个例外,它的改性研究获得了成功。
例如,Arimoto 等[50]通过V3 位置(标于图6中)氨基的反应,引入冰片烯单元,随后使冰片烯开环易位聚合,从而获得了抗菌活性明显增强的万古霉素聚合物,它甚至能有效杀灭耐万古霉素菌(VRE)。这可能是因为聚合提高了万古霉素的活性官能团密度,与VRE 细胞壁结合的能力增强。而Lawson 等[51]通过V3 和X1 处氨基的反应,引入可聚合的丙烯酸官能团,得到4 种万古霉素衍生物,随后通过辐照法,使其接枝聚合在基材表面,如图7 所示。虽然均聚物活性不及万古霉素,但仍能使表面细菌浓度降低7~8 个数量级,效果良好。而均聚物的抗菌性能与其结构有关,如在X1 处进行结构改性时产物的抗菌性能更好;PEG 的相对分子质量由3400 Da 增加到5000 Da,抗菌性能下降。

图5 水溶性壳聚糖的代表[42-43]

图6 万古霉素的结构式
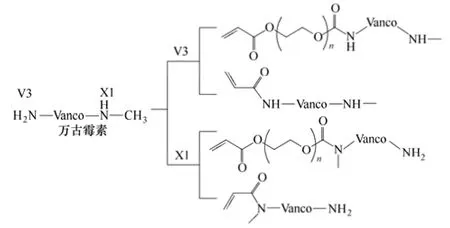
图7 4 种可聚合的万古霉素衍生物的结构
万古霉素聚合物的成功开发对研究者是个很大的鼓舞,类似尝试却常以抗菌性能显著下降而告终。例如,把丁香酚转化为聚合物后,扩散杀菌能力显著下降[13];而诺氟星沙聚合物需在较高浓度下才能有效杀死细菌[14]。改性效果的差异可能与作用机理有关。有研究指出,万古霉素的分子结构类似杯形,它能够以5 个氢键(由5 个羟基及氨基形成)、专一地与细胞壁前质末端的D-Ala-D-Ala 结合,使细胞壁前质不能加到正在成长的胜醣上,后续的转糖酶与肽基转移酶也无法继续作用,导致新生细胞壁结构松散,不能承受菌体内强大的渗透压,因此破裂死亡[50-52]。由此可知,万古霉素的作用靶位在细菌表面。而诺氟星沙主要是通过抑制DNA 的 合成而抗菌,丁香酚也需与菌体内的酶接触而抗 菌[53],它们的作用靶位都在细菌细胞内部。这可能意味着在筛选开发抗菌聚合物时,应选择能与细菌表面作用的有机抗菌剂。
3 结 语
由于抗菌方式不同,与无机或有机抗菌剂相比,高分子抗菌剂在安全性上具有突出优势,因此,有望在对安全性要求更高的抗菌领域获得应用。例如,在水处理中常用卤素抗菌消毒,而卤素已被指出易与有机物反应、生成易致癌致畸的毒害物质。若开发表面覆盖不溶性高分子抗菌剂的过滤网或过滤膜,能够有效吸附并杀死细菌,并避免活性物质释放而导致的残余毒性问题[9,54-55]。特别是季铵盐及其它一些高分子抗菌剂,它们在抗菌过程中不会发生结构上的改变,使用一段时间后洗涤除去表面吸附的细菌残骸,就能使抗菌性能恢复,因此可以循环利用,在成本上具有良好优势[55]。同时,高分子抗菌剂也可在植入性医疗材料中得到应用。植入性医疗材料如导尿管[56-57]、牙科填充树脂[58]、钛合金等骨科材料[59]等,在现代医疗中应用越来越广泛,但它们易受细菌侵袭,一旦感染很难有效治疗。若在这些材料表面接入适量的高分子抗菌剂,可以持久有效地抗菌,降低细菌感染的概率,且产生耐药性的可能性也远低于抗生素。目前,高分子抗菌剂的研发虽已取得一定进展,但距广泛应用仍有较大差距,因此研究空间巨大。随着研究的深入,高分子抗菌剂必将为保障人类的生命财产安全做出更多贡献。
[1] 刘耀斌,李彦锋,拜永孝. 高聚物抗菌材料的研究现状及展望[J]. 材料导报:综述篇,2010,24(7):123-127.
[2] 季君晖,史维明. 抗菌材料[M]. 北京:化学工业出版社,2003:8-15.
[3] 刘奇民. 抗菌材料的“今生”与“来世”[J]. 新材料产业,2009(7):22-24.
[4] Tashiro T. Antibacterial and bacterium adsorbing macromolecules[J]. Macromo. Mater. Eng.,2001,286(2):63-87.
[5] Imazato S,Ebi N,Takahashi Y,et al. Antibacterial activity of bactericide-immobilized filler for resin-based restoratives[J]. Biomaterials,2003,24(20):3605-3609.
[6] Punyani S,Singh H. Preparation of iodine containing quaternary amine methacrylate copolymers and their contact killing antimicrobial properties[J]. J. Appl. Polym. Sci.,2006,102(2):1038-1044.
[7] Vasilev K,Cook J,Griesser H J. Antibacterial surfaces for biomedical devices[J]. Expert. Rev. Med. Devic.,2009,6(5):553-567.
[8] Lenoir S,Pagnoulle C,Galleni M,et al. Polyolefin matrixes with permanent antibacterial activity : Preparation ,antibacterial activity ,and action mode of the active species[J].Biomacromolecules,2006,7(8):2291-2296.
[9] Albert M,Feiertag P,Hayn G,et al. Structure-activity relationships of oligoguanidines-influence of counterion,diamine,and average molecular weight on biocidal activities[J]. Biomacromolecules,2003,4(6):1811-1817.
[10] Song J,Kong H,Jang J. Enhanced antibacterial performance of cationic polymer modified silica nanoparticles[J]. Chem. Commun.,2009(34):5418-5420.
[11] Chen C Z,Beck Tan N C,Dhurjati P,et al. Quaternary ammonium functionalized poly(propylene imine) dendrimers as effective antimicrobials:Structure-activity studies[J]. Biomacromolecules,2000,1(3):473-480.
[12] Arimoto H,Nishimura K,Kinumi T,et al. Multi-valent polymer of vancomycin:Enhanced antibacterial activity against VRE[J]. Chem. Commun.,1999(15):1585- 1586.
[13] Rojo L,Vazquez B,Parra J,et al. From natural products to polymeric derivatives of "Eugenol":A new approach for preparation of dental composites and orthopedic bone cements[J]. Biomacromolecules,2006,7(10):2751-2761.
[14] Dizman B,Elasri M O,Mathias L J. Synthesis,characterization,and antibacterial activities of novel methacrylate polymers containing norfloxacin[J]. Biomacromolecules,2005,6(1):514-520.
[15] Zuo H,Wu D,Fu R. Preparation of antibacterial poly(methyl methacrylate) by solution blending with water-insoluble antibacterial agent poly[(tert-buty1amino) ethyl methacrylate][J]. J. Appl. Polym. Sci.,2012,125(5):3537-3544..
[16] Roy D,Knapp J S,Guthrie J T,et al. Antibacterial cellulose fiber via RAFT surface graft polymerization[J]. Biomacromolecules,2007,9(1):91-99.
[17] Lu G Q,Wu D C,Fu R W. Studies on the synthesis and antibacterial activities of polymeric quaternary ammonium salts from dimethylaminoethyl methacrylate[J]. React. Funct. Polym.,2007,67(4):355-366.
[18] Ferreira L,Zumbuehl A. Non-leaching surfaces capable of killing microorganisms on contact[J]. J. Mater. Chem.,2009,19(42):7796-7806.
[19] Calabretta M K,Kumar A,McDermott A M,et al. Antibacterial activities of poly(amidoamine) dendrimers terminated with amino and poly(ethylene glycol) groups[J]. Biomacromolecules,2007,8(6):1807-1811.
[20] Sun H Y,Li J,Qiu X L,et al. Synthesis and structure-activity relationship (SAR) of novel perfluoroalkyl-containing quaternary ammonium salts[J]. J. Fluorine Chem.,2005,126(9-10):1425-1431.
[21] Chen C Z S,Cooper S L. Interactions between dendrimer biocides and bacterial membranes[J]. Biomaterials,2002,23(16):3359-3368.
[22] Kenawy E-R,Worley S D,Broughton R. The chemistry and applications of antimicrobial polymers:A state-of-the-art review[J]. Biomacromolecules,2007,8(5):1359-1384.
[23] Kugler R,Bouloussa O,Rondelez F. Evidence of a charge-density threshold for optimum efficiency of biocidal cationic surfaces[J]. Microbiol.-Sgm.,2005,151:1341-1348.
[24] Ikeda T,Hirayama H,Ymaguchi H. Polycationic biocides with pendant active groups:Molecular weight dependence of antibacterial activity[J]. Antimicrob. Agents Ch.,1986,30(1):132-136
[25] Chen C Z,Beck Tan N C,Dhurjati P,et al. Quaternary ammonium functionalized poly(propylene imine) dendrimers as effective antimicrobials:Structure-activity studies[J]. Biomacromolecules,2000,1(3):473-480.
[26] Pasquier N,Keul H,Heine E,et al. From multifunctionalized poly- (ethylene imine)s toward antimicrobial coatings[J]. Biomacromolecules,2007,8(9):2874-2882.
[27] Kenawy E R,Abdel-Hay F I,Shahada L,et al. Biologically active polymers. IV. Synthesis and antimicrobial activity of tartaric acid polyamides[J]. J. Appl. Polym. Sci.,2006,102(5):4780-4790.
[28] Kanazawa A,Ikeda T,Endo T. Novel polycationic biocides:Synthesis and antibacterial activity of polymeric phosphonium salts[J]. J. Polym. Sci. Polym. Chem.,1993,31(2):335-343.
[29] Kanazawa A,Ikeda T,Endo T. Polymeric phosphonium salts as a novel class of cationic biocides. Ⅶ. Synthesis and antibacterial activity of polymeric phosphonium salts and their model compounds containing long alkyl chains[J]. J. Appl. Polym. Sci.,1994,53(9):1237-1244.
[30] Kenawy E R,Mahmoud Y A G. Biologically active polymers,6-Synthesis and antimicrobial activity of some linear copolymers with quaternary ammonium and phosphonium groups[J]. Macromol. Biosci.,2003,3(2):107-116.
[31] Sun Y Y,Sun G. Novel refreshable N-halamine polymeric biocides:N-chlorination of aromatic polyamides[J]. Ind. Eng. Chem. Res.,2004,43(17):5015-5020.
[32] Chen Y,Worley S D,Huang T S,et al. Biocidal polystyrene beads. Ⅲ. Comparison of N-halamine and quat functional groups[J]. J. Appl. Polym. Sci.,2004,92(1):363-367.
[33] Badrossamay M R,Sun G. A study on melt grafting of N-halamine moieties onto polyethylene and their antibacterial activities[J]. Macromolecules,2009,42(6):1948-1954.
[34] Jang J,Kim Y. Fabrication of monodisperse silica-polymer core-shell nanoparticles with excellent antimicrobial efficacy[J]. Chem. Commun.,2008(34):4016-4018.
[35] Li Q L,Mahendra S,Lyon D Y,et al. Antimicrobial nanomaterials for water disinfection and microbial control:Potential applications and implications[J]. Water Res.,2008,42(18):4591-4602.
[36] Ahmed A E S I,Hay J N,Bushell M E,et al. Optimizing halogenation conditions of N-halamine polymers and investigating mode of bactericidal action[J]. J. Appl. Polym. Sci.,2009,113(4):2404-2412.
[37] Sun Y Y,Sun G. Durable and refreshable polymeric N-halamine biocides containing 3-(4′-vinylbenzyl)-5,5-dimethylhydantoin[J]. J. Polym. Sci. Pol. Chem.,2001,39(19):3348-3355.
[38] Morra M,Cassinelli C,Cascardo G,et al. Adsorption of cationic antibacterial on collagen-coated titanium implant devices[J]. Biomed. Pharmacother.,2004,58(8):418-422.
[39] Wei D F,Ma Q X,Guan Y,et al. Structural characterization and antibacterial activity of oligoguanidine (polyhexamethylene guanidine hydrochloride)[J]. Mat. Sci. Eng. C-Mater.,2009,29(6):1776-1780.
[40] Bromberg L ,Hatton T A. Poly(N-vinylguanidine) :Characterization ,and catalytic and bactericidal properties[J]. Polymer,2007,48(26):7490-7498.
[41] 吴勇,黎碧娜. 壳聚糖水溶性改性研究进展[J]. 广州化工,1999,27(4):1-4.
[42] Liu X F,Song L,Li L,et al. Antibacterial effects of chitosan and its water-soluble derivatives on E-coli,plasmids DNA,and mRNA[J]. J. Appl. Polym. Sci.,2007,103(6):3521-3528.
[43] Yu D G,Lin W C,Lin C H,et al. Cytocompatibility and antibacterial activity of a PHBV membrane with surface-immobilized water-soluble chitosan and chondroitin-6-sulfate[J]. Macromol. Biosci.,2006,6(5):348-357.
[44] Sajomsang W,Gonil P,Tantayanon S. Antibacterial activity of quaternary ammonium chitosan containing mono or disaccharide moieties : Preparation and characterization[J]. Int. J. Biol. Macromol.,2009,44(5):419-427.
[45] Rabea E I,Badawy M E T,Stevens C V,et al. Chitosan as antimicrobial agent : Applications and mode of action[J]. Biomacromolecules,2003,4(6):1457-1465.
[46] Helander I M,Nurmiaho-Lassila E L,Ahvenainen R,et al. Chitosan disrupts the barrier properties of the outer membrane of Gram-negative bacteria[J]. Int. J. Food Microbiol.,2001,71(2-3):235-244.
[47] Raafat D,Bargen von K,Haas A,et al. Insights into the mode of action of chitosan as an antibacterial compound[J]. Appl. Environ. Microb.,2008,74(12):3764-3773.
[48] Kumar B A V,Varadaraj M C,Tharanathan R N. Low molecular weight chitosan : Preparation with the aid of pepsin ,characterization,and its bactericidal activity[J]. Biomacromolecules,2007,8(2):566-572.
[49] 吴俊,夏文水. 非生物性因素对壳聚糖抗菌活性的影响[J]. 食品科学,2004,27(4):1-4.
[50] Arimoto H,Nishimura K,Kinumi T,et al. Multi-valent polymer of vancomycin:Enhanced antibacterial activity against VRE[J]. Chem. Commun.,1999(15):1361-1362.
[51] Lawson M C,Shoemaker R,Hoth K B,et al. Polymerizable vancomycin derivatives for bactericidal biomaterial surface modification:Structure-function evaluation[J]. Biomacromolecules,2009,10(8):2221-2234.
[52] Arimoto H,Oishi T,Nishijima M,et al. Affinity of a vancomycin polymer with bacterial surface models[J]. Tetrahedron. Lett.,2001,42(19):3347-3350.
[53] Alexander O G,Richard A H. Mechanisms of bactericidal action of cinnamaldehyde against Listeria monocytogenes and of eugenol against L. monocytogenes and Lactobacillus sakei[J]. Appl. Environ. Microb.,2004,70(10):5750-5755.
[54] Moustafa H Y. Preparation and characterization of grafted polysaccharides based on sulphadiazine[J]. Pigm. Resin. Technol.,2006,35(2):71-75.
[55] Hu F X,Neoh K G,Cen L,et al. Antibacterial and antifungal efficacy of surface functionalized polymeric beads in repeated applications[J]. Biotechnol. Bioeng.,2005,89(4):474-484
[56] Vasilev K,Cook J,Griesser H J. Antibacterial surfaces for biomedical devices[J]. Expert Rev. Med. Devic.,2009,6(5):553-567.
[57] McCubbin P J,Forbes E,Gow M M,et al. Covalent attachment of quaternary ammonium compounds to a polyethylene surface via a hydrolyzable ester linkage:Basis for a controlled- elease system of antiseptics from an inert surface[J]. J. Appl. Polym. Sci.,2006,100 (1):538-545.
[58] Yoshikawa K,Clark D T,Brailsford S R,et al. The effect of antibacterial monomer MDPB on the growth of organisms associated with root caries[J]. Dent. Mater. J.,2007,26(3):388-392.
[59] Yuan S J,Pehkonen S O,Ting Y P,et al. Inorganic-organic hybrid coatings on stainless steel by layer-by-layer deposition and surface-initiated atom-transfer-radical polymerization for combating biocorrosion[J]. Acs. Appl. Mater. Inter.,2009,1(3):640-652.

