两相体系中固定化黏红酵母CCZU-G5催化合成(R)-2-羟基-4-苯基丁酸乙酯
汪 云 , 王利群 ,2,何玉财 ,2,朱 劼 ,卿 青 ,王明慧
(1常州大学制药与生命科学学院,江苏 常州 213164;2常州市药品制造与质量控制工程重点实验室,江苏 常州 213164)
(R)-2-羟基-4-苯基丁酸乙酯[(R)-HPBE]是合成众多普利类系列血管紧张肽转化酶抑制剂(ACEI)类抗高血压和充血性心力衰竭药的关键手性中间体[1],其制备方法主要有化学法和生物法[2-7]。其中利用生物催化剂直接对前手性酮进行不对称还原,理论上可将前体100%转化为目标产物,是目前高效合成(R)-HPBE的最有效方法之一。
目前,已有不少研究者报道了通过筛选微生物菌株不对称还原 2-氧代-4-苯基丁酸乙酯合成(R)-HPBE,何春茂等[5]筛选出一株对OPBE具有良好还原能力的菌株Bacillus pumilusPhe-C3,在 25 mmol/L的底物浓度下产率达74.5%,e.e.值达97%。Zhang等[2]以Candida kruseiSW2026为催化剂,在底物浓度为12 mmol/L时,获得的产率和e.e.值分别为 95.1%和 99.7%。由于底物和产物在水中溶解度较低,同时高浓度的底物和产物对细胞具有一定的毒性,因此在水相中微生物对OPBE的催化还原仅能在低浓度下进行,难以达到满意的催化效果。Shi等[6]用面包酵母为催化剂,研究了在水/苯两相体系中催化OPBE制备(R)-HPBE,产率和e.e.值分别达到67.1%和96.2%。汪庆等[7]采用固定化细胞催化拆分得到(R)-HPBE,连续转化 12次后细胞活性未明显下降。
因此,筛选出具有高立体选择性还原OPBE微生物菌株及建立合适的生物催化反应体系对于高效合成高光学纯(R)-HPBE有着重要的意义。本研究从土壤中筛选出一株对OPBE具有更高催化活性和立体选择性还原酶微生物菌株,通过将细胞进行固定化并在水/有机溶剂两相体系中不对称还原 OPBE合成(R)-HPBE,为生物催化合成(R)-HPBE工业化提供参考。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂
Agilent 1260高效液相色谱仪,手性柱 OD-H柱(4.6 mm×250 mm,5 μm),日本 Daicel公司;GC-950气相色谱仪,上海海欣色谱仪器有限公司;R2ID旋转蒸发器,巩义市予化仪器制造有限公司;THZ-072 HT恒温摇床,上海博彩生物科技有限公司。
2-羰基-4-苯基丁酸乙酯,纯度>99%,常州武进精细化工有限公司;(R)-2-羟基-4-苯基丁酸乙酯,色谱纯,Sigma公司;海藻酸钠,CP,国药集团化学试剂有限公司;其它试剂均为国产色谱纯或分析纯。
1.1.2 培养基
(1)富集培养基M1 (g/L) 葡萄糖 1.0,酵母膏 5.0,K2HPO41.0,KH2PO41.0,OPBE 4.0,pH值为7.0。
(2)平板初筛培养基M2 (g/L) 酵母膏 3.0,(NH4)2SO45.0,K2HPO41.0,KH2PO41.0,MgSO40.1,琼脂20,OPBE 4.0,pH值为7.0。
(3)发酵培养基M3 (g/L) 葡萄糖 20,蛋白胨 10,酵母膏 10,(NH4)2SO42.0,MgSO41.0,K2HPO41.0,KH2PO41.0,pH值为7.0。
1.2 方法
1.2.1 菌株筛选
(1)富集培养 取20 g土壤于50 mL无菌水中,摇匀,静置一段时间,取2 mL于50 mL的富集培养基中,30 ℃,180 r/min振荡培养48 h,如此转接2次。
(2)平板初筛 将上述菌液稀释105倍后均匀涂布到含一定浓度的OPBE的初筛培养基中,30 ℃恒温培养2~3天。
(3)发酵培养 将上述平板上长出的单菌落活化后保种,并接到 M3的发酵培养基中发酵培养72 h。
(4)催化反应 将培养好的菌体于4 ℃、8000 r/min离心 10 min,弃上清液,菌体用 PBS(0.1 mol/L,pH =7.0)洗涤两次后进行催化反应。反应体系包括PBS 5 mL,菌体0.2 g,底物20 mmol/L。
1.2.2 目标菌株的培养
将筛选到的目标菌株发酵液按5% (体积比)的接种量接入装有50 mL发酵培养基的250 mL锥形瓶中,于30 ℃、180 r/min摇床培养72 h。8000 r/min,4 ℃离心10 min收集菌体,0.9%生理盐水洗涤3次,用于后续的固定化。
1.2.3 细胞固定化方法
将收集的菌体称取20.0 g悬浮于100 mL的生理盐水中,搅拌均匀。再加入等体积的 3%海藻酸钠,充分搅拌混合均匀。用7#注射器吸取上述混合液滴入到2%的CaCl2溶液中,得到直径为3 mm左右的红色球状固定化细胞,钙化2 h后收集固定化细胞,用生理盐水洗净,4 ℃冰箱冷藏备用。1 g湿菌体可得4.5 g固定化细胞(沥干)。
1.2.4 两相体系中生物催化还原反应
在 50 mL具塞三角瓶中加入不同体积的 20 mmol/L的Tris-HCl(pH=7.5)缓冲液和有机溶剂(两相总体积为20 mL),再加入一定量的OPBE,然后加入一定量的固定化细胞和一定量的辅底物,置于摇床中30 ℃,180 r/min下转化一定时间。4 ℃下8000 r/min离心10 min,取出上层有机相,下层水相用等体积乙酸乙酯萃取3次,合并有机相,无水硫酸钠干燥过夜,分析产物的产率和对映体过量值(e.e.)。在固定化细胞重复利用实验中,反应结束后用生理盐水洗涤固定化细胞3次,滤纸吸干表面水分后用于下一批次转化。
1.2.5 分析方法
(1)产率测定 采用气相色谱检测,以十二烷为内标物的内标法定量。色谱柱为毛细管柱(25 m×0.25 mm×0.25 μm)。气相色谱条件:载气为H2,流量为2.0 mL/min,分流比1∶50,气化温度和检测温度均为 250 ℃,柱温 160 ℃保留 1.5 min,以10 ℃/min 升温至230 ℃维持10 min。
(2)e.e.值测定 采用带手性柱的高效液相色谱法。流动相正己烷∶异丙醇=95∶5;流速 1 mL/min;柱温20 ℃;紫外检测波长225 nm。
产物的产率(Yield)和对映体过量值(e.e.)计算式如式(1)、式(2)。

式中,Ci为底物OPBE 的初始摩尔浓度;CHPBE为反应终止时产物摩尔浓度;AR和AS分别表示R型和S型产物的峰面积。
2 结果与讨论
2.1 高选择性目标菌株的筛选结果
从200份土壤中利用富集培养技术进行筛选,获得1株编号G5的微生物菌株能够高立体选择性不对称催化还原 20 mmol/L OPBE合成(R)-HPBE(产率76.3%,e.e.值99.2%)。经上海生工生物有限公司测序鉴定该菌为黏红酵母(Rhodotorula mucilaginosa),命名为Rhodotorula mucilaginosaCCZU-G5。
2.2 有机溶剂的筛选
有机溶剂的存在可以提高转化体系中底物和产物的溶解度[8],进而提高产物的产率。实验考察了OPBE浓度为100 mmol/L转化体系中不同lgP值有机溶剂(Vaq/Vorg=1/1)对还原反应的影响,结果如表1所示。在lgP值较小的乙酸乙酯、苯、甲苯与水组成的两相体系中转化24 h,无产物生成,这可能是由于这些有机溶剂对固定化酵母细胞毒性或抑制作用较大。而在lgP值较大的壬烷和癸烷与水组成的两相体系中,产率也只能达到65%,这可能是因为底物OPBE在二者中溶解度(数据未给出)较低造成。很明显,在水/异辛烷两相体系中产物的产率最高,达72.1%,e.e.值>99.0%。综合考虑产物产率和e.e.值,选用水/异辛烷两相体系为最适的反应体系用于后续的实验研究。
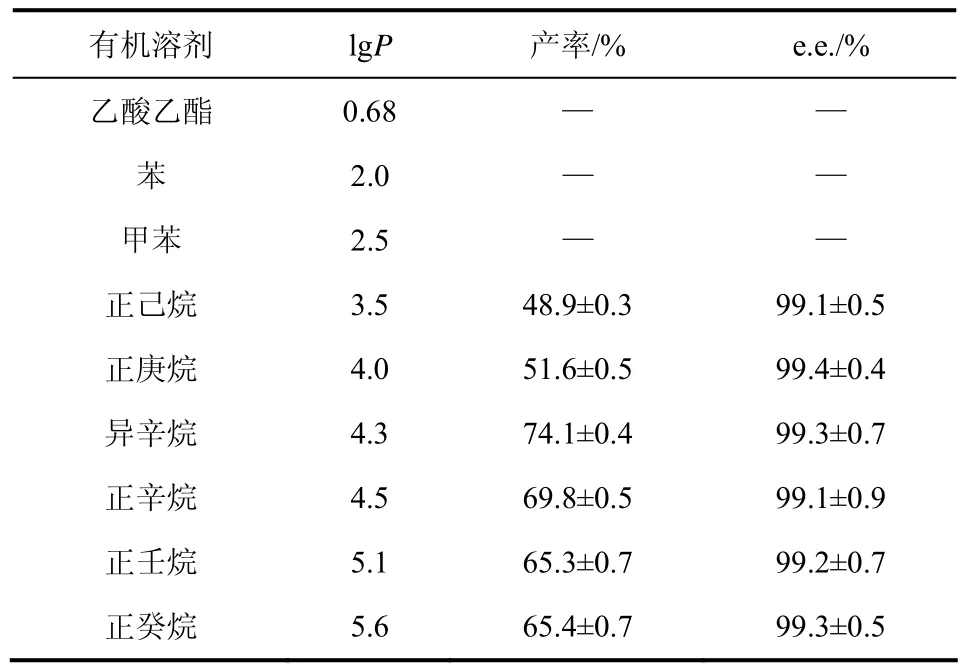
表1 不同有机溶剂的两相体系中固定化酵母不对称还原OPBE的情况
2.3 最适反应时间
两相体系中不对称还原的反应时间对反应的产率和 e.e.值影响很大,实验首先测定了在底物浓度为100 mmol/L,异辛烷比例为50%的水/有机溶剂转化体系中反应时间对还原反应的影响,如图 1所示。在水/异辛烷两相体系中固定化酵母细胞还原OPBE随着反应时间的延长,产率和e.e.值都逐渐提高,转化16 h产率和e.e.都维持不变,分别为74.1%和99.5%。因此,最适反应时间为16 h。
2.4 有机溶剂比例对还原反应的影响


两相反应体系中,提高有机溶剂的比例,底物和产物的溶解度增大,产率也随之提高,但由于有机溶剂对细胞的毒害作用,有机溶剂比例过高也会导致产率下降[9-10]。本研究进一步考察了不同体积比(5%~60%)异辛烷对转化(R)-HPBE的影响,结果如图2所示,当异辛烷含量为10%时,产物的产率较高,为83.2%,继续提高有机溶剂比例,产率下降,有机溶剂的比例对反应的 e.e.值无明显影响。这与Rekuć等[11]阐述的结果一致。故本实验选择 10%异辛烷作为水/有机溶剂两相反应体系进行后续研究。
2.5 不同辅底物对还原反应的影响
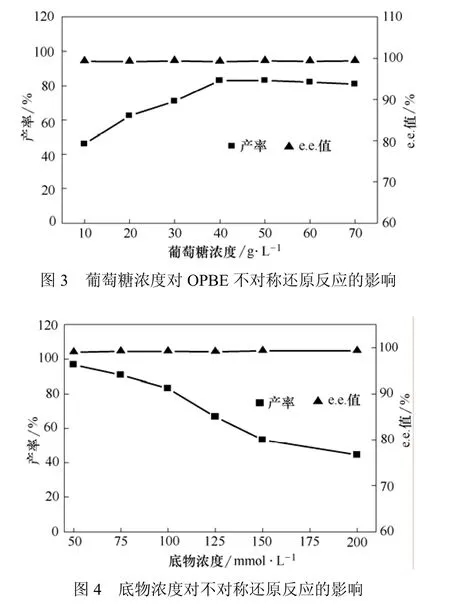
绝大多数全细胞的不对称催化需要有辅酶再生体系与还原反应耦合,以维持反应的进行[10]。不同的辅底物对生物转化反应的效果不同。在底物浓度为100 mmol/L,10%异辛烷的水/有机溶剂两相体系中,以未添加辅助底物为对照,考察了添加6种不同辅底物(乙醇、异丙醇、甘油、葡萄糖、蔗糖、乳糖)对还原反应的影响(表2)。由表2可知,不同的辅助底物对反应的影响较大。其中添加葡萄糖作为辅底物时,产率达到最大。在此基础上,进一步考察了10~70 g/L的不同葡萄糖浓度对还原反应的影响,结果如图3所示,随着葡萄糖浓度的增加,产率逐渐上升;当葡萄糖含量达到40 g/L时,产率达到最高,继续增大葡萄糖的浓度,产率没有明显提高,而葡萄糖浓度对整个反应的e.e.值影响不大,均保持在 99%以上。综合考虑成本与来源因素,选择 40 g/L 葡萄糖辅作为辅底物用于后续实验的研究。
2.6 初始底物浓度对还原反应的影响
对于生物催化而言,反应体系中不同初始浓度的底物对微生物催化的不对称还原反应有一定影响[12]。本研究考察了不同初始OPBE浓度(50~200 mmol/L)对还原反应的影响,结果如图4所示。在两相体系中反应16 h,底物浓度对产物的e.e.值影响不大。当底物浓度为50 mmol/L时,产率为96.5%。随着底物浓度的增加,产物的产率逐渐降低,当底物浓度为100 mmol/L和200 mmol/L时,产率分别为 83.3%和 44.0%,这说明底物对生物催化剂有一定的抑制作用。然而,Rhodotorula mucilaginosaCCZU-G5 催化活性明显比文献[2,5-6,13]报道的结果要高,可见固定化黏红酵母在合成(R)-HPBE中有着潜在的应用前景。

表2 不同辅助底物对OPBE不对称还原(R)-HPBE反应的影响
2.7 固定化催化剂用量对还原反应的影响

生物催化体系中,催化剂用量对还原反应有直接影响[14]。本研究分别考察了在100 mmol/L的底物浓度下不同用量的固定化细胞(0.2~0.5 g/mL)对还原反应的影响,结果见图5。从图5可以看出,随着催化剂用量的增加,产物的产率增加,在0.45 g/mL固定化酵母细胞作用下产率达到83.5%,继续提高催化剂用量产率不再增加。固定化细胞用量的改变对 e.e.值影响不大,维持在 99%以上。因此,固定化细胞最适添加量为0.45 g/mL。
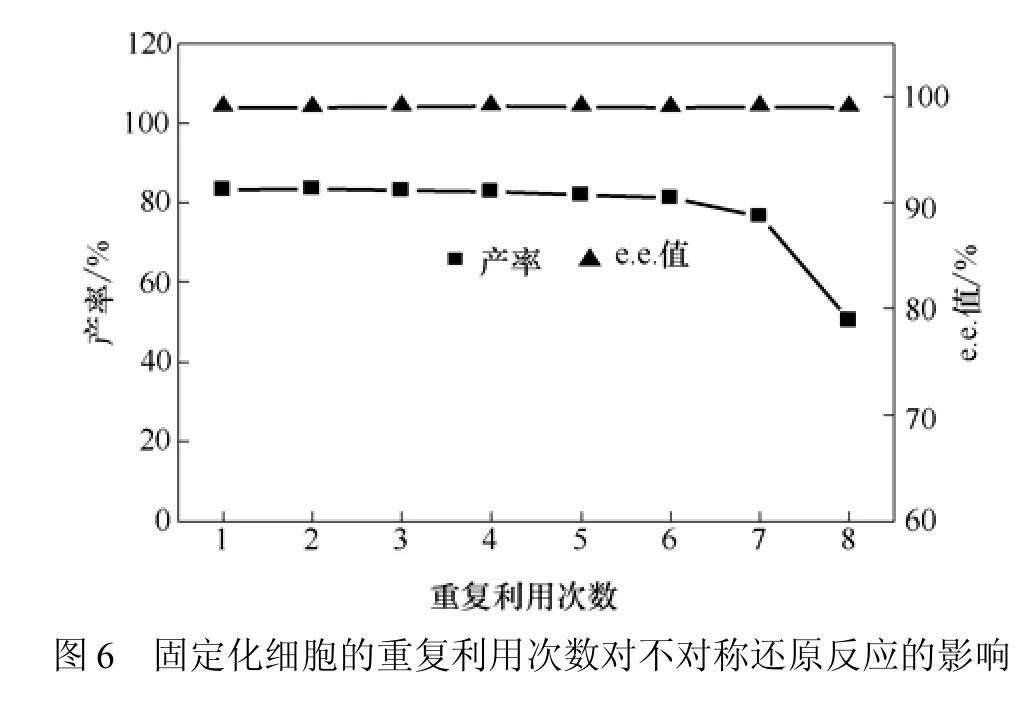
2.8 固定化细胞重复利用次数对还原反应的影响
在优化上述反应条件的基础上,考察 100 mmol/L底物浓度下固定化细胞重复利用次数对于还原反应的影响。为了维持固定化细胞的机械强度,在多批次转化过程中加入0.05%的CaCl2(未加时固定化细胞有明显的吸胀),结果见图6。从图6可知,固定化细胞稳定性较好,随着转化次数的增多,产率下降的幅度较小,在第7个周期后产率还维持在70%以上,至第8个周期开始显著下降。固定化细胞的重复利用对产物的 e.e.值影响不大,均维持在99%以上,说明固定化细胞稳定性较好。
3 结 论
从土样中筛选得到一株能高效催化OPBE不对称还原合成(R)-HPBE的菌株,并鉴定为黏红酵母,通过将细胞进行固定化并在水/有机溶剂两相体系中不对称还原OPBE合成(R)-HPBE,研究得到以下结论。
(1)不同的有机溶剂对还原反应有着显著的影响,lgP在3.5以上的有机溶中,用水/异辛烷组成的两相体系可以获得较好的催化效果。
(2)两相体系中有机溶剂的比例、初始底物浓度、辅助底物的种类和浓度以及催化剂用量对还原反应也有显著的影响,当初始底物浓度为 100 mmol/L,在含10%异辛烷、辅底物葡萄糖40 g/L、催化剂用量0.45 g/mL的两相体系中反应16 h,产率为83%。另外,上述条件对反应的e.e.值影响不大,均维持在 99%以上。这比之前报道的所有在单水相和两相体系中所获得的产率和光学纯度都要高。
(3)两相体系中固定化细胞可重复 7次,产率和e.e.值都维持在较高水平,稳定性较好。
[1]Urbach H,Henning R.A favorable diastereoselective synthesis ofN-(1-S-ethoxycarbonyl-3-phenylpropyl)-S-alanine[J].Tetrahedron Letters,1984,25(11):1143-1146.
[2]Zhang W,Ni Y,Sun ZH,et al.Biocatalytic synthesis of ethyl(R)-2-hydroxy-4-phenylbutyrate withCandida kruseiSW2026:A practical process for high enantiopurity and product titer[J].Process Biochemistry,2009,44(11):1270-1275.
[3]王利群,汪庆,何玉财,等.一株脂肪酶产生菌及其脂肪酶催化性质的初步研究[J].化工进展,2012,31(3):643-648.
[4]Lacerda P S B,Ribeiro J B,Leite S G F,et al.Microbial enantioselective reduction of ethyl 2-oxo-4-phenylbutyrate[J].Biochem.Eng.J.,2006,28(3):299-302.
[5]何春茂,常东亮,张杰.生物催化不对称还原法制备(R)-和(S)-2-羟基-4-苯基丁酸乙酯[J].精细化工,2008,25(7):720-723.
[6]Shi Y G,Fang Y,Wu H P,et al.Asymmetric reduction of ethyl 2-oxo-4-phenylbutyrate with Baker’s yeast in water/organic biphasic system[J].Journal of Biotechnology,2008,136:S361.
[7]汪庆,王利群,何玉财,等.固定化沙雷氏菌脂肪酶拆分(R,S)-2羟基-4-苯基丁酸乙酯[J].精细化工,2012,29(3):250-253,307.
[8]León R,Fernandes P,Pinheiro H M,et al.Whole-cell biocatalysis in organic media[J].Enzyme Microb.Technol.,1998,23(7-8):483-500.
[9]薛颖,张芳,王旻,等.两相体系中固定化生物合成(S)-3,5-双三氟甲基苯乙醇[J].中国医药工业杂志,2009,40(8):573-577.
[10]Kataoka M,Bohani L P S,Wada M,et al.Escherichia colitransformant expressing the glucose dehydrogenase gene fromBacillus megateriumas a cofactor regenerator in a chiral alcohol production system[J].Biosci.Biotechuol.Biochem.,1998,62(1):167-169.
[11]Rekuć A,Jastrzembska B,Liesiene J,et al.Comparative studies on immobilized laccase behaviour in packed-bed and batch reactors[J].J.Mol.Catal.B:Enzym.,2009,57(1-4):216-223.
[12]Nakamura K,Kawai Y,Nakajima N,et al.Stereochemical control of microbial reduction 17:A method for controlling the enantioselectivity of reductions with Baker’s yeast [J].J.Org.Chem.,1991,56(15):4778-4783.
[13]李泳宁,石贤爱,孟春,等.非水相固定化酵母催化的(S)-2-辛醇的不对称合成[J].药用生物技术,2006,13(6):446-450.
[14]杨锦,方世银,石贤爱.水相中酿酒酵母催化 3-氯-1-苯丙酮的不对称还原反应[J].过程工程学报,2011,11(2):324-328.

