上调mir-7表达后肺腺癌细胞对吉非替尼敏感性的变化及其机制研究
赵俊刚,任开明,汤隽,张磊
上调mir-7表达后肺腺癌细胞对吉非替尼敏感性的变化及其机制研究
赵俊刚,任开明,汤隽,张磊
目的观察上调人肺腺癌A549细胞中mir-7的表达水平后,细胞对吉非替尼敏感性的变化及其可能机制。方法取对数生长期A549细胞,随机分为对照组(NC组)、转染组(mir-7组)、吉非替尼组(吉非替尼处理细胞,G组)、联合组(转染mir-7后用吉非替尼处理细胞,G+mir-7组)。MTT法检测吉非替尼对A549细胞的半数抑制浓度(IC50),Realtime PCR及Western blotting检测表皮生长因子受体(EGFR)、胰岛素样生长因子受体1(IGF-1R)、Raf1、细胞外信号调节激酶(ERK)的mRNA和蛋白表达水平。结果G+mir-7组吉非替尼对A549细胞的IC50(8.57±0.61μmol/L)明显低于G组(15.63±0.82μmol/L,P<0.01)。Real-time PCR及Western blotting检测结果显示,G+mir-7组EGFR、IGF-1R、Raf1、ERK的mRNA及蛋白表达水平明显低于mir-7组、G组和NC组(P<0.05)。结论上调mir-7表达可增加肺腺癌细胞对吉非替尼的敏感性,其机制可能与mir-7抑制EGFR及IGF-1R通路有关。
癌,非小细胞肺;吉非替尼;微小RNAs
非小细胞肺癌(non-small cell lung cancer,NSCLC)是临床常见的肿瘤之一。吉非替尼是一种表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),常用于NSCLC治疗,其作用机制为抑制有丝分裂原活化蛋白激酶的活化,促进细胞凋亡,抑制肿瘤血管生成,但临床上有部分患者对EGFR-TKI治疗不敏感,或对该类药物最终产生耐药。因此,研究如何增强肿瘤细胞对吉非替尼的敏感性具有重要的临床意义。小RNA是一种短小的内源性非编码RNA分子,可以通过与对应的靶向mRNA的3'端非翻译区完全或非完全配对结合,导致靶向基因的翻译抑制及靶向mRNA的降解[1-3]。本研究将mir-7转染至肺腺癌A549细胞,采用MTT法检测吉非替尼对A549细胞半数抑制浓度(IC50)的变化,Real-time PCR及Western blotting检测表皮生长因子受体(EGFR)、胰岛素样生长因子受体1(IGF-1R)、Raf1、细胞外信号调节激酶(ERK)的mRNA和蛋白表达改变,观察上调mir-7表达水平后A549细胞对吉非替尼敏感性的改变,并对其可能的作用机制进行探讨。
1 材料与方法
1.1主要材料及试剂 人类肺腺癌A549细胞由中国医科大学中心实验室提供,采用RPMI 1640培养基(Gibco公司)培养,并加入10%热灭活小牛血清(Gibco公司)。mir-7序列从mirBase数据库(www. mirbase.com)检索获得。mir-7模拟物、小RNA阴性对照、荧光小RNA购自上海吉玛(Genephama)公司。mRNA和microRNA提取及反转录试剂盒、Real-time PCR试剂盒购自TaKaRa公司。吉非替尼(Iressa)购自Astrazeneca公司,溶解于二甲亚砜(DMSO)中,浓度为10mmol/L,-20℃长期保存,使用前用培养基稀释到所需浓度。MTT购自Sigma公司。鼠抗人EGFR(sc-377229)、鼠抗人IGF-1R(sc-81464)、兔抗人Raf1(sc-227)、鼠抗人ERK(sc-271291)单克隆抗体均购自Santa Cruz公司。
1.2MTT法检测吉非替尼对A549细胞的IC50变化 取状态良好的对数生长期细胞,0.25%胰酶消化后制成细胞悬液,接种于96孔板中,每孔(0.5~1.0)×104个细胞(体积100µl)。培养24h后,使用50nmol/L浓度的mir-7 mimics及小RNA阴性对照进行转染,每组5个复孔。转染24h后,加入不同浓度(0、2.5、5、12.5、25μmol/L)的吉非替尼,48h后每孔加入新鲜配制的5mg/ml MTT 20μl,继续培养4h,弃去培养液,每孔加入150μl DMSO,37℃低速震荡10min,采用酶联免疫检测仪测定490nm处的吸光度(A)值。按公式计算细胞增殖抑制率(IR):IR=(A对照组-A实验组)/A对照组×100%。绘制细胞增殖抑制率曲线,并计算吉非替尼的IC50。实验重复3次。
1.3Real-time PCR检测EGFR、IGF-1R、Raf1、ERK mRNA表达水平的变化 取对数生长期A549细胞,随机分为对照组(NC)、转染组(50nmol/L的mir-7转染,mir-7组)、吉非替尼组(12.5μmol/ L吉非替尼处理细胞,G组)、联合组(50nmol/ L的mir-7转染后用12.5μmol/L吉非替尼处理细胞,G+mir-7组)。各组进行相应处理后,用Trizol一步法提取细胞总RNA,采用TaKaRa试剂盒进行反转录(20μl反应体系),反转录条件:37℃ 15min,85℃ 15s。引物序列:EGFR正义5'-GCGTTCGGCACGGTGTATAA-3',反义5'-GGCTTTCGGAGATGTTGCTTC-3';IGF-1R正义5'-ACGCCAATAAGTTCGTCCAC-3',反义5'-GGCTTTCGGAGATGTTGCTTC-3';Raf1正义5'-GCACTGTAGCACCAAACC-3',反义5'-CTGGGACTCTATCACCAATA-3';ERK正义5'-ACCTGCTCATCAACACCACC-3',反义5'-CGTAGCCACATACTCCGTCA-3';β-actin正义5'-ATGATATCGCCGCGCTCGTC-3',反义5'-CGCTCGGTGAGGATCTTCA-3'。采用罗氏LightCycler实时荧光定量PCR仪进行Real-time PCR反应。各目的mRNA表达量采用2-ΔΔCt法表示。
1.4Western blotting检测EGFR、IGF-1R、Raf1、ERK蛋白表达水平的变化 实验分组同1.3。处理后的各组细胞在4℃下使用RIPA裂解液(含PMSF,1:100)进行处理,离心提取上清,采用BCA法进行总蛋白定量。SDS-PAGE电泳(浓缩胶20mA、分离胶35mA)并转膜后,使用含有5%牛奶的TBST(含0.05% Tween 20)进行封闭,然后分别加入EGFR、Raf1、IGF-1R、ERK抗体(1:200稀释)后进行孵育(4℃、12h),再加入辣根过氧化物酶标记的二抗(1:5000稀释)孵育2h,ECL化学发光法显色,使用ECL发光仪采集图像,并用GENE SNAP软件进行分析。
1.5统计学处理 采用SPSS 13.0软件进行统计分析。数据结果以±s表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结 果
2.1吉非替尼对A549细胞的IC50MTT法检测显示,吉非替尼对mir-7转染的A549细胞的IC50为8.57±0.61μmol/L,明显低于未转染的对照细胞(15.63±0.82μmol/L,P<0.01)。
2.2各组EGFR、IGF-1R、ERK和Raf1的mRNA表达水平 G+mir-7组A549细胞中EGFR、IGF-1R、ERK、Raf1 mRNA表达量明显低于G组、mir-7组及NC组(P<0.05),G组明显低于mir-7组、NC组,mir-7组明显低于NC组,差异均有统计学意义(P<0.05,图1)。
2.3各组EGFR、IGF-1R、ERK和Raf1的蛋白表达水平 Western blotting检测显示,G+mir-7组A549细胞中EGFR、IGF-1R、ERK、Raf1蛋白表达量明显低于G组、mir-7组及NC组(P<0.05),G组明显低于mir-7组、NC组,mir-7组明显低于NC组,差异均有统计学意义(P<0.05,图2)。
3 讨 论
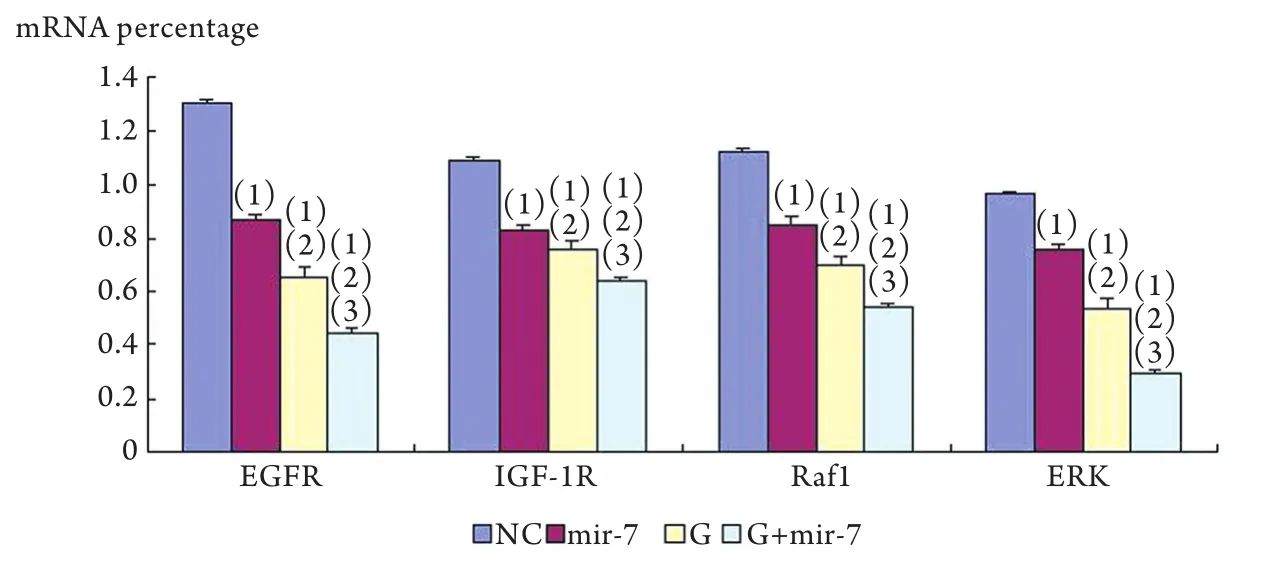
图1 各组中EGFR、IGF-1R、Raf1、ERK mRNA的表达Fig. 1 mRNA expression of EGFR, IGF-1R, Raf1 and ERK in different groups
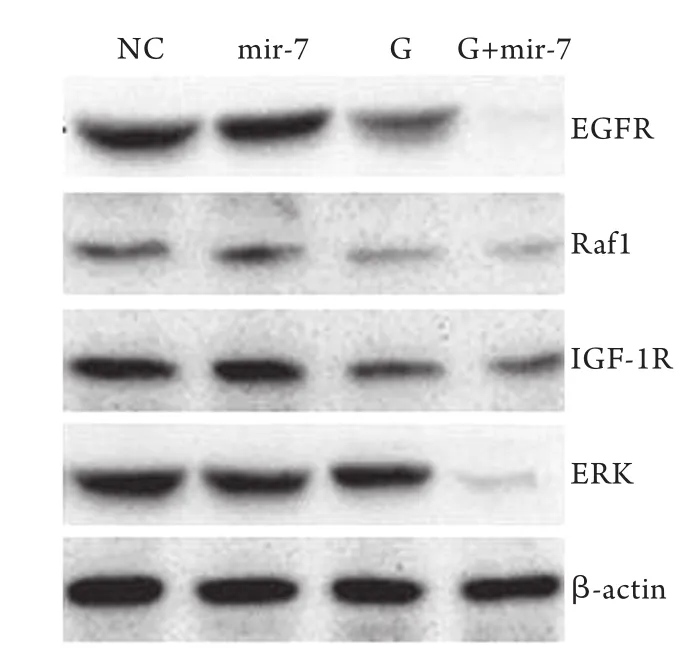
图2 不同处理组中EGFR、IGF-1R、Raf1、ERK蛋白的表达Fig. 2 Protein expression of EGFR, IGF-1R, Raf1 and ERK in different groups
肺癌为临床常见的恶性肿瘤之一,其中NSCLC约占80%[4-5]。手术切除是治疗NSCLC的有效方法,但通常只有30%左右的患者有手术机会。化学治疗是NSCLC的常规治疗手段,但有部分患者对化疗不敏感或存在耐药,因此靶向治疗药物成为临床上一种新的选择。EGFR与肿瘤生长密切相关,在多种恶性肿瘤中呈高表达,EGFR-TKI为针对EGFR较有代表性的靶向药物,临床常用的EGFRTKI包括吉非替尼和厄洛替尼,其作用机制是通过与ATP或底物竞争性结合胞外的配体结合位点,阻断EGFR分子内酪氨酸的自身磷酸化及酪氨酸激酶活化,抑制EGFR激活,阻止下游信号转导,从而抑制细胞周期进程、加速细胞凋亡、抑制血管生成、抑制浸润和转移[6]。但在临床中,有些患者对EGFR-TKI的治疗并不敏感,或对该类药物最终产生耐药。所以,研究EGFR-TKI类耐药机制并寻找增强肿瘤细胞对此类药物敏感性的方法具有重要的临床意义。
小RNA的异常表达与肿瘤发生有关[7]。mir-7是一种古老的小RNA[8],Li等[9]研究发现,mir-7在果蝇体内参与了几条反馈环,这几条反馈环的作用是缓冲外界环境变化对生物体的冲击,帮助维持生物体内的稳定性。有研究表明,在神经系统中,mir-7在大脑、晶状体、垂体及丘脑的表达都在正常水平[10-12],但在垂体腺瘤及多种中枢神经系统肿瘤中的表达明显下降[13-14]。Webster等[15]的研究表明,mir-7与EGFR通路关系密切,可抑制EGFR信号通路上的多个靶点,如直接调控EGFR及Raf1 mRNA的生成,以及间接调节分裂原活化抑制剂(MEK)、ERK、蛋白激酶B(AKt)等的表达。同时,Rusch等[16]研究发现,IGF1R通路激活是导致EGFR-TKI类耐药的重要机制。Jiang等[17]的研究显示,在舌癌中,mir-7可以抑制IGF-1R下游信号通路。Zhong等[18]也发现let-7a、has-miR-126、has-miR-145等小RNA可以增强吉非替尼对NSCLC细胞的毒性。为此,我们设想mir-7可用于增强NSCLC细胞对EGFR-TKI类药物的敏感性。一方面mir-7可直接抑制EGFR及其下游通路,这与EGFR-TKI类本身的作用目的是相同的,同时,mir-7可抑制IGF-1R等信号通路引起的EGFR-TKI类药物耐药,从另一方面加强药物的敏感性。
本研究结果显示,转染mir-7可增强A549细胞对吉非替尼的敏感性。从PCR及Western blotting检测结果可以看出,转染mir-7后EGFR-Raf1-ERK信号通路上的靶点表达均明显下降,表明mir-7无论是在mRNA水平还是蛋白水平都可以协助吉非替尼进一步抑制EGFR信号通路。同时ERK也是IGF-1R的下游信号,在吉非替尼与mir-7转染共同作用下ERK及IGF-1R表达下降也表明IGF-1R信号通路受到了明显抑制,从而避免了因旁路IGF-1R信号通路激活导致的NSCLC对吉非替尼的耐药。后续将采用耐吉非替尼的NSCLC细胞进行研究,观察上调mir-7表达能否逆转其耐药。
总之,本研究发现mir-7可增强A549细胞对吉非替尼的敏感性,其机制可能与mir-7抑制EGFR及IGF-1R通路有关,为NSCLC的靶向治疗提供了新的思路。
[1]Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297.
[2]Mattick JS, Makunin IV. Small regulatory RNAs in mammals[J]. Hum Mol Genet, 2005, 14(1): 121-132.
[3]Humphreys DT, Westman BJ, Martin DI, et al. MicroRNAs control translation initiation by inhibiting eukaryotic initiation factor 4E/cap and poly(A) tail function[J]. Proc Natl Acad Sci USA, 2005, 102(47): 16961-16966.
[4]Jemal A, Tiwari RC, Murray T, et al. Cancer statistics[J]. CA Cancer J Clin, 2004, 54(1): 8-29.
[5]Rusch V, Baselga J, Cordon-Cardo C, et al. Differential expression of the epidermal growth factor receptor and its ligands in primary non-small cell lung cancers and adjacent benign lung[J]. Cancer Res, 1993, 53(10 Suppl): 2379-2385.
[6]Jiang L, Liu X, Chen Z, et al. MicroRNA-7 targets IGF1R (insulin-like growth factor 1 receptor) in tongue squamous cell carcinoma cells[J]. Biochem J, 2010, 432(1): 199-205.
[7]Kumar MS, Lu J, Mercer KL, et al. Impaired microRNA processing enhances cellular transformation and tumorigenesis[J]. Nat Genet, 2007, 39(39): 673-677.
[8]Prochnik SE, Rokhsar DS, Aboobaker AA. Evidence for a microRNA expansion in the bilaterian ancestor[J]. Dev Genes Evol, 2007, 217(1): 73-77.
[9]Li X, Cassidy JJ, Reinke CA, et al. A microRNA imparts robustness against environmental fluctuation during development[J]. Cell, 2009, 137(2): 273-282.
[10]Sempere LF, Freemantle S, Pitha-Rowe I, et al. Expression profiling of mammalian microRNAs uncovers a subset of brainexpressed microRNAs with possible roles in murine and human neuronal differentiation[J]. Genome Biol, 2004, 5(3): R13.
[11]Farh KK, Grimson A, Jan C, et al. The widespread impact of mammalian MicroRNAs on mRNA repression and evolution[J]. Science, 2005, 310(5755): 1817-1821.
[12]Landgraf P, Rusu M, Sheridan R, et al. A mammalian microRNA expression atlas based on small RNA library sequencing[J]. Cell, 2007, 129(7): 1401-1414.
[13]Bottoni A, Zatelli MC, Ferracin M, et al. Identification of differentially expressed microRNAs by microarray: a possible role for microRNA genes in pituitary adenomas[J]. J Cell Physiol, 2007, 210(2): 370-377.
[14]Gaur A, Jewell DA, Liang Y, et al. Characterization of microRNA expression levels and their biological correlates in human cancer cell lines[J]. Cancer Res, 2007, 67(6): 2456-2468.
[15]Webster RJ, Giles KM, Price KJ, et al. Regulation of epidermal growth factor receptor signaling in human cancer cells by microRNA-7[J]. J Biol Chem, 2009, 284(9): 5731-5741.
[16]Rusch V, Baselga J, Cordon-Cardo C, et al. Differential expression of the epidermal growth factor receptor and its ligands in primary non-small cell lung cancers and adjacent benign lung[J]. Cancer Res, 1993, 53(10 Suppl): 2379-2385.
[17]Jiang L, Liu X, Chen Z, et al. MicroRNA-7 targets IGF1R (insulin-like growth factor 1 receptor) in tongue squamous cell carcinoma cells[J]. Biochem J, 2010, 432(1): 199-205.
[18]Zhong M, Ma X, Sun C, et al. MicroRNAs reduce tumor growth and contribute to enhance cytotoxicity induced by gefitinib in non-small cell lung cancer[J]. Chem Biol Interact, 2010, 184 (3): 431-438.
Change in sensitivity of A549 cells to gefitinib after up-regulation of mir-7 expression and its mechanism
ZHAO Jun-gang, REN Kai-ming, TANG Jun, ZHANG Lei
Department of Thoracic Surgery, Shengjing Hospital, China Medical University, Shenyang 110004, China
This work was supported by the Doctoral Research Foundation of Liaoning Province (20091108)
ObjectiveTo observe the change in sensitivity of human lung adenocarcinoma A549 cells to gefitinib after upregulation of mir-7 expression and its underlying mechanism.MethodsThe logarithmic growth phase A549 cells were harvested and randomly divided into 4 groups: normal control group (NC group), transfection group (mir-7 group), gefitinib group (G group), and G+mir-7 group (A549 cells were treated with gefitinib after mir-7 transfection). The MTT assay was used to determine the 50% inhibitory concentration (IC50) of gefitinib for A549 cells. Real-time PCR and Western blot were used to determine the mRNA and protein expression of epidermal growth factor receptor (EGFR), insulin-like growth factor 1 receptor (IGF-1R), Raf1 and extracellular signal-regulated kinase (ERK).ResultsThe IC50of gefitinib to A549 cells was significantly lower in G+mir-7 group (8.57±0.61μmol/L) than in gefitinib group (15.63±0.82μmol/L,P<0.01). The results of real-time PCR and Western blot showed that the mRNA and protein expressions of EGFR, IGF-1R, Raf1 and ERK were significantly lower in G+mir-7 group than in NC group, mir-7 group and gefitinib group (P<0.01).ConclusionThe up-regulation of mir-7 expression may enhance the sensitivity of A549 cells to gefitinib, and its mechanism may be related to the inhibitory effect of mir-7 on signal pathway of EGFR and IGF-1R.
carcinoma, non-small-cell lung; gefitinib; microRNAs
R734.2
A
0577-7402(2013)06-0481-04
2012-12-10;
2013-04-25)
(责任编辑:胡全兵)
辽宁省博士科研启动基金(20091108)
赵俊刚,副教授。主要从事胸外科的基础与临床研究
110004 沈阳 中国医科大学附属盛京医院胸外科(赵俊刚、任开明、汤隽、张磊)

