CT、MR多种成像技术在肝癌随访中的综合应用
史丽静,郭勇,解伟斌,张琨,左拥军,王守海,王楠
CT、MR多种成像技术在肝癌随访中的综合应用
史丽静,郭勇,解伟斌,张琨,左拥军,王守海,王楠
目的探讨CT、MR常规扫描与功能成像在肝癌随访中综合应用的价值。方法选择2008年2月-2012年12月在海军总医院接受手术或非手术(导管动脉内化疗栓塞、射频消融、伽玛刀)治疗的44例肝癌患者,采用CT和MR技术进行随访评估,分析常规扫描(CT平扫及动态增强扫描,MR常规T1WI、T2WI以及动态增强扫描)和功能扫描[CT灌注扫描、MR扩散加权成像(DWI)扫描和MR灌注扫描]在肝癌随访中的综合应用价值。其中16例肝癌术后患者着重对术后肿瘤复发和术区周围炎性反应进行评估,28例非手术治疗患者对肝癌病灶治疗后活性情况进行综合评估。结果44例患者经综合CT和MR常规及功能扫描后得到比较明确的诊断。16例肝癌术后患者,3例诊断为切缘旁复发,13例诊断为术后炎性反应或局灶性灌注异常。28例非手术治疗患者,13例诊断为肿瘤完全坏死,15例诊断为癌灶坏死不完全。结论 CT和MR功能扫描可作为常规平扫及动态增强的有益补充,提高肝癌随访评估的准确率。
癌,肝细胞;磁共振成像,弥散;体层摄影术,螺旋计算机
影像诊断是肝癌诊断和治疗结果评估的重要手段,但患者对生存质量的高要求使常规CT、MR的平扫及增强扫描越来越难以满足精细的临床诊断需求。CT灌注、MR灌注和MR扩散加权成像(diffusion weighted imaging,DWI)等功能成像方法将功能改变与解剖图像结合,可提供常规扫描所不能提供的信息,提高了对病变的辨识能力。本文分析了44例肝癌患者治疗后的综合影像学诊断结果,探讨CT和MR平扫、动态增强扫描、灌注扫描及MRI DWI在肝癌随访中的综合应用价值。
1 资料与方法
1.1研究对象 选择2008年2月-2012年12月在海军总医院确诊为肝癌的患者44例,男29例,女15例,年龄33~74岁,平均48.6岁。其中16例为肝癌术后患者,对术后有无肿瘤复发以及术区周围炎性反应进行评估。28例为非手术治疗患者,接受导管动脉内化疗栓塞(transcatheter hepatic arterial chemoembolization,TACE)、射频消融(radiofrequency ablation,RFA)、伽玛刀等非手术方法治疗,对肝癌病灶治疗后活性情况进行综合评估。
1.2仪器 多层螺旋CT机(Somatom Plus 4 Volume Zoom,Siemens),螺旋CT机(iCT 256型,Philips)。MR扫描仪(1.5T Avanto,Siemens;HD×3.0T,GE)。
1.3常规和功能扫描及相关参数 44例患者均接受常规CT和(或)MR平扫及动态增强扫描、MR DWI成像,另外,行CT灌注扫描者37例,行MR灌注扫描者31例。患者准备:检查前禁食4~8h,受检者仰卧位。腹带加压,行呼吸训练。
常规扫描包括CT平扫及动态增强扫描,MR常规T1WI、T2WI以及动态增强扫描。CT平扫及动态增强扫描:按照常规方式进行。MR常规T1WI、T2WI以及动态增强扫描按常规方式进行,使用腹部相控阵表面线圈。
功能扫描包括CT灌注扫描、MR DWI扫描和MR灌注扫描。①CT灌注扫描:在常规肝脏CT扫描后选择灌注层面,应用高压注射器经患者肘前静脉注入对比剂50~70ml,注射速度4~5ml/s,并以同等速度追加生理盐水30ml,注射同时启动动态扫描,扫描过程中受检者保持平静呼吸。灌注扫描主要参数:Siemens 螺旋CT机:120kV,30mAs,准直2.5mm,层厚5mm,每次扫2~4层,每次扫描时间0.5s,间隔2s扫描一次。Philips螺旋CT机:120kV,100mAs,准直80mm,层厚5mm,覆盖全肝,每次扫描时间1.71s,间隔7s扫描一次;螺距0.76。②MR DWI扫描:扫描序列使用平面回波成像(echo planar imaging,EPI),采用频率选择脂肪抑制技术。TR/TE=4000~6800/70~90ms,层厚6mm,层距1~2mm,扫描野(FOV) 380×380mm,矩阵192×192,横断面扫描,扫描范围同常规T1、T2。扫描时嘱受检者平静呼吸。在X、Y、Z轴3个方向上选用3个不同的扩散系数(b为0、500、1000s/mm2)。扫描时间4min54s。采集6次,信灶比1.0。③MR灌注扫描:横断面T1加权,灌注层面尽量选择能显示病灶中心的层面。高压注射器经肘静脉注射Gd-DTPA,速率3~4ml/s,注射开始的同时启动扫描。参数TR/TE=40/2.49ms,层厚6mm,层距1~2mm,每次扫2层。FOV 400×310mm,矩阵192×256,翻转角70°,每次扫描时间3s,重复不间断扫描40次,总计2min。扫描过程中受检者采用胸式呼吸为主的平静呼吸。
CT、MR灌注扫描,与常规平扫及动态增强间隔至少4s以上,以避免对比剂的重叠干扰。
1.4指标测量、计算和判断标准 MR DWI指标:在后处理工作站观察DWI图像,对比癌灶内部以及与周围肝组织的信号差异,并在图像中测量癌灶或术区周围感兴趣区的表观弥散系数(apparent diffusion coefficient,ADC)值,用以判断肝癌术后局部的残余或复发,以及非手术方法治疗后癌灶的坏死情况。判断标准:手术后患者,常规扫描显示术后切缘旁异常信号区的ADC值<1.0×10-3mm2/s,诊断为癌灶残余或切缘旁复发;若ADC值>1.0×10-3mm2/s但低于周围正常肝实质,则判断术后无肿瘤残余或复发,诊断该区为术后炎性增生或灌注异常。非手术方法治疗后患者,若病灶信号均匀,ADC值高于周围肝实质或绝对值>1.5×10-3mm2/s,诊断为病灶完全坏死;若有常规扫描信号可疑区域,该处ADC值<1.0×10-3mm2/s,则判断病灶仍有活性部分,ADC值为(1.0~1.5)×10-3mm2/s,需结合临床以及灌注参数综合诊断。
CT灌注指标:在后处理工作站对灌注图像进行分析,在相应后处理程序中,绘制主动脉、脾脏和肝脏病变处ROI的时间-密度曲线(time-density curve,TDC),计算各ROI的峰值时间、最大CT值差值和TDC的最大斜率。由于肝脏有动脉和门脉双重血供,假定血流经动脉流过肝脏和脾脏的时间相同,以脾脏的达峰时间作为肝脏动脉及门脉血流灌注的分界点,分别计算脾脏峰值前后肝脏或病灶的曲线最大斜率,以前后两个斜率的比值代表该部位动门脉的灌注比率,记为SSr(ct)=SS前/SS后,以此作为指标对肝癌坏死及有无术后复发、残余活性部分进行判断。判断标准:肝癌手术后患者,术后切缘旁的SSr(ct)值>1.5,诊断为癌灶残余或切缘旁复发;若其SSr(ct)<1.5但高于周围正常肝实质的测值,则需进一步结合DWI及MRI灌注排除肿瘤残余、复发后诊断为术后炎性增生及灌注异常。非手术方法治疗后患者,若病灶区灌注曲线近于平直无上升支,则判断为病变已完全坏死;若有上升支,则测定病变内的SSr(ct)值,>1.0则判断病灶仍有活性部分。
MR灌注指标:与CT灌注的基本计算方法相仿,在后处理工作站对灌注图像进行分析,绘制各感兴趣区的时间-信号曲线(time-intensity curve,TIC),对于肝脏和病灶,仍以脾脏的峰值时间为界,计算脾脏峰值前后病灶的曲线最大斜率比值,记为SSr(mr)=SS前/SS后,以此代表该部位动门脉的灌注比率进行评估。判断标准:肝癌手术后患者,术后切缘旁的SSr(mr)值>1.5,诊断为癌灶残余或切缘旁复发;若其SSr(mr)<1.5但高于周围肝实质的测值,比较并需进一步结合DWI及CT灌注排除肿瘤残余、复发后判断为术后炎性增生及灌注异常。非手术治疗后患者,若病灶区灌注曲线近于平直无上升支,则判断为病变已完全坏死;若有上升支,则测定病变内的SSr(mr)值,>1.0则判断病灶仍有活性部分。
2 结 果
2.1一般情况 16例肝癌术后患者中,综合常规扫描和功能扫描确认术后切缘旁复发3例,其中2例经再次手术证实,1例再行伽马刀治疗后证实;另13例综合常规扫描和功能扫描判断无切缘旁复发或残余,诊断为术后炎性反应、增生或局灶性灌注异常,1例经再次手术证实,2例经肝穿刺活检证实,其余10例经6个月以上临床随访、AFP值测定以及影像复查(2次以上无变化)证实。非手术治疗的28例患者,其中13例经综合常规扫描和功能扫描诊断为治疗后病灶完全坏死,均经6个月以上临床随访、AFP值测定及影像复查(2次以上无变化)证实;15例经综合影像学诊断为治疗后病灶不完全坏死,3例经手术证实,4例经肝穿刺活检证实,其余8例经再次非手术方法治疗后临床症状好转、AFP水平明显下降以及影像复查随访证实。
2.2术后肝癌患者常规及功能成像影像学表现
2.2.1常规扫描 16例肝癌术后患者:3例常规平扫及增强图像基本诊断明确,结合DWI成像及灌注成像之后诊断证据更加充分;另外13例常规平扫及增强扫描术区及周围发现异常密度/信号以及异常增强区,但密度或信号改变及增强方式不典型,表现为术区周边类似团片样或结节样异常密度/信号,增强扫描动脉期即有明显增强,但门脉期以及延迟期持续增强,或是动脉期中等度增强,而门脉期及延迟后造影剂有所淡出,信号略低于周围正常肝实质,但根据上述征象区分残存肿瘤与术后炎性反应和异常灌注有困难。还有部分病例左叶病变切除后切缘旁有可疑信号和增强,但强化方式不典型,并且位于左叶切缘旁,受胃肠道伪影影响,无法明确诊断。最后结合DWI成像及灌注成像,2例诊断为手术切缘旁新发活性癌灶,11例综合影像诊断为术区切缘周围炎性反应或肝脏局限性灌注异常。
2.2.2功能扫描 对于切缘旁复发病例进行DWI成像,在常规扫描的异常信号区中切缘复发呈较明显高信号,随b值增加,虽有略微的信号减低,但其下降程度明显低于周围肝组织,测量ADC值显示该区ADC值明显低于正常肝实质,说明该区分子扩散明显受限;CT和(或)MR灌注扫描指标提示该区动脉供血增加,动门脉灌注比率倒置,可诊断为肝癌切缘旁复发。其他11例在常规扫描中呈现的可疑异常信号区在DWI图像上呈等信号或混杂较高信号,且随b值增加,呈高信号区的部分信号明显下降,下降程度明显大于典型的肝癌病灶,测量ADC值显示该区ADC值虽略低于正常肝实质,但仍高于典型肝癌,提示该区并非肝癌残余或复发,分析灌注指标可见该区未达典型肝癌的动门脉灌注比率倒置,仅有轻度或中度的动脉灌注增加,因而最终诊断为术后炎性增生或肝脏局限性灌注异常(图1),后期患者随访6个月以上,一般状况和生化指标无明显异常,且影像表现基本无变化,所以否定了肝癌复发的可能。
2.3非手术治疗肝癌患者常规及功能成像影像学表现
2.3.1常规扫描 28例原发性肝癌患者采用TACE、RFA、伽玛刀等方法治疗,其中7例常规平扫及增强对病灶治疗后肿瘤坏死情况的判断基本明确,结合DWI及灌注信息后进一步确定诊断,功能成像与常规图像吻合较好。另外19例患者,经CT和(或)MR常规平扫及增强扫描均未能明确判断其坏死及活性残余情况,原因可能与增强扫描的采集时间欠精准,或可疑活性区靠近边缘有关。这些病例中,部分患者的CT和(或)MR常规平扫及增强扫描病灶内密度/信号不均匀,增强亦不均匀,未呈现典型肝癌的“快进快出”征象,AFP明显高于正常,所以虽可疑病变仍有部分活性区但诊断不明确;还有部分碘油栓塞患者,由于高密度碘油沉积,导致CT增强扫描病变内强化被掩盖,从而无法做出判断。另外2例患者的常规平扫及增强扫描病灶内无明显异常强化,未见可疑残存的活性区,但临床及AFP检测仍然高度怀疑病变未完全坏死。该21例患者均加扫DWI成像,其中16例行MR灌注成像,19例行CT灌注成像。经ADC值以及灌注值的评估,病灶坏死区和残留活性区的区分更加明确。
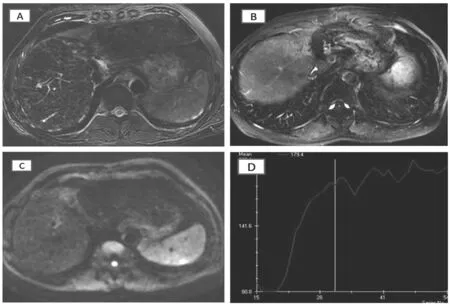
图1 肝左叶肝癌患者手术后3个月复查指标Fig. 1 MRI follow-up of a patient with hepatic carcinoma (HCC) in the left lobe, 3 months after surgery
2.3.2功能扫描 19例患者在常规扫描(平扫及增强)中均显示病灶内密度/信号不均,其中3例表现为整个病灶呈相对高信号,随b值增加,病变与周围肝实质的对比较常规T2及增强扫描更为明显;测量显示该区ADC值明显低于肝实质,进一步进行CT和(或)MR灌注测量提示病变呈明显动脉供血,动门脉灌注比例倒置,提示病灶仍有活性;5例在DWI图像上可见病变分为高、低信号两部分,随b值升高两部分的对比更加鲜明,信号差别逐渐清晰,坏死区信号明显下降,最终接近或低于肝实质信号,而活性区则仍呈相对高信号;经测量,坏死区ADC值明显高于肝实质,而活性区ADC值低于肝实质。灌注成像显示,病灶的坏死区无明显造影剂进入,灌注曲线呈低平线或轻微锯齿状,而活性区的灌注曲线则在动脉期有明显的上升支,计算显示该区动门脉灌注比率倒置,证实该处为残存肿瘤组织。2例病变内存在高密度碘油沉积,影响了CT增强扫描血供情况的判断,但CT灌注扫描可以克服常规CT图像上的缺陷,灌注值反映出真实的病变内血供情况,可更客观地反映病变仍有明显活性成分(图2)。9例DWI成像病变内信号不均,也分为两部分,DWI随b值升高,可疑活性的区域较坏死区信号略高,但两部分分界仍然不够清晰,在ADC图上也显示欠清,测量ADC值两部分差别不大且都略低于周围正常肝实质,初步判断病变基本坏死,但仍无法确诊,结合灌注计算,病变内的两部分均未见明显的动脉高灌注,两部分差别不明显,虽动脉灌注比例略高,但仍低于典型肝癌,远远未达肝癌诊断标准(动门脉比例倒置),故判断病变内没有明显的活性成分,微弱的增强可能源于病变内的炎性增生。另2例常规扫描病灶内未见动脉期明显强化,或仅轻度增强,所以报告未见可疑残存的活性区,但临床及AFP检测仍然高度怀疑病变未完全坏死,患者DWI显示病变呈较明显的高信号,ADC值也明显低于正常肝脏,灌注信息提示病灶处有比较明显的动脉血供,动门脉灌注比例接近倒置,所以确诊病变并未完全坏死。

图2 右叶肝癌患者TACE治疗后CT和CT灌注图像Fig.2 CT and CT perfusion images of a patient with hepatic carcinoma in the right lobe after TACE therapy
3 讨 论
肝癌的治疗方法越来越多,手术或TACE、RFA、伽马刀等非手术方法应用非常广泛[1-2],治疗后的随访及评估也越来越重要。对于肝癌的治疗,临床医师和患者最关注的是手术后肿瘤复发和非手术治疗后病灶活性的判断,除了较具代表性的一些化验指标以外,影像检查结果是临床医师最主要的参考依据。但由于疗效评估的要求越来越精细,单纯的影像学常规扫描已不能满足这些高要求。CT灌注、MR灌注和MR扩散加权成像等功能成像方法将功能改变和解剖图像相结合,提供许多常规扫描所不能提供的信息,对明确人体生理活动和病理变化都具有重要意义,提高了对病变的认识能力[3-5]。随着CT、MR设备的完善,以及不断优化的重建和后处理技术,功能成像得到了越来越多的关注和研究[6-11]。
目前功能成像已从科研转向临床应用,关于CT及MR肝脏功能成像的文献报道也越来越多,但临床方面的报道多为对有病理结果的病例进行回顾性分析、组间对比,以证实并总结功能成像技术对肝癌病理改变的反映能力[12-17]。以CT、MR灌注测量及MR弥散成像的结果作为诊断依据,辅助常规扫描对临床病例进行综合诊断的报道尚少。
常规扫描是依据平扫时局部的密度或信号改变,再结合增强后的强化方式和强化程度来判断,尤其在增强后动脉期的表现对诊断更是举足轻重。但是非手术治疗后的坏死组织、栓塞治疗后碘油沉积的影响、手术后局部以及周围肝脏的炎性反应、纤维增生或瘢痕组织、术区或病灶周围肝组织的异常灌注等,甚至增强扫描注射对比剂后各期扫描时相掌握不准确都会造成影像的假象或重叠,影响对局部病灶真实情况的判断,且阅片者主观印象和经验不同,即使是对相同的图像表现,也可能给出不一致的判断,而功能成像的结果相对更为客观,操作者之间可重复性强,因而结合了功能成像后,影像检查的诊断准确率和对临床的指导价值明显提高。
几种方法中,DWI成像方法简单易行,患者容易配合,一次成像可同时观察病灶和整个肝脏及周围脏器的情况,除了依靠量化的ADC值来判断病灶性质以外,对经验丰富的医师而言,有时通过病灶在不同b值所得图像的信号表现及信号改变的规律和幅度,不用ADC值测量仍能够较为准确地推测病灶性质。因此相对于需要注射对比剂、容易受时间分辨率限制,并仅可能针对病灶所在的部分层面进行评价的灌注扫描而言,DWI成像更容易被接受。建议在常规扫描有疑问或无法明确诊断时先进行DWI成像。但有时也会有复杂情况,比如肝癌治疗后病灶大部分坏死,边缘活性区范围小,在拟合的ADC图上难以清晰显示,或者当病变位置接近肝脏表面,受肠道气体以及静电伪影等影响时,ADC值的测量受到干扰,不能反映真实情况,此时灌注评价会更为有利,本组中部分病例也证实了这一点。
CT、MR灌注对病灶的评价结果基本一致,实际应用中可根据情况选择使用。根据笔者经验,CT操作更为简便,受呼吸影响更小,但在某些情况下,比如在接受碘油栓塞治疗后,碘油沉积会影响对病灶密度和强化方式的判断,也影响到灌注测量,此时MR灌注更有利用价值,本组中即有这种情况。而且,CT灌注使用的对比剂为碘剂且用量大于MR灌注,MR灌注没有辐射,相对更为安全;但MR扫描速度和时间分辨率都不如CT。目前文献报道CT、MR灌注的扫描方法、后处理以及灌注指标多不统一[18-20],CT和MR灌注之间也没有共同的评价指标。肝脏血供特殊,血流评估指标更是不一而足;大部分肝脏恶性病变,尤其是肝癌,主要由动脉供血,动门脉的灌注比例明显增高且多有比例倒置,与正常肝组织和大多数良性病变血供特点不同,很多相关研究和报道均有相似结论[21-22],在CT灌注中有一项指标,即用肝脏或病变在脾脏峰值前后TDC的最大斜率的比值代表肝脏或病变的动门脉灌注比例,根据灌注原理,此项指标应该也可用于MR灌注。故为了简化计算和便于比较,本组只采用了这一项指标对病灶的血供情况进行判断。
总之,针对不同情况和诊断目的选择合适的影像检查手段,再辅以恰当的功能成像,可以明显提高诊断准确性及病灶检出率,但还需同时进行更多的大样本积累来统一功能成像的信息采集、评估指标以及诊断标准,才能真正在临床上推广功能成像的应用,为临床的诊治提供更真实可信的依据。
【参考文献】
[1]Wang CP, Lu YY, Wang XZ, et al. Percutaneous argon-helium cryoablation for primary hepatocellular carcinoma:report of 300 cases[J]. Med J Chin PLA, 2008, 33(12): 1413-1417. [王春平, 陆荫英, 王新真, 等. 经皮氩氦刀冷冻消融治疗原发性肝癌的疗效观察(附300例报告)[J]. 解放军医学杂志, 2008, 33(12): 1413-1417.]
[2]Chen Y, Wang CP, Lu YY, et al. Risk factors for recurrence of small hepatocellular carcinoma after argon-helium cryoablation[J]. Med J Chin PLA, 2010, 35(2): 137-143.[陈艳,王春平, 陆荫英, 等. 小肝癌氩氦刀治疗后复发因素预后分析[J]. 解放军医学杂志, 2010, 35(2): 137-143.]
[3]Yang J, Yu CL, Zhang X, et al. Diagnosis of hepatic hilar cholangiocarcinoma with MR cholangiopancreatography[J]. Acta Acad Med CPAF, 2010, 19(12): 941-952. [杨剑, 于长路,张翔, 等. 磁共振胰胆管成像对肝门部胆管癌的诊断价值[J]. 武警医学院学报, 2010, 19(12): 941-952]
[4]Sun N, Liu XJ. Study of pancreatic carcinoma with multislice CT perfusion imaging[J]. Chin J Pract Intern Med, 2007, 27(11): 853-854.[孙娜, 刘秀娟. 多层螺旋CT灌注成像对胰腺癌的诊断价值[J]. 中国实用内科杂志, 2007, 27(11): 853-854.]
[5]Zhou ZG, Gao XM, Han MG, et al. Comparison between the effects of 2 contrast medias in CT enhancement scanning for HCC[J]. J Zhengzhou Univ (Med Sci), 2002, 37(3): 352-354. [周志刚, 高雪梅, 韩明光, 等. 不同对比剂在肝细胞癌患者CT增强扫描中效果比较[J]. 郑州大学学报(医学版), 2002, 37(3): 352-354.]
[6]Assumpcao L, Choti M, Pawlik TM, et al. Functional MR imaging as a new paradigm for image guidance[J]. Abdom Imaging, 2009, 34(6): 675-685.
[7]Haider MA, Farhadi FA, Milot L. Hepatic perfusion imaging: concepts and application[J]. Magn Reson Imaging Clin N Am, 2010, 18(3): 465-475.
[8]Ng CS, Chandler AG, Wei W, et al. Reproducibility of CT perfusion parameters in liver tumors and normal liver[J]. Radiology, 2011, 260(3): 762-770.
[9]Chandarana H, Taouli B. Diffusion and perfusion imaging of the liver [J]. Eur J Radiol, 2010, 76(3): 348-358.
[10]Choi SH, Chung JW, Kim HC, et al. The role of perfusion CT as a follow-up modality after transcatheter arterial chemoembolization: an experimental study in a rabbit model[J]. Invest Radiol, 2010, 45(7): 427-436.
[11]Zhang J, Wang R, Lou H, et al. Functional computed tomographic quantification of angiogenesis in rabbit VX2 soft-tissue tumor before and after interventional therapy[J]. J Comput Assist Tomogr, 2008, 32(5): 697-705.
[12]Anzidei M, Napoli A, Zaccagna F, et al. Liver metastases from colorectal cancer treated with conventional and antiangiogenetic chemotherapy: evaluation with liver computed tomography perfusion and magnetic resonance diffusion-weighted imaging[J]. J Comput Assist Tomogr, 2011, 5(6): 690-696.
[13]Yopp AC, Schwartz LH, Kemeny N, et al. Antiangiogenic therapy for primary liver cancer: correlation of changes in dynamic contrast-enhanced magnetic resonance imaging with tissue hypoxia markers and clinical response[J]. Ann Surg Oncol, 2011, 18(8): 2192-2199.
[14]Lewin M, Fartoux L, Vignaud A, et al. The diffusion-weighted imaging perfusion fraction f is a potential marker of sorafenib treatment in advanced hepatocellular carcinoma: a pilot study[J]. Eur Radiol, 2011, 21(2): 281-290.
[15]Saito K, Sugimoto K, Nishio R, et al. Perfusion study of liver lesions with superparamagnetic iron oxide: distinguishing hepatocellular carcinoma from focal nodular hyperplasia[J]. Clin Imaging, 2009, 33(6): 447-453.
[16]Sourbron S, Sommer WH, Reiser MF, et al. Combined quantification of liver perfusion and function with dynamic gadoxetic acid-enhanced MR imaging[J]. Radiology, 2012, 263(3): 874-883.
[17]Ng CS, Chandler AG, Wei W, et al. Effect of dual vascular input functions on ct perfusion parameter values and reproducibility in liver tumors and normal liver[J]. J Comput Assist Tomogr, 2012, 36(4): 388-393.
[18]Yang L, Zhang XM, Tan BX, et al. Computed tomographic perfusion imaging for the therapeutic response of chemoembolization for hepatocellular carcinoma[J]. J Comput Assist Tomogr, 2012, 36(2): 226-230.
[19]Ippolito D, Capraro C, Casiraghi A, et al. Quantitative assessment of tumor associated neovascularisation in patients with liver cirrhosis and hepatocellular carcinoma: role of dynamic-CT perfusion imaging[J]. Eur Radiol, 2012, 22(4): 803-811.
[20]Song KD, Kim YK, Lee WJ, et al. Detection and characterization of small focal hepatic lesions (≤2.5cm in diameter): a comparison of diffusion-weighted images before and after administration of gadoxetic acid disodium at 3.0T[J]. Acta Radiol, 2012, 53(5): 485-493.
[21]Lefort T, Pilleul F, Mulé S, et al. Correlation and agreement between contrast-enhanced ultrasonography and perfusion computed tomography for assessment of liver metastases from endocrine tumors: normalization enhances correlation[J]. Ultrasound Med Biol, 2012, 38(6): 953-961.
[22]Ng CS, Kodama Y, Mullani NA, et al. Tumor blood flow measured by perfusion computed tomography and 15O-labeled water positron emission tomography: a comparison study[J]. J Comput Assist Tomogr, 2009, 33(3): 460-465.
The combined use of CT and MR imaging techniques in the follow-up process of hepatic carcinoma
SHI Li-jing, GUO Yong, XIE Wei-bin, ZHANG Kun, ZUO Yong-jun, WANG Shou-hai, WANG Nan
MRI Division, Department of Radiology, Navy General Hospital, Beijing 100048, China
ObjectiveTo investigate the value of combined use of CT and MRI routine scan and functional imaging techniques in the follow-up process of hepatocellular carcinoma.Methods44 cases of liver cancer patients
surgical treatment or non-surgical treatment (transcatheter hepatic arterial chemoembolization, radiofrequency ablation, and gamma-knife radiotherapy) were enrolled. All patients received CT and MR scanning for follow-up assessment after treatment. The results of conventional scanning (including CT plain scan and dynamic enhancement, MRI T1 weighted imaging, T2 weighted imaging and MR dynamic enhancement) and functional scanning (CT perfusion, MR perfusion and MRI diffusion weighted imaging) in the follow-up study of liver cancer were analysed. Out of 44 patients, the examination in 16 postoperative patients with hepatocellular carcinoma focused around the area of tumor recurrence and inflammatory reaction after surgery. In 28 patients with non-surgical treatment, the examinations focused on comprehensive assessment of activity of the lesion.ResultsDefinite diagnosis was obtained in all of 44 patients undergoing the CT and MR conventional and functional imaging scanning. Among 16 postoperative patients with hepatocellular carcinoma, tumor recurrence at incision margin was found in 3 cases, and postoperative inflammatory reaction or abnormal focal hepatic perfusion was diagnosed in other 13 patients. As for the 28 patients with non-surgical treatment, complete tumor necrosis was found in 13, and incomplete tumor necrosis was diagnosed in 15.ConclusionsCT and MR functional scan, such as CT perfusion scanning, MR DWI scan and MR perfusion scanning can be used as a beneficial supplement for routine scan and dynamic enhanced scan in follow-up assessment of liver cancer to improve diagnostic accuracy.
carcinoma, hepatocellular; diffusion magnetic resonance imaging; tomography, spiral computed
R735.7
A
0577-7402(2013)06-0506-06
2013-02-15;
2013-04-22)
(责任编辑:李恩江)
史丽静,医学博士,副主任医师。主要从事腹部及盆腔脏器影像诊断和功能成像方面的研究
100043 北京 海军总医院磁共振室(史丽静、郭勇、解伟斌、张琨、左拥军、王守海、王楠)

