不同抗原全血ELISA检测技术对活动性肺结核的辅助诊断价值研究
杨新婷 梁清涛 杨扬 李琦 陈效友
·论 著 ·
不同抗原全血ELISA检测技术对活动性肺结核的辅助诊断价值研究
杨新婷 梁清涛 杨扬 李琦 陈效友
目的 探讨克隆表达的抗原PPD、早期分泌抗原靶6(ESAT-6)/培养滤液蛋白10(CFP-10)融合蛋白(简写为E/C)和ESAT-6的全血干扰素释放试验对活动性肺结核的辅助诊断价值。方法 选取活动性结核组96例和对照组91例共计187例,抽取清晨空腹肝素钠抗凝外周静脉血5 ml,分别给以抗原PPD、E/C和EAST-6刺激,通过ELISA的方法检测抗原刺激后血浆中IFN-γ的数值。结果 在活动性肺结核组中3种抗原刺激后IFN-γ含量的中位数分别为ESAT-6[96(41~379)pg/ml]、E/C[3180(1192~7231)pg/ml]、PPD[4348(1230~9026)pg/ml];明显高于对照组中IFN-γ含量ESAT-6[10(4~52)]、E/C[210(49~523)]、PPD[1800(70~3021)pg/ml],U值分别为1190.5、2405和1309.5,P值均<0.01;ESAT-6、E/C和PPD的全血ELISA敏感度分别为78.1%(75/96)、87.5%(84/96)和85.4%(82/96),特异度分别为76.9%(70/91)、83.5%(76/91)和65.9%(60/91)。结论 融合蛋白ESAT-6/CFP-10对活动性结核病具有一定的辅助诊断价值。
结核,肺/诊断; 重组融合蛋白质类; 酶联免疫吸附测定; γ干扰素释放试验
活动性结核病中肺结核约占85%,而菌阴肺结核约占肺结核的50%~70%[1]。痰Mtb培养一直是诊断活动性肺结核的金标准,但其阳性率较低,且费时。菌阴肺结核大多仅能得到临床诊断,确诊相对困难。因此,开发新的非细菌学诊断技术将为结核病的早期诊断提供帮助。
早期分泌抗原靶6(early secretory antigenic target 6,ESAT-6)和培养滤液蛋白10(culture filtrate protein 10,CFP-10)是Mtb复合群基因组中RD1区域编码的结核特异性抗原及T细胞最主要的靶抗原,可诱导较强的细胞免疫反应[2-3]。应用结核特异性抗原ESAT-6和CFP-10进行的全血ELISA是通过检测经过抗原刺激后细胞因子的浓度评价患者细胞免疫功能的方法,在Mtb感染和结核病的诊断方面具有敏感、快速、稳定等特点[4-5],但在结核病高流行国家的相关研究报道较少,同时这种检测技术价格昂贵,不适于在我国这种低收入国家广泛开展。为此,笔者采用克隆表达的PPD、ESAT-6/CFP-10融合蛋白(简写为E/C)和ESAT-6作为抗原进行全血ELISA检测血浆中经抗原刺激的效应T淋巴细胞分泌γ干扰素的浓度,以探讨此项检测技术在我国对结核病的辅助诊断意义。
对象和方法
一、对象
1.肺结核组:2010年6月至2011年1月期间我院住院初治结核病患者共计96例,其中男54例, 女42例,年龄16~90岁,平均年龄(42.8±10.1)岁。具体包括:(1)菌阳肺结核49例,其中男27例, 女22例,年龄17~90岁,平均年龄(46.8±10.4)岁;(2)菌阴肺结核47例,其中男27例,女20例,年龄16~76岁,平均年龄(38.3±7.8)岁。入选标准:(1)菌阳肺结核:痰抗酸杆菌涂片连续2次(+),或1次(++),或1次培养阳性;(2)菌阴肺结核:痰抗酸杆菌3次涂片阴性及1次培养阴性,具有典型的肺结核临床症状和胸部X线表现,抗结核治疗有效,临床可排除其他非结核性肺部疾患[6];有上述情况之一者入选本试验。结核组根据是否合并糖尿病分为单纯肺结核患者组76例,糖尿病合并肺结核患者组20例;所选患者均经HIV检测阴性、无妊娠和应用免疫抑制剂等病史。
2.对照组:共计91例,包括健康对照组和疾病对照组。(1)健康对照组:既往身体健康,否认结核病接触史,无临床症状,X线胸片无异常,ELISPOT阴性的本院新毕业职工、健康体检的学生和外来务工人员。共计35例,男13例,女22例,年龄18~37岁,平均年龄(30.8±6.1)岁。(2)疾病对照组:为同期住院非结核病患者,所选患者均经 HIV检测阴性、无妊娠、无应用免疫抑制剂和免疫增强剂病史。共计56例,其中男33例,女23例,年龄19~82岁,平均年龄(54.3±12.1)岁。包括肺癌43例和肺部其他疾病13例。
二、方法
1.标本采集和培养:所有入组的结核病患者及对照组均抽取清晨空腹肝素抗凝的外周静脉血5 ml,6 h内加入24孔培养板(1 ml/孔),每孔依次加入PHA、PPD、ESAT-6、E/C、生理盐水及外周静脉血标本,其中PPD、ESAT-6、E/C融合抗原由中国生物制品检定所王国治教授惠赠,根据预实验的结果,各抗原的终浓度分别为PHA(20μg/ml)、PPD(20μg/ml)、ESAT-6(40μg/ml)、E/C(20μg/ml), 于5%CO2、37℃细胞培养箱孵育过夜约16~22 h,每孔收集血浆至少300μl。
2.ELISA法检测血浆IFN-γ的浓度:采用美国BD公司生产的IFN-γ检测试剂盒,按照试剂盒要求进行操作,各样本的IFN-γ浓度通过标准曲线上的样本吸光度值来确定。两副孔浓度差小于15%,中位数数值作为IFN-γ浓度值,>15%者需重新测定。
3.结果判定标准:各抗原的诊断界值根据ROC曲线设定,ESAT-6的界定值为31 pg/ml,E/C界定值为1458 pg/ml,PPD界定值为2068 pg/ml,阳性定义为大于等于界定值且3倍于阴性对照孔且阴性对照孔<100 pg/ml;阴性定义为小于界定值且阳性对照>150 pg/ml且阴性对照孔<100 pg/ml;无法确定值:阳性对照孔<150 pg/ml且抗原孔为阴性时或阴性对照孔>100 pg/ml。由于机体对阳性刺激不反应,或由于污染使得阴性对照孔出现阳性反应,致无法判定结果为阳性还是阴性,需要重新检测。
三、统计学处理
所有数据均采用SPSS 13.0进行统计学处理,正态分布的数据用±s表示,非正态分布的数据用中位数(四分位间距)表示;各组样本率的比较和相关性应用Pearsonχ2检验;各组样本间抗原刺激后分泌的IFN-γ浓度的比较采用非参数检验,两组间的比较应用Mann-Whitney U检验,P<0.05为差异有统计学意义。
结 果
1.抗原浓度的确定:分别选取不同浓度(5、10、20、40μg/ml)的3种抗原(ESAT-6、E/C、PPD)进行刺激并测定分泌的IFN-γ,根据预实验的结果,各抗原的终浓度分别确定为PHA(20μg/ml)、PPD (20μg/ml)、ESAT-6(40μg/ml)、E/C(20μg/ml)。
2.抗原ESAT-6、E/C、PPD刺激后全血ELISA 的IFN-γ的含量结果:结核组中IFN-γ含量的中位数(四分位间距)分别为96(41~379)、3180(1192~7231)、4348(1230~9026)pg/ml,明显高于对照组中IFN-γ含量10(4~52)、210(49~523)、1800 (70~3021)pg/ml,差异均有统计学意义,U值分别为1190.5、2405和1309.5,P值均<0.01。
3.3 种抗原的全血ELISA检测的诊断效果评价:结核组E/C和PPD的全血ELISA敏感度与ESAT-6全血ELISA的敏感度比较差异无统计学意义,ESAT-6全血ELISA的特异度与PPD全血ELISA比较差异无统计学意义,而E/C全血ELISA的特异度明显高于PPD全血ELISA(表1)。结核组中3种抗原刺激后IFN-γ含量与敏感度相比较差异均无统计学意义(表2)。结核组中不确定结果共3例,对照组中不确定结果1例。
4.单纯肺结核组和合并糖尿病组3种抗原刺激后全血ELISA的IFN-γ的含量比较:无糖尿病结核组IFN-γ含量的中位数(四分位间距)分别为86 (32~675)、2686(1156~8792)、4188(1219~926)pg/ml;有糖尿病结核组中IFN-γ含量分别为63.5 (0~525)、2492.5(949~5561)、3953(868~6410)pg/ml,两组比较差异无统计学意义,U值分别为1194.5、1991和1565,P值均>0.05。其中单纯肺结核组中2例不确定结果,合并糖尿病组1例不确定结果。
讨 论
人体初次感染Mtb后初始T淋巴细胞会转化为记忆T淋巴细胞,当再次接触Mtb后,则迅速产生效应T淋巴细胞,并产生多种细胞因子发挥免疫学效应,IFN-γ是其中最关键的细胞因子。本研究中结核组3种抗原刺激后血浆中IFN-γ的含量明显高于对照组,表明这3种抗原可以使机体产生高水平的IFN-γ,据此可以判断机体是否感染Mtb[7]。
E/C和PPD的全血ELISA具有相对较高的敏感度,ESAT-6的敏感度略低,但是差异无统计学意义。Mtb基因RD1区域仅存在于致病性分枝杆菌中,所有卡介苗和大多数环境分枝杆菌基因组中均不含有此基因,其编码的蛋白ESAT-6和CFP-10是结核特异性蛋白。ESAT-6是T淋巴细胞最主要的靶抗原之一,含有多个特异性T细胞表位,但不足以囊括所有表位,由于重组蛋白中蛋白表位聚集的程度相对较低。因此,单独应用ESAT-6的敏感度略低,而ESAT-6/CFP-10融合蛋白含有ESAT-6 和CFP-10两种成分,含有更多的抗原表位,因此能够激发更广泛和更强烈的免疫反应[8]。PPD全血ELISA的敏感度与E/C相似,推测由于其含有Mtb、卡介苗等200多种成分,抗原性和免疫原性较强,因此导致其敏感度相对较高[9]。
菌阳肺结核和菌阴肺结核两组间全血ELISA血浆中γ干扰素含量和敏感度差异无统计学意义,即无论荷菌量的多少,3种抗原刺激后均可在全血进行ELISA检测到IFN-γ较高的浓度,因此可以认为即通过检测机体的细胞免疫水平来作出活动性结核病的诊断。从而提示全血ELISA检测有可能为诊断提供一定的依据[10]。
全血ELISA干扰素释放试验最早用于欧美等结核病低流行国家Mtb感染的诊断,其特异度可以高达92%~100%[11]。本研究中3种抗原全血ELISA的特异度相对略低,考虑原因可能为,我国为结核病高负担国家,即使没有明确的结核病暴露史也有可能存在潜伏感染,从而使得特异度下降,限制了其使用[12]。但是本研究显示,结核特异抗原的全血干扰素释放试验特异度远远高于PPD抗原,这是因为PPD受到卡介苗接种和环境分枝杆菌感染的影响。因此,与传统的体内结核菌素皮肤试验相比较,该试验有着广阔的临床应用前景。

表1 3种抗原全血ELISA检测的诊断评价
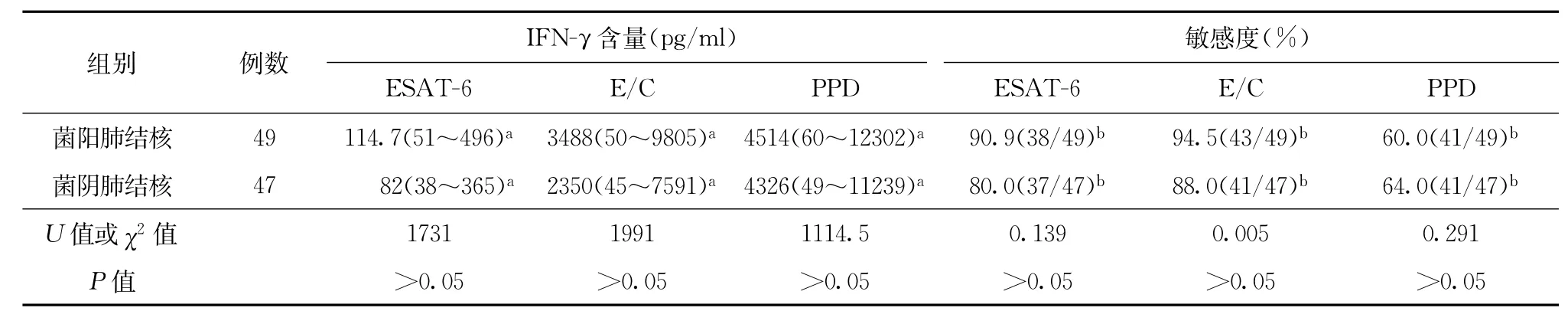
表2 菌阳与菌阴肺结核组全血ELISA血浆中IFN-γ的含量和敏感度比较
糖尿病是结核病的重要危险因素,糖尿病也会对结核病的诊断和治疗产生影响,临床工作中,糖尿病合并肺结核的诊断存在困难,因为糖尿病患者细胞免疫功能低下,传统TST试验和结核抗体检测往往呈假阴性。在本研究中无论是否患有糖尿病, 3种抗原的全血ELISA阳性率无明显差别,这就提示这种检测技术具有较高的敏感度,不受糖尿病患者免疫状态的影响,在其他的研究中也可以得到相似的结论,提示该试验对临床糖尿病合并肺结核患者的诊断有较高的价值[13]。遗憾的是本研究中肺结核合并糖尿病的患者较少,还需要进一步研究,以期获得更加客观准确的结果。E/C全血ELISA有可能作为活动性结核病的辅助诊断手段,但其特异度可能受 Mtb潜伏感染的影响而有所下降。为了准确判断其对结核病的辅助诊断价值,在以后的研究中还需要扩大样本量,并进行前瞻性研究。
[1]全国结核病流行病学抽样调查技术指导组.第四次全国流行病学抽样调查报告.中华结核和呼吸杂志,2002,25(1):3-7.
[2]Behr MA,Wilson MA,Gill WP,et al.Comparative genomics of BCG vaccines by whole-genome DNA microarray.Science, 1999,284(5419):1520-1523.
[3]Millington KA,Fortune SM,Low J,et al.Rv3615c is a highly immunodominant RD1(Region of Difference 1)-dependent secreted antigen specific for Mycobacterium tuberculosis infection.Proc Natl Acad Sci U S A,2011,108(14):5730-5735.
[4]Rangaka MX,Wilkinson KA,Glynn JR,et al.Predictive value of interferon-γrelease assays for incident active tuberculosis:a systematic review and meta-analysis.Lancet Infect Dis, 2012,12(1):45-55.
[5]Mazurek GH,Jereb J,Vernon A,et al.Updated guidelines for using Interferon Gamma Release Assays to detect Mycobacterium tuberculosis infection-United States,2010.MMWR Recomm Rep,2010,59(RR-5):1-25.
[6]中华医学会结核病学分会.肺结核诊断和治疗指南.中华结核和呼吸杂志,2001,24(2):70-74.
[7]Ferrara G,Losi M,D’Amico R,et al.Use in routine clinical practice of two commercial blood tests for diagnosis of infection with Mycobacterium tuberculosis:a prospective study.Lancet, 2006,367(9519):1328-1334.
[8]Hill PC,Jackson-Sillah D,Fox A,et al.ESAT-6/CFP-10 fusion protein and peptides for optimal diagnosis of Mycobacterium tuberculosis infection by ex vivo enzyme-linked immunospot assay in the Gambia.J Clin Microbiol,2005,43(5):2070-2074.
[9]刘菲,张宗德,杜凤娇,等.酶联免疫斑点检测斑点形成细胞在结核潜伏感染诊断中的价值.中华检验医学杂志,2009,32 (8):900-904.
[10]Diel R,Loddenkemper R,Nienhaus A.Evidence-based comparison of commercial interferon-gamma release assays for detecting active TB:a metaanalysis.Chest,2010,137(4):952-968.
[11]Rangaka MX,Wilkinson KA,Glynn JR,et al.Predictive value of interferon-γrelease assays for incident active tuberculosis:a systematic review and meta-analysis.Lancet Infect Dis, 2012,12(1):45-55.
[12]Richeldi L,Losi M,D’Amico R,et al.Performance of tests for latent tuberculosis in different groups of immunocompromised patients.Chest,2009,136(1):198-204.
[13]Walsh MC,Camerlin AJ,Miles R,et al.The sensitivity of interferon-gamma release assays is not compromised in tuberculosis patients with diabetes.Int J Tuberc Lung Dis,2011,15 (2):179-184,i-iii.
Study on the value of diagnosis for active pulmonary tuberculosis with the blood ELISA stimulated by three antigens
YANG Xin-ting,LIANG Qing-tao,YANG Yang,LI Qi,CHEN Xiao-you. The 3rd Department of Tuberculosis,Beijing Chest Hospital,Capital Medical University,Beijing Tuberculosis&Thoracic Tumor Research Institute,Beijing 101149,China C
orresponding author:CHEN Xiao-you,Email:chenxy1998@hotmail.com
Objective To evaluate the value of diagnosis for active pulmonary tuberculosis with blood interferon gamma release assay stimulated by three antigens of PPD,ESAT-6/CFP-10 fusion protein(E/C)and ESAT-6. Methods 187 participants including patients with active pulmonary tuberculosis and control were enrolled.5 ml morning fasting venous heparinazed blood were taken from all participants and stimulated by purified protein derivative(PPD),early secretory antigenic target 6(ESAT-6)and E/C.The production of IFN-γwas measured by ELISA after incubated for 16-22 hours.Results The production of IFN-γstimulated by ESAT-6,E/Cand PPDin active pulmonary tuberculosis was 96(41-379),3180(1192-7231)and 4348(1230-9026)pg/ml,respectively.It was much higher than that in control(ESAT-6:10(4-52)、E/C:210(49-523)、PPD:1800(70-3021),U=1190.5、2405和1309.5,P<0.01).The sensitivity and specificity of ESAT-6,E/C and PPD were 78.1%(75/96)vs 76.9%(70/91)、87.5%(84/96)vs 83.5%(76/91)and 85.4%(82/96)vs 65.9%(60/91),respectively.Conclusion The ESAT-6/CFP-10 fusion protein could be a very useful supplementary tool for the diagnosis of active pulmonary tuberculosis.
Tuberculosis,pulmonary/diagnosis; Recombinant fusion proteins; Enzyme-linked immunosorbent assay; Interferon-gamma release tests
2013-09-12)
(本文编辑:薛爱华)
首都医学发展科研基金(20093147)
101149首都医科大学附属北京胸科医院结核三科北京市结核病胸部肿瘤研究所
陈效友,Email:chenxy1998@hotmail.com

