重庆市结核分枝杆菌临床分离株的基因分型及相关耐药性分析
汪晓艳 赵雁林 逄宇 王玉峰 万康林 刘洁 刘英 沈静 杜昌廷 张舜
·论 著 ·
重庆市结核分枝杆菌临床分离株的基因分型及相关耐药性分析
汪晓艳 赵雁林 逄宇 王玉峰 万康林 刘洁 刘英 沈静 杜昌廷 张舜
目的 对重庆市结核分枝杆菌临床分离株进行基因分型,研究不同基因型在重庆的流行情况,并分析基因型与耐药表型的关系。方法 收集2011年1—12月重庆市结核病防治所分离的113株结核分枝杆菌临床分离株,采用比例法进行药物敏感性检测;应用间隔区寡核苷酸分型(Spoligotyping)和PCR方法对113株结核分枝杆菌临床分离株进行基因分型。结果 在113株结核分枝杆菌临床分离株中,可分为北京家族和非北京家族,分别占77株(68.1%,77/113)和36株(31.9%,36/113);北京家族菌株中现代型为48株(62.3%,48/77),古代型为29株(37.7%,29/77);非北京家族菌株中,T1型高达13株(36.1%,13/36),发现9种新基因型。北京家族菌株耐药率为24.7%(19/77),非北京家族菌株耐药率为38.9%(14/36),差异无统计学意义(χ2=2.40,P>0.05)。现代型北京家族菌株耐药率为27.1%(13/48),古代型北京家族菌株耐药率为20.7%(6/29),差异无统计学意义(χ2= 0.39,P>0.05)。结论 重庆地区结核分枝杆菌具有明显的基因多态性,其主要流行基因型为北京家族,其中北京家族中主要为现代型;北京家族菌株、非北京家族菌株均与耐药性无明显相关性。
分枝杆菌,结核; 基因型; 抗药性,细菌; 基因分型技术; 重庆市
据估计,世界人口有1/3感染过结核分枝杆菌。我国的结核病患者例数位居世界第二位,并且80%的结核病患者来自农村地区。重庆市是西部结核病疫情较重的地区,据统计,2008年登记的12万例疑似结核病患者中,农村边远地区患者占70%以上。结核病不仅影响民众的身体健康,同时也给社会带来严重的经济负担[1]。
结核分枝杆菌基因分型有助于更好地理解结核病的流行规律。通过分型研究证实结核分枝杆菌具有明显的基因多态性,并且不同的基因家族具有独特的分子特征、地区性分布和致病性[2]。因此,对结核分枝杆菌临床分离株进行分子分型鉴定不仅成为结核病分子流行病学研究的基础,而且成为目前结核病研究的热点之一。间隔区寡核苷酸分型(Spoligotyping)自20世纪90年代由Kamerbeek等设计用于结核分枝杆菌复合群基因分型以来,由于其具有操作简便、快速,结果易数字处理,可重复性高,分型效果稳定,且具有较丰富的多态性,无需菌株培养等优点,在世界范围内得到了广泛应用[3]。
笔者对2011年1—12月从重庆市结核病患者分离培养到的113株结核分枝杆菌临床分离株进行基因分型研究,以了解重庆地区结核分枝杆菌的基因型和特征;了解北京家族在重庆的流行状况;分析不同基因型,特别是北京家族与抗结核药物耐药性的关系。
材料和方法
一、标本来源及资料
113株结核分枝杆菌临床分离株来源于2011 年1—12月重庆市结核病防治所分离的113例涂片阳性痰标本,其中男83例,女30例,年龄范围14~82岁,平均年龄(61±14.57)岁,均为具有重庆户籍的结核病患者。对菌株进行培养鉴定和药物敏感性检测。参照菌株采用标准菌株H37Rv,由中国疾病预防控制中心结核病参比实验室提供。
二、药物敏感性试验
药物敏感性试验采用比例法。培养基内药物的终浓度分别为:异烟肼0.2μg/ml、利福平40μg/ml、乙胺丁醇2μg/ml、链霉素4μg/ml、氧氟沙星2μg/ml。对以上检测的任何一种药物耐药的菌株为耐药株。具体方法见文献[4]。
三、DNA提取
收集经罗氏(L-J)培养基(珠海贝索生物技术有限公司)培养、生长良好菌体,取适量,80℃孵育30 min灭活,离心收集菌体,用400μl TE缓冲液悬菌,于沸水中煮沸30 min;离心半径10 cm,12 000 r/min,离心3 min,取上清即为DNA模板,—20℃保存备用。
四、分型方法
1.Spoligotyping分型:根据Kamerbeek等[5]建立的Spoligotyping标准化方法对113株结核分枝杆菌进行分型。通过引物DRa和DRb扩增结核分枝杆菌DR区。DRa:5′-GGTTTTGGGTCTGACGAC-3′,5′端进行生物素标记;DRb:5′-CCGAGAGGGGACGGAAAC-3′。PCR反应条件:96℃3 min;96℃1 min,55℃1 min,72℃30 s,35个循环;延伸6 min。同时扩增结核分枝杆菌H37Rv和卡介苗(中国疾病预防控制中心结核病参比实验室提供)作为对照。将PCR产物与结合有43个间隔区寡核苷酸探针的Biodyne C膜(美国Pall公司)进行杂交。最后,通过链霉素亲和素-过氧化物酶联接体(streptavidin-peroxidase conjugate,华美生物工程公司)进行酶孵育及CDP-star(华美生物工程公司)检测,X线曝光获得结果。
2.NTF分型:通过引物(引物为NTF-L:5′-CCAGATATCGGGTGTGTCGAC-3′;NTF-R,5′-TGCCGTTGTCGAAATCTAAACCC-3′。对Spoligotyping鉴定出的北京家族菌株在NTF区进行扩增,PCR反应条件:94℃5 min;94℃1 min,62℃1 min,72℃1.5 min,35个循环;72℃延伸10 min。
五、结果判定
1.Spoligotyping结果分析:对Spoligotyping 43个间隔区杂交结果指纹图谱进行分析。其间隔区的存在用二进制表示,Spoligotyping结果通过国际数据库MIRU-VNTRplus(http://www.miruvntrplus.org)[6]进行比对,主要是与世界各地已知的结核分枝杆菌基因型分别比对,从而确定菌株基因家族和(或)基因型。用BioNumerics(version 5.0)软件分析:将Spoligotyping结果进行软件聚类,聚类主要根据平均连锁聚类法进行,结果判定由图可知特征相同或相近的菌株被分为同一型。
2.NTF结果分析:通过电泳结果,分析IS6110插入情况;古典型表现为302 bp,现代型表现为1500 bp。
六、统计学分析
使用SPSS 13.0统计学软件对表型和基因型数据进行统计分析,基因型检出率差异比较采用卡方检验,P<0.05为差异有统计学意义。应用logistic单因素回归分析,对不同年龄、性别、基因型对不同菌株产生耐药的情况进行统计分析。运用Pearson卡方检验,对北京家族现代型和古代型分离株产生耐药情况的差异进行分析,P<0.05为差异有统计学意义。
结 果
一、菌株不同基因型的组成
菌株呈现多个基因型,如图1所示,可分为2个基因群,即北京家族(Beijing family)[或称北京基因型(Beijing genotype)]和非北京家族(non-Beijing family),分别为77株(68.1%)和36株(31.9%),共有27种基因型,其中19株为独立类型,其余94株分为8簇,成簇率为83.2%(94/113)。非北京家族菌株表现为高度的基因多态性,可分为20个基因型,15株为独立类型。
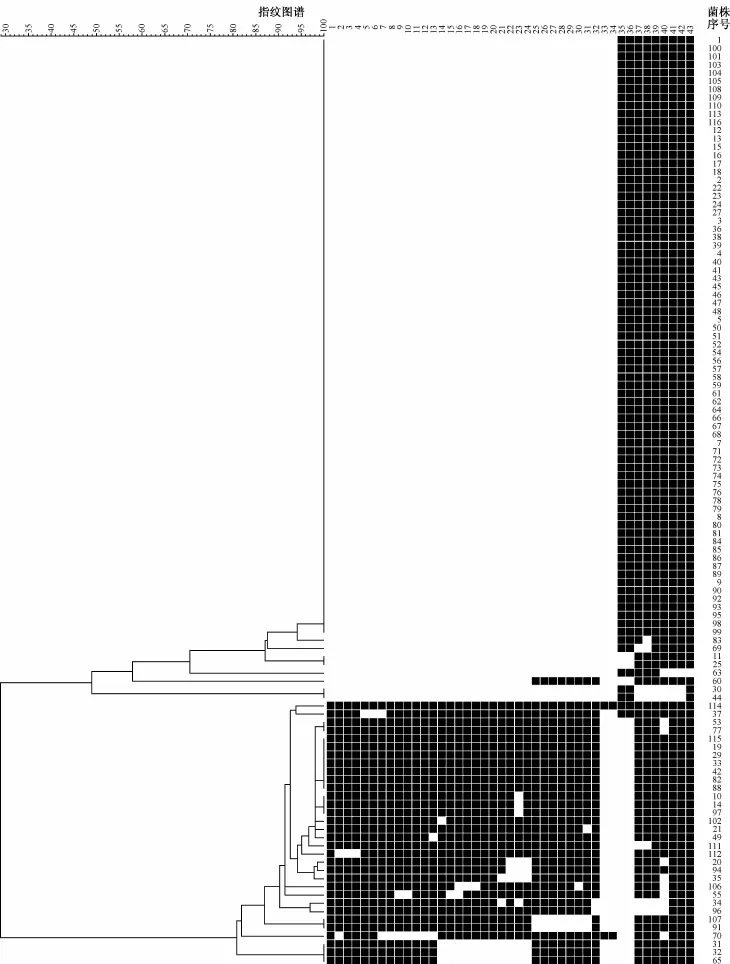
图1 结核分枝杆菌Spoligotyping基因分型聚类分析图
二、Spoligotyping不同分型的分布
如图2所示,113株结核分枝杆菌临床分离株以北京家族为主要基因型。非北京家族以 T家族为主要基因型,其中T1基因型为13株(36.1%,13/ 36);T2基因型为3株(8.3%,3/36);T3基因型为1株(2.8%,1/36);T5基因型为3株(8.3%,3/36);U基因型为2株(5.6%,2/36);H3基因型为3株(8.3%,3/36);LAM3&convergent基因型为1株(2.8%,1/36);LAM4基因型为1株(2.8%,1/36)。另外,发现9株(25.0%,9/36)结核分枝杆菌菌株表现的9种基因型在国际数据库中未检索到,为新的基因型。

图2 113株结核分枝杆菌的主要Spoligotyping家族和次要家族的流行分布
三、重庆市113株结核分枝杆菌临床分离株与耐药性相关分析
在本研究中,113株临床分离株均获得基因分型结果,并获得完整的药敏实验结果。应用logistic单因素回归分析,对不同年龄、性别、基因型对不同菌株产生耐药的情况进行分析,结果显示不同年龄、性别、基因型对菌株产生耐药的情况差异均无统计学意义(表1)。
四、北京家族结核分枝杆菌与耐药性相关分析
如表2所示,本研究将77株北京家族菌株分为现代型和古代型,分别为48株(62.3%,48/77)和29株(37.7%,29/77)。其中任意耐药现代型菌株为13株(27.1%,13/48),任意耐药古代型菌株为6株(20.7%,6/29)。经Pearson卡方分析,北京家族不同亚型的分离株发生耐药的情况差异均无统计学意义(P值均>0.05)。
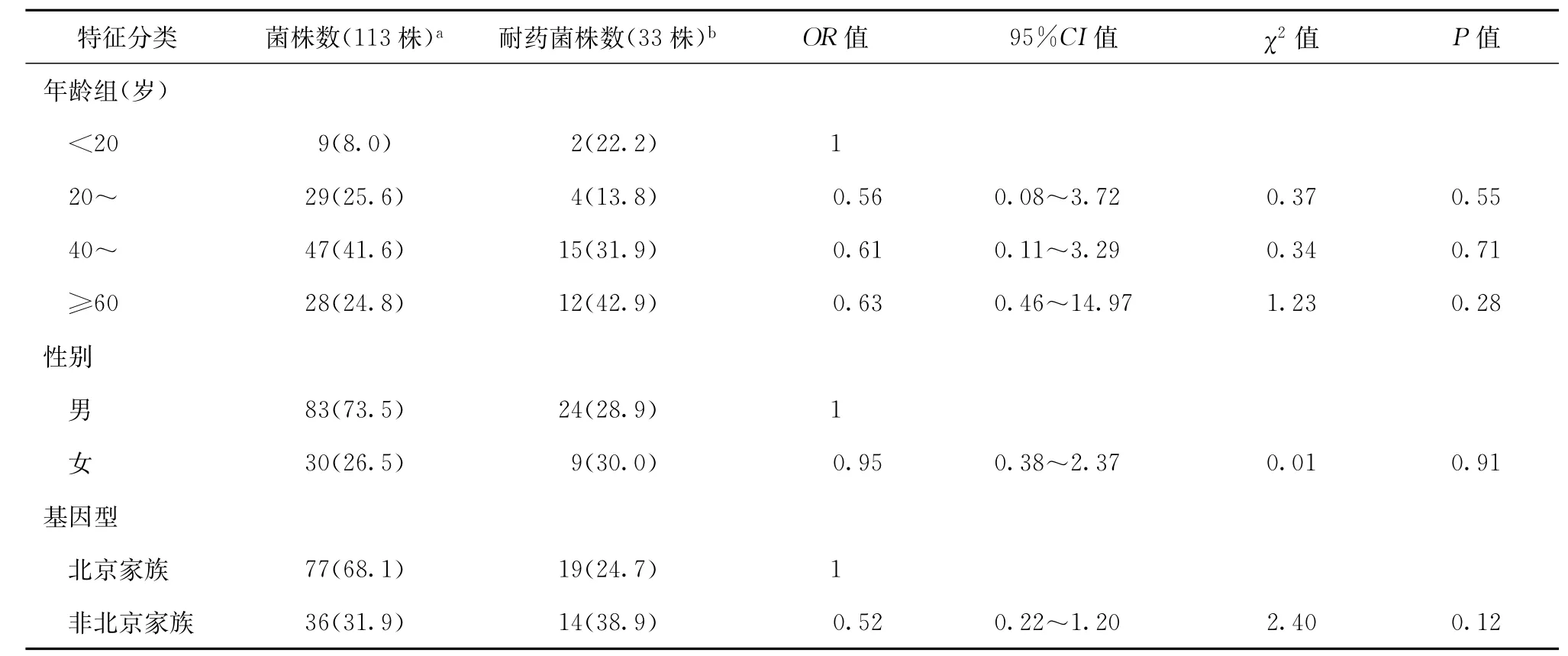
表1 不用因素对抗结核药物的耐药情况
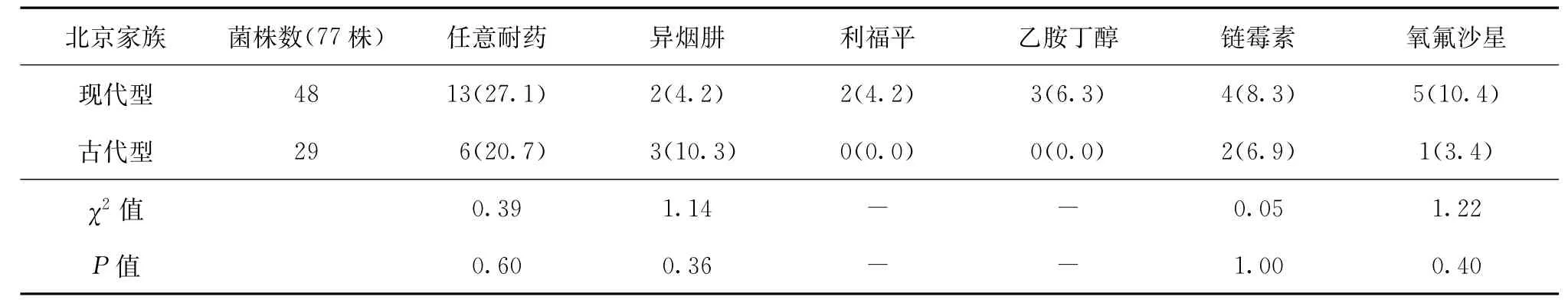
表2 北京家族古代基因型和现代基因型对抗结核药物的耐药情况
讨 论
北京家族是中国结核分枝杆菌的主要基因型。据报道,中国北方地区和南方地区北京家族表现为“北多南少”的特征:北方地区的北京家族达到76.5%,而南方地区的北京家族只有53.2%[7]。重庆位于中国的西南方,是结核病疫情高发区。此次研究中,笔者的研究结果显示:重庆北京家族占全部菌株的68.1%(77/113),为重庆市主要流行基因型,与报道基本相符。通过NTF分型,将北京家族分为古代型与现代型。文献报道,现代型结核分枝杆菌引起包括中国、俄罗斯、南非在内的世界范围的流行[8-9];而古代型在美国引起了小范围的暴发[10],在HIV/Mtb双重感染患者中也检测到古代型北京家族结核分枝杆菌[11]。本研究结果显示,在77株北京家族菌株中古代型为29株(37.7%,29/77),现代型为48株(62.3%,48/77)。说明现代型北京家族结核分枝杆菌在重庆市北京家族结核分枝杆菌中占优势地位,所以加强流行病学检测和生物学特性研究是十分必要的。非北京家族占31.9%(36/113),其表现为高度的基因多态性,以T家族为主,其中T1基因型检出率为36.1%(13/36)。文献报道,T1、T2主要流行于非洲和中、南美洲地区[12],因此,T1在重庆的高检出率可能与该地区炎热、潮湿的气候因素有关,人口流动也可能是原因之一,另外,本研究发现了9种新基因型,将在后期工作中展开关于这部分新基因型的分子进化的研究。本研究结果基本探明了重庆市结核分枝杆菌基因型的特点,为重庆市结核病病原学和结核病控制提供一定的科学依据。
另外,结核病的耐药问题是目前结核病防治的重要研究课题,由于耐多药北京家族菌株多次引起暴发性流行,使得北京家族菌株与耐药之间的关系成为了研究的热点[13],但研究结果不尽相同。有些文献报道,北京家族菌株耐药率高于非北京家族,如越南胡志明市、爱沙尼亚、美国纽约等地区[14]。也有文献报道,北京家族菌株与非北京家族菌株耐药率差异无统计学意义,如印度尼西亚、阿塞拜疆、哥伦比亚等地区,而香港地区北京家族菌株的耐异烟肼菌株比率甚至低于非北京家族菌株[15-16]。笔者的研究结果显示:77株北京家族耐药率为24.7% (19/77),36株非北京家族耐药率为38.9%(14/36),差异无统计学意义(χ2=2.40,P>0.05)。说明不支持北京家族菌株更易产生耐药的推断,即不认为结核分枝杆菌北京家族与耐药性之间存在相关性。现代型北京家族耐药率为27.1%(13/48);古代型北京家族耐药率为20.7%(6/29),差异无统计学意义(χ2=0.39,P>0.05)。笔者推测现代型、古代型北京家族与耐药性之间不存在相关性。采用寡核苷酸方法分辨出的基因型与耐药率差异无统计学意义,一方面也可能是由于样本量较小;另一方面寡核苷酸分辨能力有限,笔者将在后续实验中扩大样本量,采用多种其他基因分型方法补充完整。
[1]Liu JJ,Yao HY,Liu EY.Analysis of factors affecting the epidemiology of tuberculosis in China.Int J Tuberc Lung Dis,2005,9(4):450-454.
[2]Asgharzadeh M,Kafil HS.Current trends in molecular epidemiology studies of Mycobacterium tuberculosis.Biotechnol Mol Biol,2007,2(5):108-115.
[3]Gori A,Bandera A,Marchetti G,et al.Spoligotyping and Mycobacterium tuberculosis.Emerg Infect Dis,2005,11(8):1242-1248.
[4]中国防痨协会.结核病诊断细菌学检验规程.中国防痨杂志,1996,18(1):28-31.
[5]Kamerbeek J,Schouls L,Kolk A,et al.Simultaneous detection and strain differentiation of Mycobacterium tuberculosis for diagnosis and epidemiology.J Clin Microbiol,1997,35(4):907-914.
[6]王胜芬,赵雁林,黄海荣,等.结核分枝杆菌北京型菌株与耐药表型的关系.中国医学科学院学报,2009,31(4):427-431.
[7]逄宇,夏辉,姜广路,等.中国结核分枝杆菌寡核苷酸基因分型及其耐药性分析.中华检验医学杂志,2011,34(11):1023-1028.
[8]Hanekom M,van der Spuy GD,Streicher E,et al.A recently evolved sublineage of the Mycobacterium tuberculosis Beijing strain family is associated with an increased ability to spread and cause disease.J Clin Microbiol,2007,45(5):1483-1490.
[9]Mokrousov I,Jiao WW,Valcheva V,et al.Rapid detection of the Mycobacterium tuberculosis Beijing genotype and its ancient and modern sublineages by IS6110-based inverse PCR.J Clin Microbiol,2006,44(8):2851-2856.
[10]Milan SJ,Hauge KA,Kurepina NE,et al.Expanded geographical distribution of the N family of Mycobacterium tuberculosis strains within the United States.J Clin Microbiol,2004,42(3):1064-1068.
[11]Strauss OJ,Warren RM,Jordaan A,et al.Spread of a low-fitness drug-resistant Mycobacterium tuberculosis strain in a setting of high human immunodeficiency virus prevalence.J Clin Microbiol,2008,46(4):1514-1516.
[12]Brudey K,Driscoll JR,Rigouts L,et al.Mycobacterium tuberculosis complex genetic diversity:mining the fourth international spoligotyping database(SpolDB4)for classification,population genetics and epidemiology.BMC Microbiol,2006,6:23.
[13]Gutiérrez MC,Vincent V,Aubert D,et al.Molecular fingerprinting of Mycobacterium tuberculosis and risk factors for tuberculosis transmission in Paris,France,and surrounding area.J Clin Microbiol,1998,36(2):486-492.
[14]Anh DD,Borgdorff MW,Van LN,et al.Mycobacterium tuberculosis Beijing genotype emerging in Vietnam.Emerg Infect Dis,2000,6(3):302-305.
[15]van Crevel R,Nelwan RH,de Lenne W,et al.Mycobacterium tuberculosis Beijing genotype strains associated with febrile response to treatment.Emerg Infect Dis,2001,7(5):880-883.
[16]Chan MY,Borgdorff M,Yip CW,et al.Seventy percent of the Mycobacterium tuberculosis isolates in Hong Kong represent the Beijing genotype.Epidemiol Infect,2001,127(1):169-171.
Genotyping and drug resistance analysis of M.tuberculosis clinical isolates in Chongqing
WANG Xiao-yan*,ZHAO Yan-lin,PANG Yu,WANG Yu-feng,WAN Kang-lin,LIUJie,LIU Ying,SHENJing,DUChang-ting,ZHANG Shun.*Reference Laboratory,Chongqing Institution of Tuberculosis Control and Prevention,Chongqing 400050,China
ZHANG Shun,Email:ZS52077@sina.com
Objective To study the prevalence of different genotypes of M.tuberculosis in Chongqing and analyze the relationships between genotype and drug-resistant phenotype.Methods One hundred and thirteen M. tuberculosis clinical isolates were collected in Chongqing from January to December in 2011,performed drug susceptibility testing by the proportion method,analyzed the genotypes by Spoligotyping and PCR method,and then made gene glustering analysis.Results One hundred and thirteen clinical strains were divided into 2 gene clusters,namely Beijing family(68.1%,77/113)and non-Beijing family(31.9%,36/113).Of 77 Beijing family strains,48 (62.3%)strains were belong to modern type,29(37.7%)were the ancient type.Of 36 strains with non-Beijing family,13(36.1%)strains were T1 type,and found 9 new genotypes.The drug-resistant rate of Beijing family strains was 24.7%(19/77),and of non-Beijing family strains was 38.9%(14/36),in which there was no significant differences(χ2=2.40,P>0.05).The drug-resistant rate of modern type strains in Beijing family was 27.1% (13/48),and of the ancient type strains was 20.7%(6/29),in which there was no significant differences(χ2= 0.39,P>0.05).Conclusion There was obvious gene polymorphism in M.tuberculosis isolates in Chongqing. Beijing family was the main epidemic strains,in which the modern type was predominant.There was no significant correlation between genotype and drug resistance.
Mycobacterium tuberculosis; Genotype; Drug resistance,bacterial; Genotyping techniques;Chongqing city
2013-07-22)
(本文编辑:郭萌)
400050重庆市结核病防治所参比实验室(汪晓艳、刘洁、刘英、沈静、杜昌廷、张舜);中国疾病预防控制中心结核病预防控制中心 国家结核病参比实验室(赵雁林、逄宇、王玉峰);中国疾病预防控制中心传染病所(万康林)
张舜,Email:ZS52077@sina.com

