结核性脑膜炎临床分离株基因型和耐药表型的特征分析
王婷 赵雁林 刘家云 逄宇 周杨 赵冰 赵钢
·论 著 ·
结核性脑膜炎临床分离株基因型和耐药表型的特征分析
王婷 赵雁林 刘家云 逄宇 周杨 赵冰 赵钢
目的 了解导致结核性脑膜炎(TBM)的致病菌在基因型和耐药表型方面的特征。方法 利用间隔区寡核苷酸分型法(Spoligotyping)和数目可变串联重复序列(VNTR)分型法对25株TBM临床分离菌株进行基因分型;采用MGIT(mycobacteria growth indicator tube)960液体和比例法固体药敏试验分别对所选15种药物:异烟肼(INH)、利福平(RFP)、乙胺丁醇(EMB)、吡嗪酰胺(PZA)、链霉素(S)、卡那霉素(Km)、阿米卡星(Am)、卷曲霉素(Cm)、莫西沙星(Mfx)、氧氟沙星(Ofx)、左氧氟沙星(Lfx)、对氨基水杨酸(PAS)、乙硫异烟胺(Eto)、丙硫异烟胺(Pto)、环丝氨酸(Cs)进行药敏实验。结果 Spoligotyping分型法确定了在25株TBM临床分离株中有20株为北京基因型,占80.0%(20/25),2株为T1基因型,另外3株分别为T2型、LAM6型及未知型;VNTR有2株成一簇,基因型一样;25株TBM分离株中耐多药结核性脑膜炎(MDR-TBM)占12.0%(3/25),广泛耐药结核性脑膜炎(XDR-TBM)占4.0%(1/25),耐氟喹诺酮类的菌株占8.0%(2/25),都属于北京基因型;任意耐药的菌株占48.0% (12/25),其中83.3%(10/12)为北京基因型;全敏感者占52.0%(13/25),其中76.9%(10/13)为北京基因型。结论 北京基因型在耐药TBM中所占比例很高,尤其是 MDR-TBM,较其他基因型更易引起脑脊液生化的改变;耐氟喹诺酮类的菌株所占比例最少,提示临床上氟喹诺酮类药物对治疗TBM会有很好的疗效。
结核,脑膜; 分枝杆菌,结核; 基因型; 抗药性,细菌; 寡核苷酸分型; 小卫星重复

表1 25个VNTR位点、引物序列,及其在H37Rv中的重复次数
Mtb基因分型是识别结核病人群间传播的重要方法,可用于更准确地识别结核病的暴发、流行及其传播模式。近年来,基于Mtb散在分布重复单位(mycobacterial interpersed repetitive units,MIRUs)的多位点可变数量串联重复序列分析(mutiple loci VNTR analysis,MLVA)分型方法在国内外 Mtb基因分型研究中越来越受到关注。它是以PCR为基础,利用基因组中特定位点可变数量串联重复序列(VNTR),即不同菌株间拷贝数差异鉴定菌株,从而进行基因分型。本实验选取了文献报道[5]的25个分辨力较高的MIRUs的位点,对25 株TBM临床分离株进行PCR扩增,在琼脂糖凝胶上通过电泳确定扩增产物长度。再根据各位点不同重复单位拷贝数来区别并分型。此法操作简单,对基因型别的分辨能力高于IS6110限制性内切酶片段长度的多态性法(IS6110 restriction fragment length po1ymorphism,IS6110-RFLP)和Spoligotyping,且试验成本较低,适合在结核病高负担的中低收入国家和地区应用[6]。传统的 Mtb分型方法是描述IS6110限制性内切酶片段长度的多态性,并被认为是识别 Mtb基因型的“金标准”,但耗时,并需要用特殊软件分析,现使用较少[7];在我国流行的Mtb中北京基因型是一个重要的种类,具有特异分子标志RD105基因缺失区,表现为1~34个杂交信号缺失。基于直接重复区(DR)缺失的间隔区寡核苷酸分型(spacer oligonucleotide typing,Spoligotyping),具有敏感度高、重复性好、特异度强等特性,主要用于鉴定 Mtb家族的北京型和非北京型[8]。使用MLVA和Spoligotyping定义Mtb基因型,并有效区别北京基因型中各种亚型,可以更好地了解TBM临床分离株基因型的特点[9]。
鉴于此,本研究利用Spoligotyping、VNTR分型、比例法固体药敏和液体药敏对TBM的临床分离株在基因型和耐药性方面的特征作了初步分析,并尝试与肺结核的临床分离株各项检测结果进行比较,以了解两者之间有无差异。
材料和方法
一、材料和试剂
1.菌株来源:陕西省西安市第四军医大学西京医院2010年7月至2011年6月收集了500例确诊TBM并住院患者的脑脊液标本,经BACTEC MGIT 960快速培养结核分枝杆菌阳性者有25例,并经PCR、GeneXpert鉴定是Mtb。这25例患者包括男8例,女17例,中位年龄26岁,年龄范围3~82岁,15~60岁占68.0%(17/25);28.0%(7/25)有结核病接触史,40.0%(10/25)有肺结核病史;68.0%(17/25)经一线药物、16.0%(4/25)经氟喹诺酮类药物治疗过,20.0%(5/25)的患者死亡,72.0% (18/25)的患者肺部有空洞,44.0%(11/25)有高血压或糖尿病等并发症。H37Rv标准株由国家参比实验室提供,作为对照株。
2.诊断标准:500例患者根据2009年国际TBM临床诊断标准确诊为TBM[9],这些患者必须符合以下3个诊断标准中的任意一项:(1)脑脊液或组织中镜检查到抗酸杆菌;(2)分离培养出 Mtb;(3)商业化核酸扩增检测显示阳性。
3.试剂和仪器:所用试剂有2×Taq PCR Master Mix(天根生化科技有限公司)、BestaTM琼脂糖(赛百盛基因技术有限公司)、DNA Ladder Marker (TaKaRa公司)、凝胶成像仪(FOTO DYNE公司)、Spoligotyping试剂盒,Miniblotter MN45(荷兰Isogen Bioscience公司)、链霉亲和素(Sigma公司)、化学发光检测系统(enhanced chemiluminescence,ECL)(美国Amersham Bioscience公司)、全自动BACTEC MGITTM960TB系统、MGIT(mycobacteria growth indicator tube)960液体培养基、MGIT生长添加剂(美国BD公司)。L-J固体培养基依据《结核病诊断实验室检验流程》[10],由国家参比实验室制备。
用平板菌落计数方法,将样品液稀释106~107倍到每个平板生长30~300个菌落为计数的合适稀释度,涂布于MRS固体培养基上,将涂布样品的MRS固体培养基于30 ℃培养箱中培养2天后计数[17]。
二、检测方法
1.DNA的制备:取一接种环经L-J固体培养基培养2~3周后,将生长形态良好的菌体,溶于400μl TE缓冲液(p H值为8.0)中,80℃、30 min水浴灭活,涡漩振荡混匀,沸水浴煮沸30 min,12 000 r/min,离心半径10 cm,离心2 min,取上清备用,-20℃保存。
2.引物设计与合成:25个VNTR位点引物设计见表1,由北京擎科新业生物技术有限公司合成。
3.PCR反应体系和条件:VNTR分型采用20.0μl反应体系,其中含上、下游引物(10μmol/L)各1.0μl,2×Taq PCR Master Mix 10.0μl,双蒸水6.0μl,DNA模板2.0μl。PCR扩增条件为94℃预变性5 min,94℃变性30 s,因每条引物不同,因此退火温度从58℃到62℃不等,退火时间为30 s,72℃延伸1 min,30个循环之后72℃再延伸7 min。Spoligotyping采用25μl反应体系,其中引物DRa (5′-CCGAGAGGGGACGGAAAC-3′)和DRb(5′-GGTTTTGGGTCTGACGAC-3′)分别为1.0μl,2×TaqPCR Master Mix为12.5μl,DNA模板2.0μl,双蒸水8.5μl。PCR扩增反应条件为96℃预变性3 min,96℃变性60 s,55℃退火60 s,72℃延伸30 s,30个循环后72℃再延伸5 min。
4.抗结核药物:所选15种药物分别为:异烟肼(INH)、利福平(RFP)、乙胺丁醇(EMB)、吡嗪酰胺(PZA)、链霉素(S)、卡那霉素(Km)、阿米卡星(Am)、卷曲霉素(Cm)、莫西沙星(Mfx)、氧氟沙星(Ofx)、左氧氟沙星(Lfx)、对氨基水杨酸(PAS)、乙硫异烟胺(Eto)、丙硫异烟胺(Pto)、环丝氨酸(Cs),均购自Sigma-Aldrich公司(St.Louis,MO,USA)。INH、EMB、PZA、Km、Am、Cm、Mfx、PAS、Cs、S溶于双蒸水;RFP、Eto、Pto溶于DMSO有机溶剂中;Lfx、Ofx溶于NaOH(0.1 mol/L)中。所有药物在-20℃~-4℃存放。
5.含药培养基药物的终浓度:根据2008年WHO最新指南[11],MGIT960液体药敏试验选择14种抗结核药物,即:INH(0.1μg/ml)、RFP(1.0 μg/ml)、EMB(5.0μg/ml)、PZA(100.0μg/ml)、S (1.0μg/ml)、Km(2.5μg/ml)、Am(1.0μg/ml)、Cm(2.5μg/ml)、Mfx(0.5μg/ml,2.0μg/ml)、Ofx (2.0μg/ml)、Lfx(1.5μg/ml)、PAS(4.0μg/ml)、Eto(5.0μg/ml)、Pto(2.5μg/ml);固体药敏试验选择12种抗结核药物,即:INH(0.2μg/ml)、RFP (40.0μg/ml)、EMB(2.0μg/ml)、S(4.0μg/ml)、Km(30.0μg/ml)、Am(30.0μg/ml)、Cm(40.0μg/ml)、Ofx(4.0μg/ml)、Lfx(4.0μg/ml)、PAS(1.0μg/ml)、Pto(40.0μg/ml)、Cs(30.0μg/ml)。
6.比例法固体药敏试验:取L-J固体培养基2~3周后生长状态良好的菌落,分别在含药培养基上接种0.01 ml稀释菌液,菌液用生理盐水将一个麦氏浓度(107CFU/ml菌液)分别稀释10-2和10-4倍。同时将不加菌液的L-J固体培养基作为空白对照,放入37℃温箱中孵育4周后观察生长情况并计算菌落百分率。根据我国实验室诊断标准对耐药结果进行判定:耐药百分率=(含药培养基的菌落数/对照培养基的菌落数)×100%。耐药百分率<1%为敏感,≥1%为耐药[12]。
7.液体MGIT960药敏试验:严格地为每个MGIT960培养管添加800μl MGIT生长添加剂。取L-J固体培养基2~3周后生长状态良好的菌落,分别在已加药的MGIT培养管中加入500μl稀释菌液,菌液用生理盐水将0.5个麦氏浓度稀释5倍,空白对照稀释100倍(因PZA所用培养管是酸性的,与其他培养管不同。PZA的空白对照稀释10倍),置入MGIT960仪器中37℃培养。孵育至仪器报阳,最多培养6周,如未能生长,仪器将标记为阴性。
8.结果检测:VNTR实验中取5μl PCR扩增产物,在2%琼脂糖凝胶中电泳,电泳结束后在凝胶成像仪下观察条带并拍照储存。Spoligotyping试验中将PCR扩增产物与结合有43个间隔区寡核苷酸探针的Biodyne C膜进行杂交。最后,通过链霉素亲和素-过氧化物酶连接体(streptavidin-peroxidase conjugate)酶孵育及CDP-star检测,X线曝光获取结果。
9.结果分析:(1)VNTR结果采用Gel-Pro analyzer 3.1软件对凝胶进行数字化处理,确定产物大小,据此计算每个VNTR位点重复单位的重复次数,并形成一组编码。Spoligotyping结果为经二进制及八进制数转换后形成一组编码,再用BioNumerics(Version 5.0)数据库软件对两种分型实验结果进行聚类分析,将实验菌株进行分型处理,揭示菌株间的相互关系。根据VNTR基因分型结果,设计调查表,收集成簇菌株的患者资料,用以追踪同一簇患者间的相互传播途径,并分析其与耐药结果的相关性。(2)根据各位点重复次数计算位点的分辨率:本实验采用计算Hunter-Gaston分辨率指数(Hunter-Gaston diversity index,HGDI)来分析各位点的分辨率和合并分辨率,数值在0~1之间,即实验总体中的2个无关样本能够分到不同型别中的能力[13],数值越大,分辨率越大。计算公式为
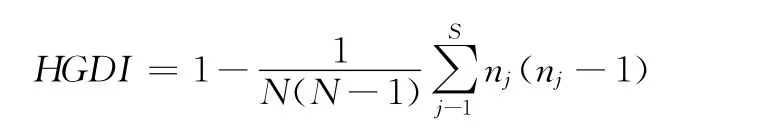
公式中N为所有菌株数,S为分型的型别数,nj表示在j型别中的菌株数[14]。(3)计算菌株成簇率:实验结果完全相同的菌株定义为一簇,成簇率为成簇菌株占总试验菌株的百分率。
10.统计学分析:应用SPSS 16.0进行Fisher精确检验,以分析北京基因型菌株耐药率和非北京型菌株的耐药率,以P<0.05为差异有统计学意义。
11.质量控制:质控均以标准株H37Rv和阴性对照进行。H37Rv的Spoligotyping结果表现为20、21、33~36的间隔区杂交呈阴性,其他间隔区杂交均为阳性,说明质控合格,若不一致,说明不合格。对于不合理的质控结果,采取重新检测质控样品重新进行试验。
结 果
一、Spoligotyping基因分型结果
从图1中可以看出TBM临床分离株被聚为7类,其中以典型北京基因型(1~34间隔区缺失)为主,占80.0%(20/25)。23、26为T1型,15为T2型,8为未知型(表2)。
二、北京基因型菌株与耐药表型的关系
从表3中可看出,25株TBM分离株中MDR-TBM 占12.0%(3/25),XDR-TBM占4.0%(1/25),耐氟喹诺酮类的菌株占8.0%(2/25),都属于北京型;任意耐药的菌株占48.0%(12/25),83.3%(10/12)是北京型;全敏感的菌株占52.0%(13/25),76.9% (10/13)是北京型。用SPSS 16.0对结果进行Fisher精确检验,显示北京基因型菌株耐药率和非北京型菌株的耐药率之间的差异无统计学意义(P= 1.000)。
三、VNTR位点多态性检测
本实验共选取了25个特异性较好的VNTR位点,对TBM临床分离菌株基因组进行扩增。
图2 A和B检验的是VNTR3820和Qub11b位点的多态性,结果显示各菌株的扩增产物大小差别很大,分辨率最高。实验中有些扩增位点可获得完整的数据结果,如图2A;但有些位点没有清晰的条带,需要经过多次不同退火温度的扩增,才能获得清晰的电泳条带以判断产物大小,如图2B中19号TBM临床分离株。最终,将实验获得的25个VNTR位点的完整数据结果作聚类分析(图3)。
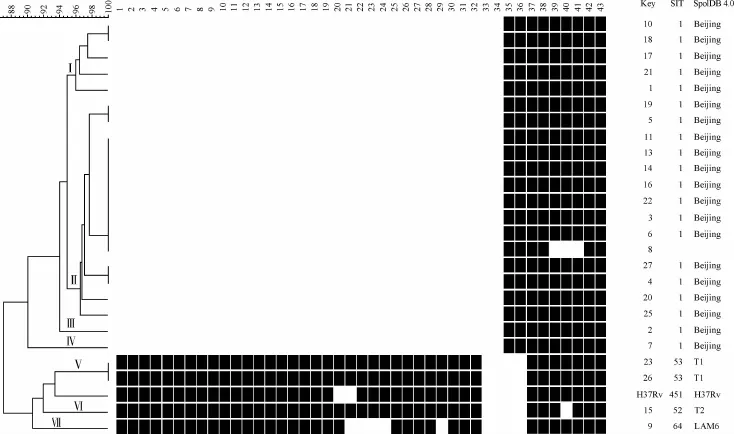
图1 Spoligotyping分型实验结果及聚类分析图

表2 25株TBM临床分离株在SpolDB 4.0中的Spoligotyping分型结果

表3 北京家族菌株与15种药物耐药的相关性

图2 结核性脑膜炎临床分离株在VNTR3820位点和Qubllb位点的多态性检测结果
四、VNTR结果
由于多个VNTR位点与Spoligotyping联合使用的分辨率已经能够达到IS6110-RFLP水平,加之操作简便,现已基本取代了后者,成为对 Mtb分型的标准方法。通过网站“http://www.hpa-bioinfotools.org.uk/cgi-bin/DICI/DICI.pl”计算本实验中25个VNTR位点的HGDI值后,发现VNTR3820 (HGDI=0.877)、Qub11b(HGDI=0.803)、MIRU26(HGDI=0.744)、Qub26(HGDI=0.687)、VNTR1955(HGDI=0.621)对所有TBM临床分离菌株有较高的分辨率。VNTR3820(HGDI=0.805)、Qub11b(HGDI=0.795)、MIRU26(HGDI=0.676)、Qub26(HGDI=0.648)对北京型TBM临床分离株有较高分辨率。VNTR3820、Qub11b、MIRU26、Qub26、VNTR1955、Mtub04、MIRU10、MIRU31、MIRU39、Mtub39、ETRA、Mtub30、MIRU4、MIRU40、VNTR4120、ETRC、MIRU23、MIRU16、MIRU27、MIRU2对非北京型TBM临床分离株有较高分辨率,HGDI值高于0.600。分辨率最差的位点是MIRU24,HGDI值<0.400。通过上述公式算出25个位点对25株临床分离株的综合分辨率为0.997;成簇率为8%(2/25)。此外,VNTR将TBM临床分离株分成完全独立的24个基因型,可归为3类;其中23和26号菌株成一簇,基因型一样(图3)。
讨 论
一、TBM与肺结核在基因型方面的差异性
在此次研究中获得了患者的一些基本信息(性别、年龄、既往史、结核病史、合并肺结核、一线药治疗诊疗情况、患者接触史等),能确定彼此之间的流行病学联系。从图1、3中可以看出23和26号菌株成一簇,基因分型结果相同。查阅病历资料后发现这2例患者住院日期相近,均为第一次入院,但所住医院地处西安市不同片区,因此排除院内感染的可能。2例患者性别均为男性,年龄均在7岁以下,都未患过肺结核,入院时根据临床表现和实验室检查进行TBM评分[8],均>6分,送检日期为同一天,脑脊液中分离培养Mtb时间均为2周左右,二者对一线药物的抗结核治疗均有效,脑脊液镜下均未见抗酸杆菌,ESAT-6均为阳性,脑脊液细胞学检查中发现淋巴细胞数均>63%,中性粒细胞均<10%,单核细胞均>9%,浆细胞均为0.5%,脑脊液生化检查发现葡萄糖含量均<3.9 mmol/L,蛋白含量均>0.4 g/ L,氯含量均低于125 mmol/L。但由于无法获知2例患者入院前有无接触或其他接触史,无法判断是否由相互传染所致,因此只能推断他们可能来自同一传染源。
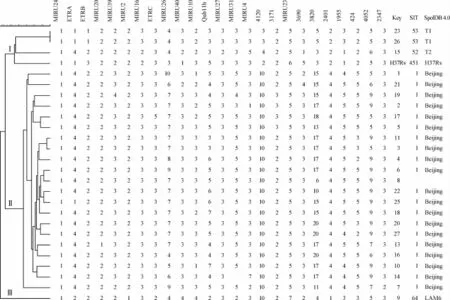
图3 VNTR分型实验结果及聚类分析图
本实验中笔者发现TBM临床分离株和肺结核临床分离株结果都比较分散,具有各种基因型别[15]。选取的25个位点综合分辨率高,HGDI值可达到0.997,其中Qub11b、MIRU26和Qub26分辨率最高,有文献报道这25个位点用于肺结核的VNTR分型,分辨率也可>0.900[15];从Spoligotyping分型后在SpolDB 4.0中的家族类型中可以看出T1、T2、Beijing、LAM6型均可引起TBM,而这些基因型同样可以引起肺结核;据文献报道,目前中国最流行的是北京型菌株,北京型菌株是感染肺结核的优势菌株[16]。25个TBM临床分离株均来自西北地区,以北京型为主,这点也与文献报道的陕西地区肺结核聚类情况相似[17]。这些发现提示,北京型可能也是感染TBM的优势菌株并与其发病有关,TBM感染菌株与肺结核感染菌株在基因分型上可能没有明显差别。
二、TBM与肺结核在耐药表型方面的差异性
25株TBM分离株中MDR-TBM占12.0% (3/25),XDR-TBM占4.0%(1/25),耐氟喹诺酮类的菌株占8.0%(2/25),都属于北京型;任意耐药的菌株占48.0%(12/25),其中83.3%(10/12)是北京型;全敏感的菌株占52.0%(13/25),其中76.9% (10/13)是北京型。耐氟喹诺酮类的菌株所占比例最少,耐一线药物的菌株所占比例最高。越南有文献报道,TBM耐多药率(2.5%)要低于肺结核耐多药率(5.9%)。因此,目前对于MDR-TBM的问题还未普遍受到关注。印度有文献报道,大多数TBM对一线药敏感(82.2%),有12.5%对异烟肼耐药[18]。本实验中可以看出中国MDR-TBM所占比例高于其他发展中国家,但仍低于中国耐多药肺结核所占比例(25.6%)[19]。由此可以看出,北京型可能与TBM和MDR-TBM的发病有关,是肺结核和结核性脑膜炎的优势菌株;虽然本实验中北京基因型菌株耐药率和非北京型菌株的耐药率之间的差异无统计学意义,但很可能与样本量少有关,因此不能就此下否定结论。此外,笔者也发现氟喹诺酮类药物在治疗肺结核和结核性脑膜炎方面都具有较好的效果[20],一线药物对TBM的治疗效果要优于肺结核。
大多数人感染Mtb后引起的是肺结核,Mtb也可通过血脑屏障后引起TBM。本实验中25例患者有18例肺部有结核病灶,说明大多数TBM患者可伴有肺结核,但不是每个TBM患者肺部都有结核病灶。被感染者感染的虽然都是 Mtb,但为何有些患者没有患肺结核,却有TBM?笔者认为,导致这种现象的原因可能是存在特异性感染肺结核的菌株型别、特异性感染TBM的菌株型别和均可感染肺结核和TBM的菌株型别,如果患者仅感染了嗜脑组织的Mtb,肺部就不会有病灶。
但由于TBM的发病率、诊断率不高,临床上可收集用于检测的脑脊液量有限,加上Mtb为胞内寄生菌,因此可从TBM患者脑脊液中分离培养获得的菌株数量很少,导致统计学没有意义,不能充分说明此假设的可靠性。若能扩大样本量,可能会使推断更据说服力。如果经扩大样本量后能发现某些基因型只能导致TBM而不能导致肺结核,并且耐药谱也不同,则对临床用药会有很大帮助。若发现导致TBM的基因型均能导致肺结核,则对于只患TBM而未合并肺结核的患者来说,原因有待探讨。本实验可以看出,从TBM和肺结核患者体内分离培养出的 Mtb具有相似基因型和耐药谱,治疗方法也没有很大差别。这就说明导致这种病因学差异性的原因与 Mtb的基因型和耐药谱关系不大,可能与Mtb的嗜组织性、血脑屏障、人体免疫系统、人体遗传多态性和特异感染途径有关,从而造成不同组织的病理改变。此外,本课题对于TBM的基础研究,很好地扩展了对结核病的研究范围,有助于解决临床上的诸多问题。比如,同样是不耐药的 Mtb,为何对肺结核疗效好的药物对结核性脑膜炎的疗效却不好?相信这将是结核病基础和临床研究的新方向,值得每个学者为之探索发现。
[1]Thaiss WM,Thaiss CC,Thaiss CA.Recent developments in the epidemiology and management of tuberculosis-new solutions to old problems?Infect Drug Resist,2012,5:1-8.
[2]Zumla A,Raviglione M,Hafner R,et al.Tuberculosis.N Engl J Med,2013,368(8):745-755.
[3]Liao PW,Chiang TR,Lee MC,et al.Tuberculosis with meningitis,myeloradiculitis,arachnoiditis and hydrocephalus:a case report.Acta Neurol Taiwan,2010,19(3):189-193.
[4]Schoeman JF,Donald PR.Tuberculous meningitis.Handb Clin Neurol,2013,112:1135-1138.
[5]Chen P,Shi M,Feng GD,et al.A highly efficient Ziehl-Neelsen stain:identifying de novo intracellular Mycobacterium tuberculosis and improving detection of extracellular M.tuberculosis in cerebrospinal fluid.J Clin Microbiol,2012,50(4):1166-1170.
[6]Chou CH,Lin GM,Ku CH,et al.Comparison of the APACHE II,GCS and MRC scores in predicting outcomes in patients with tuberculous meningitis.Int J Tuberc Lung Dis,2010,14(1):86-92.
[7]Bhigjee Al,Padayachee R,Paruk H,et al.Diagnosis of tuberculous meningitis:clinical and laboratory parameters.Int J Infect Dis,2007,11(4):348-354.
[8]Garg RK.Tuberculous meningitis.Acta Neurol Scand,2010,122(2):75-90.
[9]Marais S,Thwaites G,Schoeman JF,et al.Tuberculous meningitis:a uniform case definition for use in clinical research. Lancet Infect Dis,2010,10(11):803-812.
[10]中国防痨协会基础专业委员会.结核病诊断实验室检验规程.北京:中国教育文化出版社,2006:54,56-57.
[11]World Health Organization.Policy guidance on drug-susceptibility testing(DST)of second-line antituberculosis drugs. WHO/HTM/TB/2008.392.Geneva:World Health Organization,2008[2013-07-28].http://whqlibdoc.who.int/hq/2008/ WHO-HTM-TB-2008.392-eng.pdf.
[12]Pang Y,Zhou Y,Zhao B,et al.Spoligotyping and drug resistance analysis of Mycobacterium tuberculosis strains from national survey in China.PLoS One,2012,7(3):e32976.
[13]Lu B,Zhao P,Liu B,et al.Genetic diversity of Mycobacterium tuberculosis isolates from Beijing,China assessed by Spoligotyping,LSPs and VNTR profiles.BMC Infect Dis,2012,12:372.
[14]Hunter PR,Gaston MA.Numerical index of the discriminatory ability of typing systems:an application of Simpson's index of diversity.J Clin Microbiol,1988,26:2465-2466.
[15]吕冰,李兆娜,刘梅,等.45个可变数目串联重复序列位点用于中国结核分枝杆菌基因型鉴定的分辨力评价.中华流行病学杂志,2009,30(1):58-62.
[16]Pang Y,Song Y,Xia H,et al.Risk factors and clinical phenotypes of Beijing genotype strains in tuberculosis patients in China.BMC Infect Dis,2012,12:354.
[17]Zhou A,Nawaz M,Xue X,et al.Molecular genotyping of Mycobacterium tuberculosis in Xi'an,China,using MIRU-VNTR typing.Int J Tuberc Lung Dis,2011,15(4):517-522.
[18]Thwaites G,Caws M,Chau TT,et al.Relationship between Mycobacterium tuberculosis genotype and the clinical phenotype of pulmonary and meningeal tuberculosis.J Clin Microbiol,2008,46(4):1363-1368.
[19]Zhao Y,Xu S,Wang L,et al.National survey of drug-resistant tuberculosis in China.N Engl J Med,2012,366(23):2161-2170.
[20]Thwaites GE.Advances in the diagnosis and treatment of tuberculous meningitis.Curr Opin Neurol,2013,26(3):295-300.
The characteristic analyses in genotype and drug resistance of clinical isolates from the patients with tuberculous meningitis
WANG Ting*,ZHAO Yan-lin,LIU Jia-yun,PANG Yu,ZHOU Yang,ZHAO Bing,ZHAO Gang.*Department of Neurology,Center for Clinical Laboratory Medicine,Department of Infectious Diseases,Xijing Hospital,the Fourth Military Medical University,Xi'an 710032,China
ZHAO Gang,Email:zhaogang@fmmu.edu.cn
Objective To study the characteristics in genotype and drug resistance of clinical isolates from the patients with tuberculous meningitis.Methods Twenty-five clinical isolates from the patients with tuberculous meningitis(TBM)were analyzed by Spoligotyping,variable numbers of tandem repeats(VNTR),15 antituberculosis drug susceptibility testing methods,in which 15 drugs were as following:isoniazid,rifampicin,ethambutol,pyrazinamide,streptomycin,kanamycin,amikacin,capreomycin,moxifloxacin,ofloxacin,levofloxacin,para amino salicylic acid,ethionamide,prothionamide,cycloserine.Results Of 25 M.tuberculosis isolates,20(80.0%)were Beijing genotype,2 were T1 genotype,3 were other genotypes(including T2,LAM6,and unclassified genotype). 12.0%(3/25)were multi-drug resistant(MDR),and 4.0%(1/25)strains were extensive drug-resistant(XDR). 8.0%(2/25)strains were resistant to fluoroquinolones,all belong to Beijing genotype.48.0%(12/25)strains were resistant to any drug,in which 83.3%(10/12)were Beijing genotype;52.0%(13/25)strains were sensitive,in which 76.9%(10/13)strains were Beijing genotype.Conclusion Beijing genotype strains were possibly associated with drug-resistant tuberculosis and may act as the main epidemic strain of TBM.Few strains were resistant to fluoroquinolones,which may play an important role in TBM treatment.
Tuberculosis,meningeal; Mycobacterium tuberculosis; Genotype; Drug resistance,bacterial;Spoligotyping; Minisatellite repeats
2013-07-16)
(本文编辑:张晓进)
国家科技重大专项(2012ZX10003004)
710032西安,第四军医大学西京医院神经内科(王婷、赵钢),检验科(刘家云);中国疾病预防控制中心结核病预防控制中心 国家结核病参比实验室(赵雁林、逄宇、周杨、赵冰)
赵钢,Email:zhaogang@fmmu.edu.cn

