家禽日粮中酶制剂使用的现状和展望
奥托迎,张兰草
(1.Center for Animal Nutrigenomics&Applied Nutrition,Alltech Inc.,Nicholassville,KY40356,U.S.A.;2.Division ofRegulatoryServices,UniversityofKentucky,Lexington,KY40546,U.S.A.)
酶被定义为蛋白质催化剂,它可以启动和控制生物体内各种化学反应的速率。纵观历史,人们在酿造、食品加工和抗生素的合成等过程中都使用了酶进行催化反应。自从Sumner在1962年首次分离纯化了第1个酶——脲酶以来,分离提纯的各种酶制剂已被广泛用于纺织、皮革加工、食品和饮料加工行业。在动物饲料中添加酶制剂已有超过60 a的历史,但在最近15 a,酶制剂的使用才得到快速增长。
酶在消化过程中发挥关键作用。虽然动物本身或在其消化道中天然存在的微生物可以生产用于消化饲料的多种酶,但是有一些饲料成分,如植酸盐、可溶性纤维等,由于缺少内源分泌的消化酶,不能被单胃动物所消化利用。饲料中添加酶主要是帮助动物消化那些不能被消化的成分,而这些成分已被证明还具有抗营养作用,如植酸盐不能被消化,不仅它所含的磷不能被动物利用,而且植酸是一个很强的螯合剂,它在肠道内会影响其他多种营养物质(如矿物质、氨基酸)的吸收利用。由于酶本身是蛋白质,很长时间以来人们认为,饲料中添加酶制剂后,这些酶制剂就会在动物的胃肠道被消化而失去活性。1946年,Hastings[1]首次报道,在含有高纤维的鸡饲料中添加糖化酶,可以改进鸡的生长和饲料报酬。1957年,Jensen等[2]研究也发现,在含有大麦的家禽日粮中添加具有β-葡聚糖酶活性的发酵复合物,显著提高了鸡的生长表现,并减少了鸡排泄黏湿粪便,改善了垫料的湿度。Nelson等[3]在1967年首次证明,在鸡饲料中添加植酸酶可以有效提高鸡对植酸中磷的利用。之后,全球科研人员对植酸酶在动物饲料中的应用进行了大量而广泛的研究。
饲料中添加的酶制剂主要是通过微生物发酵和提取来生产。饲料级的酶通常含有多种酶活性,在过去的20 a,转基因和生物工程技术的快速发展,使大量生产高活性饲料用酶成为可能。目前家禽日粮中常用的一些酶制剂列于表1。

表1 家禽日粮中常用的一些酶制剂[4]
目前,在家禽饲料中应用最广泛的酶包括β-葡聚糖酶、木聚糖酶和植酸酶,其中,前2种酶都属于碳水化合物降解酶,主要添加在含有大麦、燕麦、黑麦或小麦的家禽日粮中,帮助家禽对这些谷物中所含的非淀粉多糖进行降解。非淀粉多糖包括不溶性多糖(主要存在于细胞壁)和可溶性多糖(主要存在于胚乳部分)。其中,大麦和燕麦含有的非淀粉多糖主要是β-葡聚糖,而黑麦和小麦主要是阿拉伯木聚糖。最初,人们仅对这些非淀粉多糖的低营养价值有所认识,后来的研究发现,它们在饲料中还会大大降低其他营养物质的有效利用。几种常见谷物中所含非淀粉多糖的种类和平均数量列于表2。
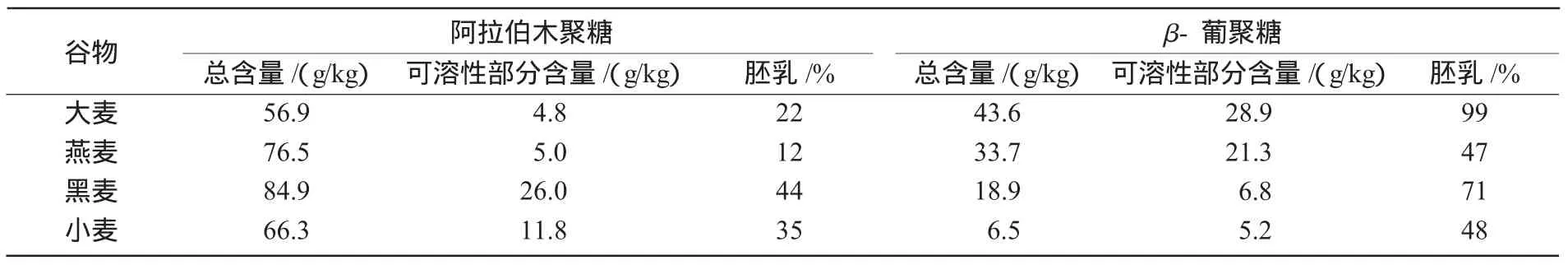
表2 常见谷物中阿拉伯木聚糖和β-葡聚糖的总含量和可溶性部分含量及其在胚乳部分所含的比例
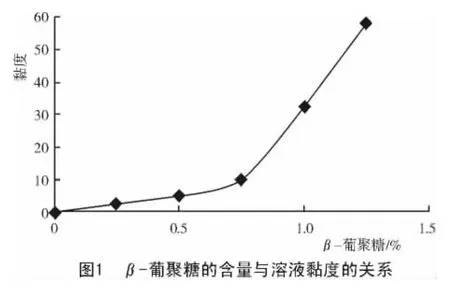
谷物中可溶性非淀粉多糖如β-葡聚糖和阿拉伯木聚糖,不能被单胃动物如肉仔鸡所消化利用,原因是由于在小鸡的胃肠道中缺乏相应的消化酶。这些非淀粉多糖类物质易溶于水,形成黏性溶液(图1),从而使小肠内食糜的黏度增加,降低营养物质扩散速率以及底物和消化酶在黏膜表面的相互作用[5],这不仅影响到营养物质的消化效率,而且影响到基本营养素如葡萄糖、脂肪酸、氨基酸以及矿物质元素的吸收利用率[6]。另外,由于大量营养物质在肠道内的滞留,使家禽消化道内微生物大量繁殖,进一步给家禽的生长带来不利的影响。这也是为什么在含有大麦或小麦的日粮中添加抗生素可以看到类似添加酶效果的原因[7]。通过多年大量的试验证明,在以大麦为基础的肉鸡日粮中添加β-葡聚糖酶或在以小麦或黑麦为基础的肉鸡日粮中添加含有木聚糖酶活性的酶制剂,可以显著改进肉鸡的生产性能和提高饲料效率[8-19]。这种结果并不主要是由于可溶性非淀粉多糖被酶水解后,所释放的单糖被动物吸收利用所致,而主要是消化道内特别是小肠内的黏度由于可溶性非淀粉多糖被酶水解而显著降低的缘故[20-25]。
植物中大部分存储的磷是以植酸磷的形式存在于籽粒中。玉米和豆粕中植酸磷占总磷的比例分别为90%和75%[26]。由于单胃动物(鸡和猪)不能分泌植酸酶,这些植酸磷被单胃动物的利用率不足30%。大量的磷从动物粪便中排出,将造成环境特别是水源的污染。另外,植酸在肠道中还会与其他的矿物质(如 Ca,Fe,Cu,Mn,Zn)、氨基酸和淀粉形成复合物,从而降低这些营养物质的有效利用率[27]。大量研究结果表明,在家禽饲料中添加植酸酶,不仅可以使植酸磷的利用率提高20%~45%,而且还显著增加了其他营养物质的利用[28-30]。
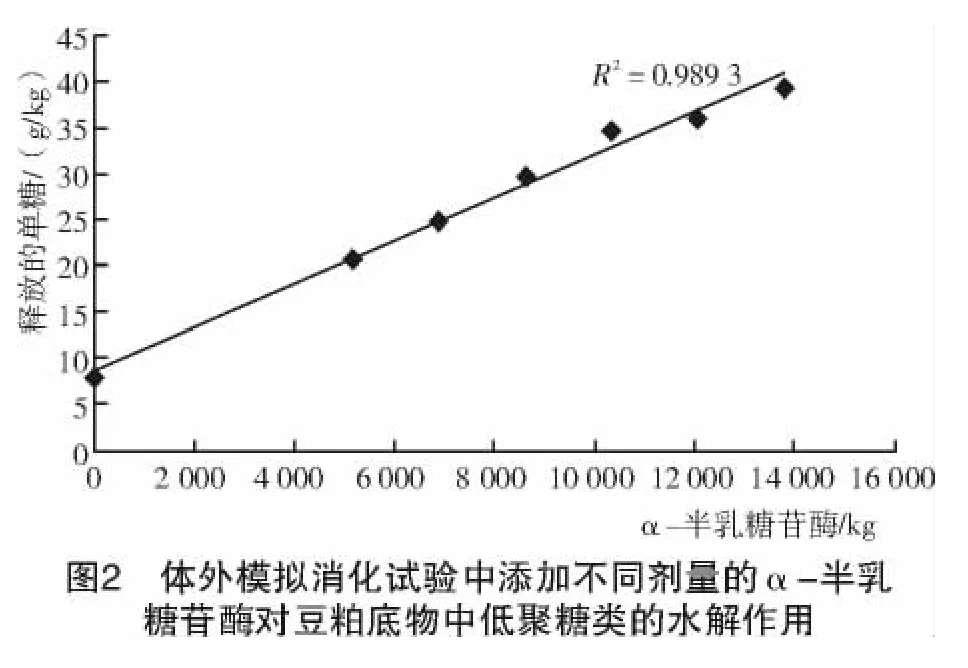
豆粕是迄今为止世界各地的动物饲料中使用最广泛的蛋白源。据估计,约63%用于动物饲料的蛋白质来源于大豆蛋白,在美国,豆粕提供家禽饲料中98%的植物蛋白。大豆中含有包括抗胰蛋白酶、外源凝集素和低聚糖在内的多种抗营养因子。虽然,热处理通常被认为是一种非常有效去除这些抗营养因子的方法,特别是抗胰蛋白酶和外源凝集素[31],但是,有一些抗营养因子如低聚糖,还是不能通过热处理来消除。豆粕中含有约22.7%的非淀粉多糖[21],其中,有6%是低聚糖[32]。由于单胃动物不分泌用于消化低聚糖的α-半乳糖苷酶[33],这些低聚糖在肠道内的积累可以引起大量气体的产生[34],并使肠道蠕动加快,从而降低动物对营养物的消化吸收[35-36]。家禽对豆粕中的能量利用率很低(仅为总能量的50%)[37],其中与这些低聚糖的抗营养作用有关[38]。有试验表明,用完全去除低聚糖的豆粕来饲喂公鸡,所测的氮矫正真代谢能(TMEn)比普通豆粕高21%,消化物在胃肠道的停留时间延长50%[39]。在过去的10多年,科学家们试图通过在家禽饲料中添加α-半乳糖苷酶来消化这些低聚糖类(图2),从而提高豆粕的代谢能值[40-42]。另外,一些研究人员试图利用蛋白酶对豆粕进行预处理,从而消除残余的抗胰蛋白酶和外源凝集素等抗营养物[43-45]。
尽管酶制剂在家禽日粮中的使用得到了一些普及,但在其他动物饲料中的应用还十分有限。即使在家禽日粮中,常用的酶制剂也只有以上提到的几种。为了充分发挥酶制剂在动物饲料中的使用潜能,使更多的酶应用于更广泛的饲料中,未来应在5个方面对其进行广泛而深入的研究。
第一,目前,大部分酶制剂通过真菌发酵来生产,是较为传统的一种方式,但是,这些酶往往不能抵抗高温和低pH值等,在饲料的制粒或膨化过程中,酶的活性会降低。未来将利用不同的生产方式,比如通过基因重组[46],利用细菌或植物果实来生产[47],使生产的酶具有较高的活性及较强的抗环境能力,如在高温、低pH值环境以及在蛋白水解酶存在的情况下都具有较高的酶活性。
第二,开发测定酶活性的标准方法。目前,全球尚未找到一种能测量各种饲料用酶的标准方法。事实上,酶活性的测定一般都是在酶添加到饲料之前进行,一旦将酶加入饲料,酶活性的测定就变得十分困难[48],这样就不利于酶制剂之间的相互比较,同时也不利于监测酶在饲料加工过程中活性的变化情况。
第三,对各种酶制剂之间的协同或拮抗作用进行调查研究。从理论上讲,利用酶对某一底物进行彻底消化,不能仅依靠一种酶,而要依靠多种酶的协同作用。另外,由于酶本身是属于蛋白质,蛋白酶和其他酶制剂同时添加是否会降低其他酶的效率,这都需要研究数据的支持。
第四,尽管目前知道酶加入饲料后,可以提高饲料的消化率,促进家禽的生长。但是,有关酶在消化道中具体的作用部位尚不清楚。以家禽为例,饲料中加入的酶主要是在嗉囊、肌胃、小肠或整个消化道中发生作用,这还有待进一步研究。这些信息的获得有助于开发新的更有效的饲料用酶。从酶在饲料中的应用看,家禽饲料中的应用效果总体好于猪饲料,部分学者把这归结于家禽和猪在整体消化系统方面的差异。由于家禽具有嗉囊,饲料中的酶可以在这里得到缓冲;而猪饲料直接进入胃,饲料中加入的酶的活性由于胃里的低pH值和蛋白酶可能会受到很大影响。这些推断还需要得到进一步证实。
第五,饲料酶制剂的研究还包括将酶的活性、饲料原料的种类以及动物生产表现视为整体的模型研究,如果该项研究成功,就可以利用模型来预测当某种酶用于特定的饲料时可能带来的收益。
[1]Hastings W H.Enzyme supplements to poultry feeds[J].Poultry Sci,1946,25:548-586.
[2]Jensen L S,FryR E,Allred J B,et al.Improvement in the nutritional value of barley for chicks by enzyme supplementation[J].PoultrySci,1957,36:919-921.
[3]Nelson T S.The utilization of phytate phosphorus by poultry-A review[J].PoultrySci,1967,46:862-869.
[4]Thorpe J,Beal J D.Vegetable protein meals and the effect of enzymes[M]//Bedford MR,Partridge G G.Enzymes in Farm Animal Nutrition.UK:CABI Publishing,2001.
[5]Johnson I T,Jennifer MG.Effect of gel-forminggums on the intestinal unstirred layer and sugar transport in vitro[J].Gut,1981,22:398-403.
[6]White W B,Bird H R,Sunde ML,et al.Viscosity of β-D-glucan as a factor in the enzymic improvement of barley for chicks[J].PoultrySci,1983,62:853-862.
[7]MacAuliffe T,McGinnis J.Effect of antibiotic supplement to diets containing rye on chick growth[J].Poultry Sci,1971,50:1130-1134.
[8]Fry R E,Allred J B,Jensen L S,et al.Influence of enzyme supplementation and water treatment on the nutritional value of different grains for poults[J].PoultrySci,1958,37:372-375.
[9]Willingam H E,Jensen L S,McGinnis J.Studies on the role of enzyme supplements and water treatment for improving the nutritional value ofbarley[J].PoultrySci,1959,38:539-544.
[10]Berg L R.Effect of adding enzyme to barley diets at different ages of pullet on laying house performance[J].Poultry Sci,1961,40:34-39.
[11]Potter L M,Stutz M W,Matterson L D.Metabolizable energy anddigestibility coefficients of barley for chicks as influenced bywater treatment or bypresence of fungal enzyme[J].Poultry Sci,1965,44:565-573.
[12]Hesselman K,Elwinger K,Nilson M,et al.The effect of β-glucanase supplementation,stage of ripeness,and storage treatment of barley diets fed to broiler chickens[J].Poultry Sci,1981,60:2664-2671.
[13]Hesselman K,Aman P.The effect of β-glucanase on utilization of starch and nitrogen by broiler chickens fed on barley of low and high viscosity[J].AnimFeed Sci Tech,1986,15:83-93.
[14]Pettersson D,Aman P.Effects of enzyme supplementation of Poultrydiet containingrye and wheat[J].Br J Nutr,1988,62:139-149.
[15]Grootwassink J W D,Campbell G L,Classen H L.Fractionation of crude pentosanase for improvement of the nutritional value of rye diets for broiler chickens[J].J Sci Food Agric,1989,46:289-300.
[16]Classen H L,Campbell G I.Improvement of feed utilization through the use of enzyme products[C]//Proceedings of the Australian PoultryScience Symposium.Sydney:The University ofSydney,1990:1-8.
[17]Friesen O D,Guenter W,Rotter B A,et al.The effects of enzyme supplementation on the nutritive value of rye grain for the youngbroiler chick[J].PoultrySci,1991,70:2501-2508.
[18]Bedford MR,Classen H L,Campbell G L.The effect of pelleting,salt,and pentosanase on the viscosity of intestinal contents and the performance of broilers fed rye [J].Poultry Sci,1991,70:1571-1577.
[19]Brenes A,Smith M,Guenter W,et al.Effect of enzyme supplementation on the performance and digestive tract size of broiler chickens fed wheat and barley based diets[J].Poultry Sci,1993,72:1731-1739.
[20]Campbell G L,Sosulski F W,Classen H L,et al.The nutritive value of irradiated and β-glucanase-treated wild oat groats for broiler chickens[J].Anim Feed Sci and Tech,1986,16:243-252.
[21]Chesson A.Supplementaryenzymes toimprove the utilization of pigand poultrydiets[M]//Haresign W,Cole DJ A.Recent Advances in Animal Nutrition.UK:Butterworths,1987.
[22]Rotter B A,Marquardt R R,Guenter W,et al.In vitro viscosity measurements of barley extracts as predictors of growth responses in chicks fed barley-based diets supplemented with a fungal enzyme preparation [J].Can J Anim Sci,1989,69:431-439.
[23]Classen H L,Bedford MR.The use of enzymes to improve the nutritive value of poultry feeds[M]//Recent Advances in Animal Nutrition.London:Butterworth-Heinemann,1991.
[24]Cowan D.Advances in feed enzyme technology[J].Agro Food IndustryHi Tech,1992,3(3):9.
[25]Bedford M R,Schulze H.Exogenous enzymes for pigs andPoultry(Review)[J].Nutr Res Rev,1998,11:91-114.
[26]CVB.Table of feedstuffs[C]//Information about composition,digestibility and feeding value.Lelystad in Netherland:Centraal Veevoederbureau,1998.
[27]PallaufJ,Rimbach G.Effect ofsupplemental phytase on mineral and trace element bioavailability and heavy metal accumulation in pigs with different type diets[M]//.Phytase in animal nutrition and animal waste management.Germany:BASF publication DC9601,1997.
[28]Ravindran V,Bryden WL,KornegayE T.Phytates:occurrence,bioavailabilityand implications in Poultrynutrition[J].Poult A-vian Biol Rev,1995,6:125-143.
[29]Sebastian S,Touchburn S P,Chavez E R,et al.The effects of supplemental microbile phytase on the performance and utilization of dietary calcium,phosphorus,copper and zinc in broiler chickens fed corn-soybean diets[J].Poultry Sci,1996,75:729-736.
[30]Ao T,Pierce J L,Pescatore A J,et al.Effects of organic Zn and phytase supplementation in a maize-soybean meal diet on the performance and tissue Zn content of broiler chicks[J].Brit Poult Sci,2007,48(6):690-695.
[31]Campbell G L,Van der Poel,A F B.Use of enzymes and process technology to inactivate antinutritional factors in legume seeds and rapeseed [M]//Recent Advances of Research in Antinutritional Factors in Legume Seeds and Rapeseed.Wageningen:Wageningen Press,1998:377-386.
[32]Trugo L C,Farah A,Cabral L.Oligosaccharide distribution in Brazilian soya been cultivars [J].Food Chem,1995,52:385-387.
[33]Gitzelmann R,Auricchio S.The handling of soy α-galactosidase by a normal and galactosemic child [J].Pediatrics,1965,36:231-232.
[34]Steggerda F R.Gastrointestinal gas following food consumption[J].Ann NYAcad Sci,1968,150:57-66.
[35]Kuriyama S,Mendel L B.The physiological behavior of raffinose[J].J Biol Chem,1917,31:125-147.
[36]Wiggins H S.Nutritional value ofsugars and related compounds undigested in the small gut[J].Proc Nutr Soc,1984,43:69-85.
[37]Dudley-Cash W A.Soybean meal source,added enzyme affect nutritional value for chicks[J].Feedstuffs,2001,73:41.
[38]Parsons C M,Zhang Y,Araba M.Nutritional evaluation of soybean meals varying in oligosaccharide content[J].Poult Sci,2000,79:1127-1131.
[39]Coon C N,Leske K L,Akavanichan O,et al.Effect of oligosaccharide-free soybean meal on true metabolizable energy and fiber digestion in adult roosters [J].Poult Sci,1990,69:787-793.
[40]Leske K L,Akavanichan O,Cheng T K,et al.Effect of ethanol extract on nitrogen-corrected true metabolizable energyfor soybean meal with broilers and roosters[J].Poult Sci,1991,70:892-895.
[41]Ao T,Cantor A H,Pescatore A J,et al.Effect of enzyme supplementation and acidification of diet on nutrient digestibility and growth performance of broiler chicks [J].Poult Sci,2009,88:111-117.
[42]AoT,Cantor AH,Pescatore AJ,et al.Effects of citric acid,alpha-galactosidase and protease on in vitro nutrient release from soybean meal and trypsin inhibitor content in raw whole soybeans[J].AnimFeed Sci Tech,2010,162:58-65.
[43]HuoG C,Fowler V R,Bedford M.The use of enzymes to denature antinutritive factors in soybean[M]//Recent Advances of Research in Antinutritional Factors in Legume Seeds.Proceedings of the Second International Workshop on'Antinutritional factors (ANFs)in Legume seeds'.Wageningen:Wageningen Pers,1993.
[44]Rooke J A,Slessor M,Fraser H,et al.Growth performance and gut function of piglets weaned at four weeks of age and fed protease-treated soybean meal[J].Anim Feed Sci and Tech.1998,70:175-190.
[45]Ghazi S,Rooke J A,Galbraith H,et al.The potential for the improvement of the nutritive value of soybean meal by different proteases in broiler chicks and broiler cockerels[J].Br Poult Sci,2002,43(1):70-77.
[46]Ward P P,Conneely O M.Using biotechnology to improve enzyme yields:from DNA to the market place[C]//Enzymes in Animal Nutrition,Proceedings of the 1 Symposium.Kartause Ittingen,Switzerland:Institute ofAnimal Science,1993.
[47]ForsbergCW,ChengKJ,Krell J,et al.Establishment ofrumen microbial gene pools and their manipulation to benefit fiber digestion bydomestic animals[C]//Proceedings VII World Conference on Animal Production.Edmonton,Alberta,Canada:UniversityofAlberta,1993.
[48]Bedford MR.Matching enzymes to application[J].Feed Management,1993,44:14-18.

