鮰鱼皮明胶的水解工艺
吕 顺,林 琳,向 蔚,陆剑锋,叶应旺,姜绍通
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
水解明胶是一种低分子质量多肽,是以动物结缔组织中的胶原蛋白为原料,经水解而制得的产品[1]。水解明胶除具有明胶所固有的绝大部分优良理化性能外,经水解后,相对分子质量降低,在水中的溶解度增大,更易被人体吸收。明胶水解物除具有优良的理化性能外,还具有多种生物活性,如鱿鱼皮[2-3]和河豚鱼皮[4]明胶水解物及罗非鱼骨明胶水解物[5]被发现具有清除自由基和抗氧化活性,鳕鱼皮明胶[6]、海参明胶[7]和鱿鱼皮明胶[8]水解物被发现具有ACE抑制活性等。目前,水解明胶已广泛应用于食品、医药、化妆品等方面[9]。
明胶水解的方法主要有酸法、碱法和酶法,其中使用较为广泛的是酶法水解[10]。酶法水解明胶的过程中产生的污染物少,反应条件温和,生产过程中能耗少,产品性能稳定质量可靠,且整个生产过程易形成连续化生产,便于大批量生产。碱性蛋白酶[11]、木瓜蛋白酶[12]、复合蛋白酶[13]、胃蛋白酶[14]、Alcalase[15]等酶都被用于水解明胶或鱼皮,生产水解明胶和多肽。
斑点叉尾鮰(Ictalurus punctatus)是安徽乃至全国的主要淡水养殖、加工品种,主要用于生产出口鮰鱼片,鮰鱼片加工中产生40%左右的下脚料,主要是鱼皮(10%)、鱼骨、内脏等,目前这部分副产物主要用来生产鱼粉,其中的胶原蛋白/明胶资源被大大浪费。从鮰鱼皮中提取明胶、制备水解明胶,既可以减少加工废弃物对环境的污染,又可增加其附加值。本实验以鮰鱼皮明胶为原料,通过单因素和正交试验确定碱性蛋白酶水解明胶的最佳工艺条件,为水解明胶的生产提供理论依据。
1 材料与方法
1.1 材料与试剂
斑点叉尾鮰鱼(Ictalurus punctatus)鱼皮 安徽明光永言水产食品有限公司。
碱性蛋白酶 北京奥博星生物技术有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
RE52-86A旋转蒸发器 上海亚荣生化仪器有限公司;FSH-ZA型可调高速匀浆机 江苏省金坛市华荣仪器制造有限公司;HH-2孔数显水浴锅 江苏金坛市环宇科学仪器厂;SP-752紫外分光光度计 上海光谱仪器有限公司;FD-1型真空冷冻干燥机 北京博医康实验仪器有限公司;CT15RT台式高速冷冻离心机 上海天美生化仪器设备工程有限公司。
1.3 方法
1.3.1 鮰鱼皮明胶的提取[16]
称取一定量的鮰鱼皮,剪成小块,按1:6(m/V)加入0.05mol/L NaOH溶液浸泡30min,水洗至中性,按1:6再加0.2%硫酸溶液浸泡30min,水洗至中性,最后用热水抽提过夜,4000r/min离心20min,弃去沉淀不溶物,得到粗胶制品,于冷冻干燥机中冻干。
1.3.2 鮰鱼皮明胶水解工艺
称取制备的明胶,用蒸馏水溶解制成相应质量浓度的明胶溶液。采用碱性蛋白酶对明胶溶液进行水解,水解过程中用电动搅拌机不断搅拌,水解结束后,将水解液置于沸水浴中煮沸10min以灭酶活,终止水解反应,然后迅速冷却至室温。将水解液以4000r/min离心15min,弃去沉淀并记录上清液体积。
1.3.3 明胶水解度的测定
采用紫外分光光度法[17]测定明胶水解度,并对此方法进行改进。
1.3.3.1 明胶溶液测试质量浓度的确定
通过不同加酶量(0.1、0.2、0.3、0.5、1.0、2.0、3.0g/100mL)对明胶水解程度的影响实验,对明胶溶液的质量浓度与吸光度的关系进行研究,确定明胶溶液的测试质量浓度。具体操作为:在pH 10.0、10g/100mL的明胶溶液中,改变碱性蛋白酶加入量,并在温度为50℃恒温水浴锅中,使明胶水解2h。反应完成后,将明胶配成质量浓度为10-2、10-3、10-4g/mL的测试液进行测定,以确定测试液质量浓度。
1.3.3.2 明胶水解液水解度与吸光度的线性相关性
取9支试管(含1mL pH10.0的明胶溶液)于50℃水浴锅中预热10min,各管中分别加入1mL 6000U/mL碱性蛋白酶酶液,在50℃条件下对明胶进行水解,酶解时间分别为5、10、15、20、30、60、120、240、480min。水解完成后,于100℃煮沸5min灭酶活,4000r/min离心15min,弃去沉淀并记录上清液体积。用蒸馏水将上清液定容到适当的质量浓度,在波长为275nm处测定吸光度。吸光度测定完后,采用茚三酮法[18]测定水解液的水解度(DH)。水解度按公式(1)计算。

式中:h为水解后每克蛋白质被裂解的肽键毫摩尔数/(mmol/g);htot为每克原料蛋白质的肽键毫摩尔数/(mmol/g),明胶取8.41mmol/g。
以水解液的吸光度为横坐标,水解度为纵坐标,绘制水解液吸光度和水解度的关系图,确定线性方程和相关性以及适用的吸光度范围。
1.3.4 明胶水解液氮回收率(NR)的测定
采用碱性蛋白酶对鮰鱼皮明胶进行水解后,记录水解离心后上清液的总体积,取5mL水解液,用凯氏定氮法消化、定氮,测定上清液中蛋白含量,则氮回收率按式(2)计算。

1.3.5 明胶水解液平均分子质量的测定[19]
将分子质量已知的标准品K2CrO4(Mr=196)、还原型谷胱甘肽(Mr=307)、VB12(Mr=1355)、细胞色素C(Mr=12300)和胃蛋白酶(Mr=35500)各10mg,分别溶于1mL洗脱磷酸盐缓冲液(0.1mol/L,pH7.0)中,配制质量浓度为10mg/mL的标准溶液。
取已处理好的交联葡聚糖凝胶(Sephadex G-25)装柱,并用洗脱液平衡。分别加入各标准品1mL,在280nm波长处检测其吸光度,并记录各标准品出现最大吸收峰时洗脱液的流出体积(mL)。
以标准品重铬酸钾、还原型谷胱甘肽、VB12、细胞色素C和胃蛋白酶洗脱体积(V)为纵坐标,标准品分子质量的对数(lgMr)为横坐标,绘制分子质量标准曲线,根据分子质量标准曲线,计算明胶水解液的平均分子质量。
1.3.6 碱性蛋白酶水解明胶的最佳条件确定
选用碱性蛋白酶作为水解明胶用酶,对酶解温度(35、40、45、50、55℃)、pH值(8.0、9.0、9.5、10.0、10.5)、酶解时间(1、2、3、4、5h)、加酶量(1000、2000、3000、4000、5000U/mL)进行单因素试验,然后采用四因素三水平正交试验确定碱性蛋白酶水解明胶的最佳条件。
2 结果与分析
2.1 明胶水解度测定方法的确定
分别测定质量浓度为10-2、10-3、10-4g/mL的明胶溶液经水解后在275nm波长处的吸光度(A275nm),以加酶量为横坐标,吸光度为纵坐标,绘制加酶量与明胶水解液吸光度之间的关系曲线。
从图1可以看出,当明胶溶液的质量浓度为10-3g/mL时,明胶的水解度与吸光度(A275nm)之间的关系能正确地反映出明胶的水解反应规律,其他两种质量浓度的测试结果都有明显的误差,难以判断明胶的水解。因此,确定采用紫外分光光度法测定明胶溶液水解度的适宜质量浓度为10-3g/mL。
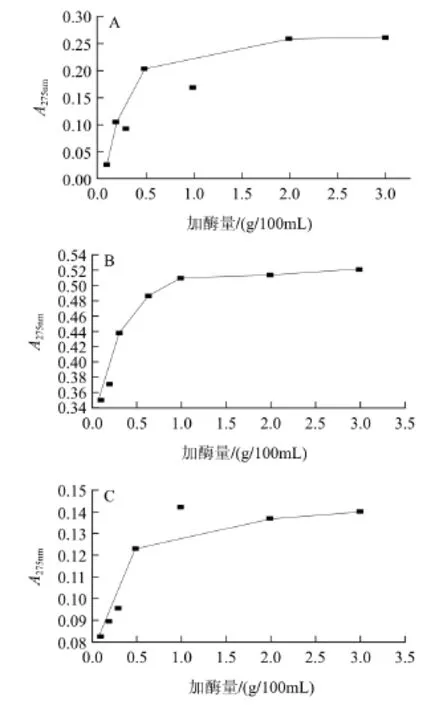
图1 酶用量与明胶溶液质量浓度的关系Fig.1 Relationship between enzyme loading and gelatin concentration
取碱性蛋白酶,在其适宜作用条件下,对明胶溶液分别水解5、10、15、20、30、60、120、240、480min。水解完成后采用紫外分光光度法测定水解液的吸光度(A275nm),并采用传统水解度测定方法测定明胶的水解度,以吸光度(A275nm)为横坐标,以水解度为纵坐标作图。得到:当吸光度在0.082~0.708的范围内时,水解液的吸光度与水解度成线性关系,其线性相关方程为:Y=49.39X-0.443(R2=0.996),式中:Y为水解液的水解度/%;X为水解液在275nm波长处的吸光度。
通过本实验的研究发现,在明胶水解液的质量浓度为10-3g/mL时,其水解度与吸光度(A275nm)呈线性相关。因此,可以测定明胶水解液的A275nm值,利用水解度与吸光度的线性关系方程,计算得到明胶水解液的水解度。
目前,测定蛋白质水解度的方法主要有三硝基苯磺酸法(TNBS)、邻苯二甲醛(OPA)法、茚三酮法、甲醛滴定法和pH-Stat法等。甲醛滴定法是国内广泛应用于测定蛋白质水解程度的方法,操作较简单,但脯氨酸与甲醛作用后,生成不稳定化合物,因此采用甲醛滴定法测定富含脯氨酸的原料,其结果偏低[20]。明胶水解液中脯氨酸含量较高,因此甲醛滴定法不适用于测定明胶水解物的水解度。pH-Stat法的优点在于操作简单、快速、可重复性高,通常被用于水解度的连续测定。但这种方法仅适用于中性及碱性(pH>7)或pH<3的酸性溶液中进行的水解,并且需要特别的仪器控制水解过程中的pH值,同时这种方法还需要用其他的方法进行校正,有研究[21]表明pH-Stat法的测定结果偏高。TNBS法测定的结果较准确,但其所用试剂不易获得且测定过程耗时较长,不适于实时监测水解度[22]。OPA法操作简单,可快速测定水解度,但由于其需要采用荧光光度计测定,因此应用受到一定的限制[23]。茚三酮比色法操作简单,测定快速,但是由于不同氨基酸和水合茚三酮显色不同,对测量结果有部分偏差,使测定结果偏低[24]。
本实验对已有的利用紫外分光光度法测定明胶水解度的方法进行了改进,操作简单,结果较准确,可快速测定明胶的水解度,不仅适用于实验室中对明胶水解液水解度的测定,也便于工厂化生产时监控明胶水解度。后续实验均采用此方法测定明胶水解液的水解度。
2.2 碱性蛋白酶水解明胶的最佳条件确定
2.2.1 单因素试验结果
2.2.1.1 酶解温度对碱性蛋白酶水解明胶的影响
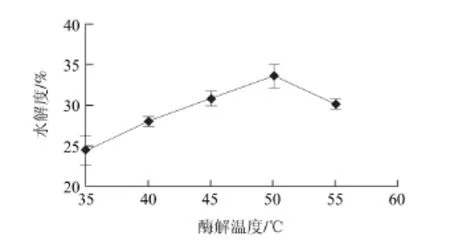
图2 酶解温度对碱性蛋白酶水解明胶的影响Fig.2 Effect of temperature on gelatin hydrolysis by alkaline protease
由图2可知,碱性蛋白酶水解明胶的最适温度为50℃,此时的水解度最高,为33.52%,当酶解温度达到55℃,可能是高温引起碱性蛋白酶失活而使水解度有所降低。
2.2.1.2 pH值对碱性蛋白酶水解明胶的影响

图3 pH值对碱性蛋白酶水解明胶的影响Fig.3 Effect of pH on gelatin hydrolysis by alkaline protease
由图3可知,pH8时碱性蛋白酶对明胶的水解作用较弱,水解度较低,而当pH值达到9.5时,碱性蛋白酶对明胶的水解作用最强。当pH值继续增大时,碱性蛋白酶对明胶的水解作用减弱。
2.2.1.3 酶解时间对碱性蛋白酶水解明胶的影响

图4 酶解时间对碱性蛋白酶水解明胶的影响Fig.4 Effect of time on gelatin hydrolysis by alkaline protease
由图4可知,水解初期(酶解时间为1h),水解度增长缓慢,而在酶解2~4h这段时间,水解度上升较快,因为碱性蛋白酶需要在其最适温度下活化一段时间,酶的活性中心方能被激活,达到其最佳水解效果。当酶解时间为4h时,酶的水解作用最大,此时水解度达到最大值。酶解4h后,因为底物浓度下降,可以与酶活性中心结合的底物减少,水解趋于平衡,水解度基本不增长,此时,继续延长酶解时间对水解效果的影响不大。
2.2.1.4 加酶量对碱性蛋白酶水解明胶的影响

图5 加酶量对碱性蛋白酶水解明胶的影响Fig.5 Effect of enzyme loading on gelatin hydrolysis by alkaline protease
由图5可知,碱性蛋白酶的加入量会影响明胶的水解效果。当加酶量较少时,碱性蛋白酶的水解效果不好;当碱性蛋白酶的加入量为3000U/mL,水解效果最好,此后继续增加加酶量,对水解度的影响不大。
2.2.2 碱性蛋白酶水解明胶的正交试验
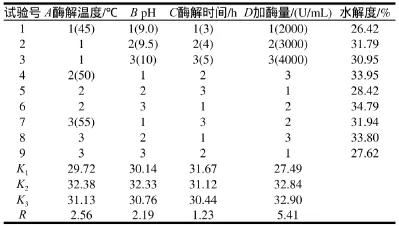
表1 正交试验因素水平、结果及分析TTaabbllee 11 OOrrtthhooggoonnaall aarrrraayy ddeessiiggnn aarrrraannggeemmeenntt aanndd rreessuullttss
在上述单因素试验的基础上,综合考虑各因素作用,以酶解温度、pH值、酶解时间和加酶量为主要因素,以水解度为评价指标,采用四因素三水平正交试验确定碱性蛋白酶的最佳水解条件。正交试验因素水平及试验结果、极差分析见表1。第6组试验得到水解液的水解度最高,即加酶量3000U/mL、酶解温度50℃、pH10.0、酶解时间3h,此时水解度为34.79%。通过极差分析可知,影响碱性蛋白酶对明胶水解效果的主次因素为D>A>B>C,即加酶量>酶解温度>pH值>酶解时间。根据极差分析结果可知碱性蛋白酶水解明胶的最佳工艺条件为A2B2C1D3,即加酶量4000U/mL、酶解温度50℃、pH值为9.5、酶解时间3h,经验证实验可知,此条件下得到水解液的水解度为35.12%,较直观分析第6组试验得到的水解液的水解度高出了0.33%。
在最佳工艺条件制备得到的明胶水解物的氮回收率为65.3%,产率为47.0%,经Sephadex G-25凝胶过滤层析可知水解液的分子质量分布是连续的,其平均分子质量为5500D。实验结果表明,通过以上工艺条件水解制得的明胶水解物的水解度较高,获得的水解物分子质量分布范围较宽,可进一步对其进行分离,获得不同分子质量的组分,以满足不同的应用要求。
3 结 论
3.1 采用改进的紫外分光光度法测定明胶水解度,明胶水解液质量浓度为10-3g/mL时,水解液的吸光度(A275nm)能正确地反映出明胶的水解反应规律,吸光度(A275nm)在0.082~0.708范围内时,吸光度与水解度的线性相关方程为:Y=49.39X-0.443(R2=0.996),通过此方程可根据水解液在275nm波长处的吸光度计算水解度。此方法较传统的水解度测定方法更为简单、快速。
3.2 选用碱性蛋白酶对明胶进行水解,采用单因素试验和正交试验,确定碱性蛋白酶水解明胶的最佳工艺条件。各因素对碱性蛋白酶水解明胶的影响作用不同,其中加酶量对水解度的影响最大,酶解温度和pH值次之,酶解时间对水解度的影响最小。碱性蛋白酶水解明胶的最优工艺条件为加酶量4000U/mL、酶解温度50℃、pH值为9.5、酶解时间3h,此时的水解度达到35.12%。
[1] 李文渊.水解明胶[J].明胶科学与技术, 1981(2): 112-117.
[2] GIMENEZ B, ALEMAN A, MONTERO P, et al.Antioxidant and functional properties of gelatin hydrolysates obtained from skin of sole and squid[J].Food Chemistry, 2009, 114: 976-983.
[3] MENDIS E, RAJAPAKSE N, BYUN H G, et al.Investigation of jumbo squid (Dosidicus gigas) skin gelatin peptides for theirin vitroantioxidant effects[J].Life Science, 2005, 77: 2166-2178.
[4] ZHU B W, ZHOU D Y, LI D M, et al.Free radical scavenging activity of gelatin hydrolysate from puffer fish skin,Takifugu rubripes[J].Journal of Biotechnology, 2008, 136(Suppl 1): 596.
[5] NGO D H, QIAN Z J, RYU B M, et al.in vitroantioxidant activity of a peptide isolated from Nile tilapia (Oreochromis niloticus) scale gelatin in free radical-mediated oxidative systems[J].Journal of Functional Foods, 2010, 2: 107-117.
[6] HIMAYA S W A, NGO D H, RYU B M, et al.An active peptide puri fi ed from gastrointestinal enzyme hydrolysate of Paci fi c cod skin gelatin attenuates angiotensin-1 converting enzyme (ACE) activity and cellular oxidative stress[J].Food Chemistry, 2012, 132: 1872-1882.
[7] ZHAO Y H, LI B F, LIU Z Y, et al.Antihypertensive effect and puri fi cation of an ACE inhibitory peptide from sea cucumber gelatin hydrolysate[J].Process Biochemistry, 2007, 42: 1568-1591.
[8] LIN L, LÜ S, LI B F.AngiotensinⅠconverting enzyme (ACE)-inhibitory and antihypertensiveproperties of squid skin gelatin hydrolysates [J].Food Chemistry, 2012, 131: 225-230.
[9] 田洪磊, 田呈瑞.水解明胶生产的关键点控制[J].食品工业科技,2005(2): 168-169.
[10] 张立萍.酶法生产水解明胶工艺研究[J].化工时刊, 1996, 10(10):16-18.
[11] 刘海英, 李丁, 李双祁, 等.斑点叉尾鮰鱼皮明胶水解方法的研究[J].食品工业科技, 2007(2): 176-178.
[12] NGO D H, RYU B M, VO T S, et al.Free radical scavenging and angiotensin-Ⅰconverting enzyme inhibitory peptides from Pacific cod (Gadus macrocehalus) skin gelatin[J].International Journal of Biological Macromolecules, 2011, 49: 1110-1116.
[13] 林燕, 王鸿飞, 李和声, 等.酶法水解鱿鱼皮制备多肽工艺的研究[J].食品工业科技, 2011(3): 204-207.
[14] LEE S H, QIAN Z J, KIM S K.A novel angiotensin Ⅰ converting enzyme inhibitory peptide from tuna frame protein hydrolysate and its antihypertensive effect in spontaneously hypertensive rats[J].Food Chemistry, 2010, 118: 96-102.
[15] GIMENEZ B, ALEMAN A, MONTERO P, et al.Antioxidant and functional properties of gelatin hydrolysates obtained from skin of sole and squid[J].Food Chemistry, 2009, 114: 976-983.
[16] 林琳, 李八方, 吕顺, 等.鱿鱼皮明胶水解物降血压活性研究[J].中国海洋大学学报, 2010, 40(4): 43-46.
[17] 黄雅钦, 冷延国, 黄明智.明胶水解程度测定方法的探讨[J].明胶科学与技术, 1999, 19(1): 21-28.
[18] 赵新淮, 冯志彪.大豆蛋白水解物水解度测定的研究[J].东北农业大学学报, 1995, 26(2): 178-181.
[19] 赵新淮, 迟玉杰, 张永忠, 等.大豆蛋白水解物中肽分子分布的研究[J].东北农业大学学报, 1996, 27(1): 102-103.
[20] 姚玉静, 崔春, 邱礼平, 等.pH-Stat法和甲醛滴定法测定大豆蛋白水解度准确性比较[J].食品工业科技, 2008(9): 268-270.
[21] CHEISON S C, ZHANG S B, WANG Z, et al.Comparison of a modified spectrophotometric and the pH-Stat methods for determination of degree of hydrolysis of whey proteins hydrolysed in a tangential-flow filter membrane reactor[J].Food Research International, 2009, 42: 91-97.
[22] ADLER-NISSEN J.Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid[J].Journal of Agricultural and Food Chemistry, 1979, 27(6): 1256-1262.
[23] SPELLMAN D, MCEVOY E, O’CUINN G, et al.Proteinase and exopeptidase hydrolysis of whey protein: comparison of the TNBS,OPA and pH stat methods for quanti fi cation of degree of hydrolysis[J].International Dairy Journal, 2003, 13: 447-453.
[24] 徐英操, 刘春红.蛋白质水解度测定方法综述[J].食品研究与开发,2007, 28(7): 173-176.

