西兰花籽中萝卜硫苷的提取、分离及结构鉴定
江 敏,石林娟,杨 毅*
(合肥工业大学 农产品生物化工教育部工程研究中心,安徽 合肥 230009)
硫代葡萄糖苷(glucosinolates,简称硫苷)是广泛存在于十字花科植物中的含硫次级代谢产物[1-4],其种类相当丰富。硫苷及其降解产物具有活跃的生物化学特性,尤其是抗癌活性已受到越来越多国内外学者的关注,并得到广泛的认同[5-7]。硫苷的基本结构见图1。

图1 硫苷的基本结构Fig.1 Chemical structure of glucosinolates
根据侧链R基团的不同,可以将硫苷分为脂肪族、芳香族和吲哚族三类[8]。萝卜硫苷(glucoraphanin)即4-甲基亚磺酰丁基硫代葡萄糖苷(4-methylsufinylbutyl glucosionlate),R基为CH3SO(CH2)4,属于脂肪族硫代葡萄糖苷,其降解产物为异硫代氰酸盐,主要为萝卜硫素[9]。萝卜硫素是迄今为止蔬菜中发现的抗癌活力最强的一类异硫代氰酸盐,它的抗癌作用已在大鼠的乳腺癌中得到充分的证明[10-11]。而现有的大多数萝卜硫素的研究都是从十字花科蔬菜中直接提取萝卜硫素的前体。
目前已报道的硫苷总量分析测试方法已很多[12],单种硫苷的测定方法只有HPLC法和X射线荧光分析法,其中HPLC法经ISO专家和欧洲标准委员会推荐[13]。目前,市面上所售的硫苷纯品只有丙烯基硫苷和苯甲基硫苷,尚无萝卜硫苷。因此,分离纯化萝卜硫苷对于萝卜硫素和其他种类硫苷的研究都具有现实意义。
西兰花种子中萝卜硫苷的含量(20~50mg/g)是成熟植株的60~70倍,是提取萝卜硫苷的较优原料。本实验研究阴离子交换和制备色谱结合的方法,快速有效地分离纯化萝卜硫苷,并对其进行结构鉴定,研究一种从西兰花籽中提取分离萝卜硫苷的实用方法。
1 材料与方法
1.1 材料与试剂
西兰花籽购于鑫雅花卉园艺公司。
甲醇、乙腈(均为色谱纯) 美国Tedia公司;DEAE Sephadex A-25 美国Pharmacia公司;四甲基溴化铵(分析纯) 阿拉丁试剂(上海)有限公司;咪唑(分析纯) 国药集团化学试剂有限公司;甲酸、醋酸钠、硫酸钾(分析纯) 广东汕头市西陇化工厂;实验用水为超纯水,由纯水发生器制得。
1.2 仪器与设备
Waters 高效液相色谱仪(配2487紫外检测器、996二极管阵列检测器) 美国Waters公司;高效液相色谱仪配UV3000B紫外检测器 安徽皖仪科技股份有限公司;API3200质谱仪 美国应用生物系统公司;Nocilet 5700傅里叶红外光谱仪 美国热电公司;Bruker AV400型核磁共振仪 瑞士Bruker Biospin公司;Ultra pure超纯水机上海和泰仪器有限公司。
1.3 方法
1.3.1 提取工艺
参照参考文献[13]的硫苷提取方法并稍作修改。称取西兰花籽10g,于烘箱中100℃灭酶1h。然后研磨粉碎,并在索氏提取器中用正己烷脱脂,室温晾干,制得脱脂西兰花籽备用。
称取脱脂后的西兰花籽2g于离心管中,加入20mL沸甲醇-水溶液(70:30,V/V),75℃水浴10min,其间每隔2min取出离心管在涡旋混合器上涡旋混合,然后取出离心管冷却至室温,5000×g离心3min,取出上清液。再向离心管中加入20mL沸甲醇-水溶液,重复以上操作,合并上清液。取提取液加入到DEAE Sephadex A-25葡聚糖凝胶离子交换柱中,待溶液流干后,用40mL 0.02mol/L醋酸钠溶液洗涤,再用40mL水冲洗。最后用40mL 0.5mol/L硫酸钾溶液洗脱,收集洗脱液,供制备色谱用。
1.3.2 分析型HPLC分离条件
色谱柱:Global Chromatography SP-120-5-C18-AP(4.6mm×200mm,5μm);流动相:乙腈-水(2:98,V/V)含0.1%甲酸;流速:1.0mL/min;检测波长:229nm。
1.3.3 MS检测条件
离子源:电喷雾电离(ESI);离子极性:负离子;毛细管电压:4500V;去簇电压:-20V;针泵流速:5μL/min;扫描离子范围:300~600m/z。
1.3.4 制备色谱分离条件
参照分析型HPLC分离条件,并对流动相进行优化。得到液相色谱分离条件。
色谱柱:Global Chromatography SP-120-5-C18-AP(10mm×250mm,10μm);流动相:乙腈-水(2:98,V/V)含0.1%甲酸;流速:5mL/min;检测波长:229nm。
1.3.5 红外光谱分析条件
样品采用KBr压片法通过Nicolet 5700傅里叶红外光谱仪进行检测。
1.3.6 HPLC-紫外光谱分析条件
样品用纯水溶解,采用Waters 996二极管阵列检测器进行检测。
色谱柱:Global Chromatography SP-120-5-C18-AP(4.6mm×200mm,5μm);流动相:乙腈-水(2:98,V/V)含0.1%甲酸;流速:1.0mL/min;扫描波长范围为190~400nm。
1.3.7 核磁共振氢谱分析条件
样品用CD3OD溶解,采用超导核磁共振仪进行检测。
2 结果与分析
2.1 分析型HPLC分离条件
粗提液在分析型高效液相色谱柱上分离,以乙腈-水体系作为流动相,加入0.1%四甲基溴化铵和甲酸,分离结果类似,色谱峰都得到了很好的分离,图2为流动相中加0.1%甲酸的色谱图。

图2 萝卜硫苷的液相色谱分离图Fig.2 HPLC separation of glucoraphanin extracted from broccoli seeds
2.2 MS鉴定结果
对2.1节中的1~4号峰,按保留时间收集后进行质谱检测。采用负离子模式的ESI-MS分析,结果发现峰2产生离子碎片m/z435[M-],提示其相对分子质量为436,对应萝卜硫苷的相对分子质量,这与Rochfort等[16]的结论相一致,结果见图3。

图3 萝卜硫苷的MMSS图Fig.3 MS spectrum of glucoraphanin
2.3 制备色谱分离条件的选择
粗提取的萝卜硫苷为硫苷钾盐类物质,根据分析型HPLC条件,选择乙腈-水体系作为流动相。四甲基溴化铵作为离子交换剂加入到流动相中能够使硫苷很好的分离,但是其在提纯物中的残留不易除去,所以制备色谱流动相中不宜加入无机盐。而甲酸由于其挥发性,容易分离除去,故选择甲酸作为pH值调节剂,实验表明加入甲酸后分离效果与前者相似,萝卜硫苷有很好的分离效果,分离情况见图4。多次收集萝卜硫苷峰(图4),将收集液减压浓缩后,经冷冻干燥得到萝卜硫苷的提纯物。

图4 萝卜硫苷的液相制备色谱图Fig.4 Preparative HPLC chromatogram of glucoraphanin
2.4 红外光谱测定结果

图5 萝卜硫苷的红外光谱图Fig.5 FTIR spectrum of glucoraphanin
根据红外谱图(图5)分析,3340cm-1处的较强吸收峰对应O—H的伸缩振动;2916cm-1对应饱和C—H伸缩振动;1567cm-1对应C=N的伸缩振动;1110cm-1和1059cm-1对应葡萄糖苷上的C—O伸缩振动;986cm-1对应S=O的伸缩振动;803cm-1对应C—S的伸缩振动。
2.5 HPLC-紫外光谱测定结果
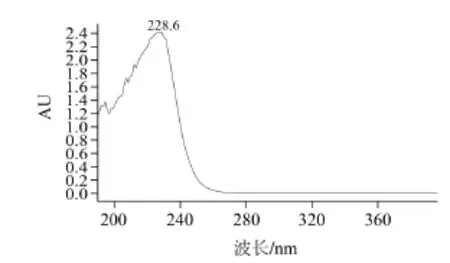
图6 萝卜硫苷的UUVV图Fig.6 UV absorption spectrum of glucoraphanin
在二极管阵列检测器上,样品的液相色谱峰2号峰(萝卜硫苷)的紫外谱图(图6)显示在波长228.6nm处有最大吸收峰,对应了S—C=N在紫外区的特征吸收。
2.6 核磁共振氢谱法
由1H NMR图(图7)可以观察到不活泼氢的氢峰。δ=4.7为H2O峰,δ=3.41-3.82(5H,吡喃环上的H),δ=3.87(2H,-CH2*OD),δ=2.80(2H,-CNCH2*-CH2-),δ=1.89(2H,-CN-CH2-CH2*-),δ=1.91(2H,-CN-CH2-CH2-CH2*-),δ=2.95(2H,-CH2*-SO-CH3),δ=2.71(3H, -CH2-SO-CH3*)。

图7 萝卜硫苷的核磁共振氢谱图Fig.7 1H NMR spectrum of glucoraphanin
上述分析最终确定所得到的硫苷提取物为萝卜硫苷结构,见图8。

图8 萝卜硫苷结构示意图Fig.8 Chemical structure of glucoraphanin
3 结 论
对西兰花籽进行溶剂提取、阴离子交换、液相制备色谱分离纯化后,再采用质谱、红外、紫外检测光谱和核磁共振等方法进行结构鉴定,最终确定产品为萝卜硫苷结构。通过本方法制备的萝卜硫苷对于萝卜硫素和其他种类硫苷的研究具一定参考价值。
[1] 季宇彬, 武晓丹, 邹翔.硫代葡萄糖苷的研究[J].哈尔滨商业大学学报, 2005, 21(5): 550-562.
[2] 段礼新, 陈芳, 蔡光明, 等.天然硫苷化合物的研究进展[J].中草药, 2006, 37(增刊1): 111-114.
[3] 李鲜, 陈昆松, 张明方, 等.十字花科植物中硫代葡萄糖苷的研究进展[J].园艺学报, 2006, 33(3): 675-679.
[4] OLSEN O, SQRENSEN H.Recent advances in the analysis of glucosinolates[J].JAOCS, 1981, 11(10): 865-857.
[5] 申树芳, 张英峰, 马子川.西兰花中硫代葡萄糖苷的抗癌药理[J].化学教学, 2009, 2(7): 19-22.
[6] TALALAY P, ZHANG Y.Chemoprotection against cancer by isothiocyanates and glucosinolate biochem[J].Soc Tran, 1996, 24: 806-810.
[7] 邹翔, 季宇彬, 武晓丹, 等.西兰花中葡萄糖异硫氰酸盐对S180小鼠抗氧化功能的影响[J].中国天然药物, 2007, 5(2): 134-136.
[8] HECHT S S.Chemporevention of cancer by isothiocyanates, modifiers of carcinogen metabolism[J].Journal of Nutrition, 1999, 129: 744-768.
[9] ROSE E A S, HEANEY R K, FENWICK G R, et al.Glucosinolates in crop plants[J].Horticultural Reviews, 1997, 19: 99-215.
[10] WATHELET J P, MARLIER M, SEVERIN M, et al.Measurement of glucosinolates in rapeseeds[J].Natural Toxins, 1995, 3(4): 29-30.
[11] 李志邈, 曹家树.蔬菜的抗癌特性[J].北方园艺, 2001(4): 4-6.
[12] YANG W X.A review of degradation and analysis of glucosinolates in rapeseeds[J].Oil Crops of China, 1983(3): 76-85.
[13] International Organization for Standardization.ISO9167-1: 1992.Rapeseed-determination of glucosinates content.Part 1: methodusing high-performance liquid chromatography[S].Genva: International Organization for Standardization, 1992.
[14] MOGREGOR D I, MULLIN W J, FENWICK G R.Analytical methodology for determining glucosinolate composition and content[J].J Assoc Off Anal Chem, 1983, 66(4): 825-849.
[15] Official Journal of the European Communities.EEC’NO.1864190,O.J.NO.L17037 July 3.Oliseed-determination of glucosinolates by high performance liquid chromatography[J].Fette Scifen Anstrichmittel, 1984, 86: 118-231.
[16] ROCHFORT S, CARIDI D, STINTO M, et al.The isolation and purification of glucoraphanin from broccoli seeds by solid phase extraction and preparative high performance liquid chromatography[J].Journal of Chromatography A, 2006, 46: 205-210.

