膀胱癌中MMP-2及TIMP-2的表达与病理分期和预后的相关性
张金平,孙发林,周大海
膀胱癌在泌尿系肿瘤中发病率最高,其肿瘤的生物学行为比较复杂,病变的发生发展受多种基因的控制和调节。复发是导致膀胱癌患者多次接受手术的主要原因,而转移是导致膀胱癌患者病死的主要原因。如何界定膀胱癌的恶性程度,早期将具有复发和转移潜能的患者筛选出来,给予密切的随访和积极、合理的治疗,有重要意义。近年来认为肿瘤侵袭和转移过程的形成受多个基因调控。基质金属蛋白酶(MMPs)具有降解细胞外基质(EMC)的能力,与肿瘤转移密切相关,金属蛋白酶组织抑制剂(TIMPs)是体内天然存在的MMPs抑制剂。本研究采用免疫组化方法对膀胱癌组织和癌旁组织MMP-2和TIMP-2的表达与病理学分级、分期和预后情况的相关性进行分析,了解其是否能对提高膀胱癌恶性程度的认识、预后的情况预测具有临床价值。
1 资料与方法
1.1 一般资料 40份标本全部来自青岛大学附属医院和解放军第 401医院泌尿外科 2009 ̄01—2010 ̄06行开放手术治疗的膀胱癌患者,另选择正常膀胱黏膜10例作为对照组。40例中膀胱部分切除术32例,膀胱全切除术8例。男28例,女12例;年龄37~76岁,平均60.2岁;第1次发病25例,复发15例。UICC TNM标准病理分期,Tis~T1期22例,T2~T3期18例。WHO分类标准进行病理分级,G1级11例,G2级13例,G3级16例,全部为移行细胞癌。膀胱部分切除术的患者,手术切除范围:包括癌肿及基底部膀胱壁和距离癌缘2 cm的黏膜及膀胱壁[1];术中取癌组织和癌旁2 cm组织各1块;膀胱全切标本在离体5 min内进行取材。标本取材后分别放入10%甲醛液中固定。患者术后常规经尿道膀胱灌注丝裂霉素。术后对12例行膀胱部分切除术患者进行膀胱镜检查1次/3个月,以后进行膀胱镜检查1次/6个月。对8例行膀胱全切术患者术后10个月行盆腔超声检查。
1.2 实验方法 鼠抗人MMP-2单克隆抗体、鼠抗人TIMP-2单克隆抗体、3%H2O2去离子水、EDTA抗原修复液 (pH9.0)、APES、PBS 缓冲液(pH7.4,0.01 mol/L)、免疫组化试剂及染色试剂均购自北京中杉金桥生物技术有限公司。载玻片防脱片剂处理:选择APES,捞片后置烤箱58~60℃ 5 min,以使切片紧密粘附;切片脱蜡;新鲜配制3%双氧水,室温5~10 min以灭活内源性酶;蒸馏水洗3次;pH9.0 EDTA抗原修复液行微波抗原修复。全部标本均常规石蜡包埋、切片及染色。应用免疫组化SP法。一抗选用鼠抗人MMP-2、TIMP-2单克隆抗体,MMP-2、TIMP-2、SP试剂购买自北京中杉金桥生物技术有限公司。 抗体稀释度效价分别为 1∶800、1∶500、1∶100,切片常规脱蜡、水化,pH9.0 EDTA抗原修复液行微波抗原修复。用已知胃癌切片作阳性对照,阴性对照一抗用PBS取代。常规SP技术操作,DAB染色。显微镜观察。以PBS代替一抗作为阴性对照,用已知阳性的胃癌切片作为阳性对照,按上述步骤操作。
1.3 结果判定 ①MMP-2和TIMP-2染色阳性信号均呈棕色定位于细胞胞浆内;判定方法为在镜下观察,根据棕色反应的阳性强度及面积判定结果;②评分标准[2]:MMP-2:无阳性细胞为(-);阳性细胞数≤10%为(+),10%~75%为(++),>75%为(+++);TIMP-2:0分为阴性,1分为局限性 (<0%的肿瘤细胞或间质组织)弱阳性,2分为弥漫性(<10%的肿瘤细胞或间质组织)弱阳性或局限性(>10%的肿瘤细胞或间质组织)强阳性,3分为弥漫性强阳性。
1.4 统计学处理 所有数据输入计算机,用统计软件SPSS11.5处理。不同部位、病理分级、临床分期的蛋白表达的显著性分析均采用χ2检验法,以P<0.05为有显著性差异。
2 结 果
2.1 MMP-2和TIMP-2在正常膀胱黏膜组织及膀胱癌 (BTCC)组织中的表达 10例正常膀胱黏膜MMP-2和 TIMP-2的表达均为阴性,细胞质内无深棕色颗粒。在BTCC组织中MMP-2及TIMP-2的表达详见表1;癌旁组织中MMP-2及TIMP-2的表达详见表2。经过χ2检验证实BTCC组织中MMP-2和TIMP-2的阳性率显著高于癌旁组织(P<0.01)。
2.2 BTCC组织中MMP-2和TIMP-2的表达与BTCC病理分级分期的关系 在BTCC组织中MMP-2和TIMP-2的表达与BTCC病理分级分期的关系详见表1。经过χ2检验证实,MMP-2的阳性表达与临床分期、分级呈正相关(P<0.01);TIMP-2的阳性表达与临床分期、分级无明显相关(P>0.05),见表1。
2.3 癌旁组织中MMP-2和TIMP-2的表达与BTCC病理分级、分期关系 在癌旁组织中MMP-2和TIMP-2的表达与BTCC病理分级、分期关系详见表2。经过χ2检验证实,MMP-2的阳性表达率与临床分期、分级呈正相关(P<0.05);TIMP-2的阳性表达率与临床分期、分级相关性不显著(P>0.05),见表2。
2.4 MMP-2、TIMP-2的表达与膀胱癌1年内及2年内复发的关系 40例患者之中有32例行膀胱部分切除术,对这32例患者术后常规膀胱灌注丝裂霉素化疗,复查膀胱镜1次/3~6个月,结果12例膀胱癌1年内复发,其余28例患者2年内未复发。这12例膀胱癌复发患者的BTCC组织和癌旁组织中MMP-2和 TIMP-2的表达率 91.6%(11/12),33.3%(4/12)与 66.7%(8/12),16.7%(2/12)。 经过 χ2检验证实BTCC组织和癌旁组织中MMP-2的表达率与膀胱癌1年内复发率呈正相关 (P<0.01);BTCC组织和癌旁组织中TIMP-2的表达率与膀胱癌1年内复发率呈负相关(P<0.05)。
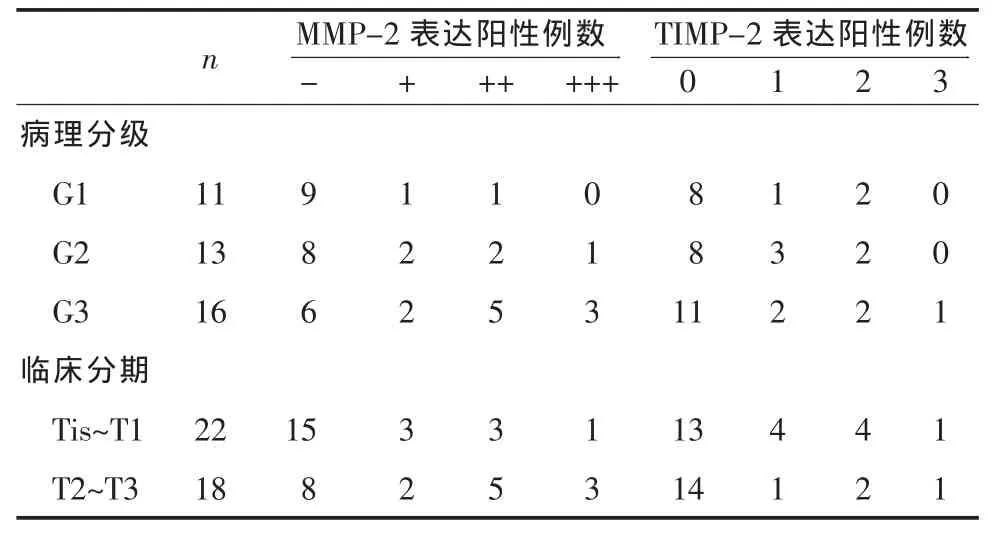
表 1 BTCC组织中MMP-2和TIMP-2的表达与临床分期的关系
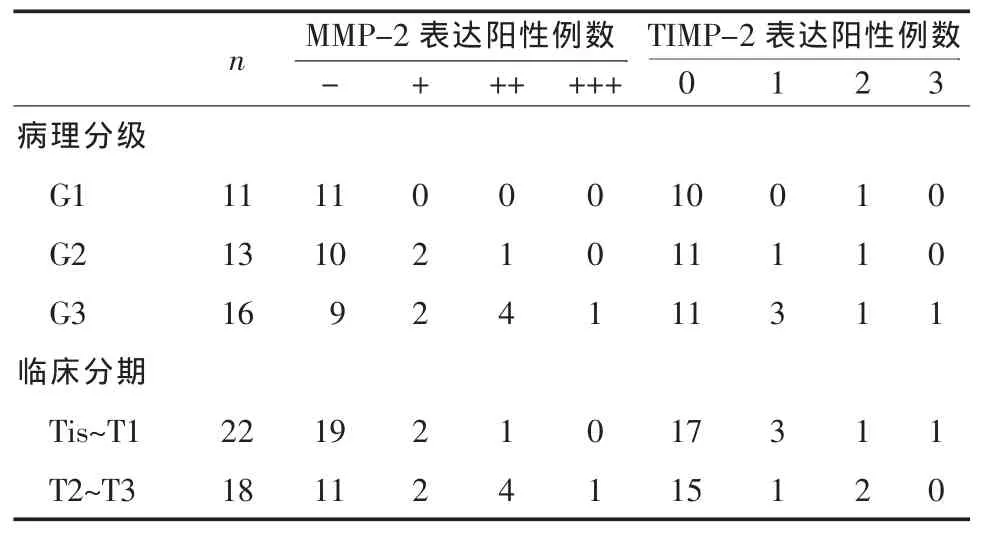
表 2 癌旁组织中MMP-2和TIMP-2的表达与临床分期的关系
3 讨 论
3.1 MMP-2和TIMP-2在恶性肿瘤组织中的表达及意义 肿瘤的侵袭和转移是恶性肿瘤的基本生物学特征,是一个多步骤、多因素参与的极其复杂的过程[3]。肿瘤细胞的浸润和转移必须首先脱离原发灶,黏附在细胞外基质上,尔后降解基质并通过降解的基质进行移动,穿透基底膜进入间质或体液循环而发挥作用[4]。肿瘤细胞从原发瘤脱离后,必须穿透原发瘤周边的ECM,才能进入血管和淋巴管,ECM是阻止肿瘤细胞移动的生理屏障,其完整与否是影响肿瘤转移的关键环节。大量实验证明,瘤细胞穿透基底膜的这种侵袭能力的获得与其产生或诱导产生蛋白酶,降解ECM有关,其中最重要的一组蛋白酶是基质金属蛋白酶(MMPs),它几乎能降解细胞外基质和基底膜的所有成分,对肿瘤的浸润与转移起着极为重要的作用[5]。Ⅳ型胶原酶是MMPs家族中主要成员之一,它分为两个亚型,即MMP-2(72 kD,明胶酶 A)和 MMP-9(92 kD,明胶酶 B)。Ⅳ型胶原是基底膜的主要结构蛋白,MMP-2是Ⅳ型胶原的降解酶,TIMP-2通过与MMP-2形成复合物,从而抑制MMP-2的降解活性。BTCC组织通过高表达MMP-2和(或)低表达TIMP-2,降解Ⅳ型胶原,Ⅳ型胶原降解加快,基底膜破坏,有助于膀胱癌细胞发生浸润和转移。在癌旁组织中MMP-2呈局灶状表达,尤其是在癌巢的边缘或血管的周围染色特别深,这被认为是肿瘤侵袭和转移的前期工作。
Liotta等[6]首先报道了MMP-2在癌细胞转移中的作用,Talvens uari-Matlila等[7]采用免疫组化方法测定177例原发性乳腺癌患者组织样本,发现84%MMP-2阳性,且阳性者生存期明显短于阴性者,在前10年随访中,患者病死危险性明显增加,认为MMP-2阳性为乳腺癌患者低生存率的独立预后因素。国内对乳腺癌患者组织样本研究表明,MMP-2总阳性表达率为68%,有淋巴结转移的30例乳腺癌组织中有24例MMP-2阳性(80%),而无淋巴结转移的30例乳腺癌组织中有17例MMP-2阳性(56.7%),临床分期越晚MMP-2的阳性表达越高,MMP-2可能具有促进乳腺癌细胞发生转移的作用;5年随访结果,MMP-2阳性组生存率明显低于MMP-2阴性组。提示MMP-2可作为乳腺癌不良预后判定指标,且独立应用有意义。
TIMPs是MMPs的特异性抑制剂,目前已知的TIMPs主要有四种:TIMP-1、2、3 和 TIMP-4,TIMP-2对MMP-2活性的抑制特别重要[8]。TIMP-2可与MMP-2 酶原及其活化形式形成 1∶1(mol)稳定复合物,从而抑制MMP-2的产生及其活性,TIMP-2与胶原酶由同一个细胞分泌,因此只有当活化的胶原酶量超过TIMP-2时,才有胶原的水解,MMP-TIMP在维持ECM稳态中起关键作用。TIMPs除了具有抑制MMPs降解活性,保持基底膜完整,另外还有抑制肿瘤新生血管形成的作用[9,10]。
3.2 MMP-2和TIMP-2的表达失衡是癌肿局部侵犯、远处转移及复发的原因之一 基底膜是阻止肿瘤细胞侵袭转移的天然屏障,Ⅳ型胶原是基底膜的主要结构蛋白,MMP-2是Ⅳ型胶原的降解酶,TIMP-2通过与MMP-2形成复合物,从而抑制MMP-2的降解活性。在正常组织中两者是平衡的,共同参与Ⅳ型胶原的代谢调节,维持基底膜的正常结构和生理功能。恶性肿瘤组织通过高表达MMP-2和(或)低表达TIMP-2,降解Ⅳ型胶原,破坏基底膜,从而有助于肿瘤细胞的浸润转移。国内许可慰等[11]研究报道HER-2与MMP-2的表达密切相关,两者在膀胱癌的浸润性生长和转移过程中相互促进。实验结果表明,TIMP-2阳性表达与恶性肿瘤的临床分期、淋巴结转移情况呈负相关,与患者生存率呈正相关,MMP-2和TIMP-2在恶性肿瘤组织中的表达呈负相关,TIMP-2可通过对MMP-2的抑制作用,成为恶性肿瘤细胞转移的阻抑因素。MMP-2和TIMP-2作为分子生物学指标,联合检测能更有效地判定早期恶性肿瘤患者的预后,以便为患者选择更合理的治疗[12,8]。
3.3 癌旁组织癌标的表达与癌复发的关系 癌旁组织易发生不同程度的恶变倾向,是否癌变及癌变的范围大小,不仅与肿瘤的恶性程度有关,亦影响手术方式的选择及治疗后的效果[1]。Igawa[13]通过美蓝对膀胱黏膜进行染色后取组织进行组织病理学检查的结果表明,Ta、T1膀胱癌癌旁组织的组织病理学有恶变倾向的恶变率为21.1%,T2恶变率50.0%,T3恶变率64.7%。浅表性膀胱癌癌旁组织距癌缘2 cm处有癌变及癌前病变占20%左右,其中距癌缘2 cm处原位癌和异型增生各占1/2。浸润性膀胱癌癌旁有癌变及癌前病变高达50%以上,癌变组织距癌缘2 cm以外占20%以上;T2浸润性癌距癌缘2 cm以外接近20%,T3浸润性癌距癌缘2cm以外接近30%;其中癌旁癌变、原位癌和不典型性增生约各占1/3。国内马文香等[14]对26例膀胱癌进行图像分析,主要以癌旁原位癌为主。在行膀胱癌手术时,不仅要考虑肿瘤的浸润深度,更要高度重视手术切除范围;在2 cm处发现恶变,提示在行膀胱部分切除术时要扩大切除范围。对于T3 G3期膀胱移行细胞癌应多以膀胱全切为主,对于分级、分期稍低的膀胱癌若行膀胱部分切除术亦应扩大切除范围才获得较好的预后。
本研究采用免疫组化方法测定膀胱移行细胞癌组织中MMP-2和TIMP-2的表达,并以正常膀胱黏膜组织为对照。结果显示在正常膀胱组织中MMP-2和TIMP-2不表达;而在膀胱癌组织中,两者均呈局灶状或斑片状表达。MMP-2的阳性表达与临床分期、分级呈正相关;TIMP-2的阳性表达与临床分期、分级相关不显著,MMP-2表达普遍高于TIMP-2表达。本组实验证实BTCC组织和癌旁组织中MMP-2的表达率与膀胱癌1年内复发率呈正相关;BTCC组织和癌旁组织中TIMP-2的表达率与膀胱癌1年内复发率呈负相关。MMP-2失去TIMP-2对它的抑制,能够顺利降解Ⅳ型胶原,破坏基底膜,从而有助于肿瘤细胞的浸润转移。MMP-2和TIMP-2两者表达失衡,导致癌细胞周围基底膜降解、为肿瘤侵袭和转移提供了便利条件。MMP-2和TIMP-2的表达失衡也是膀胱癌在膀胱部分切除术后短期内复发的原因之一。
[1]Patrick CW,Alan BR,Thomas AS,et al.Campell’s urology[M]:sixth edition.USA,W.B:Saunders Company Hareourt Brace Jovanovich Inc,1992.2767.
[2]Grignon DJ,Sakr W,Toth M,et al.High levels of tissue inhibitor of metalloproteinase-2(TIMP-2) expression are associated with poor outcome in invasive bladder cancer[J].Cancer Res,1996,56(16):1654-1659.
[3]曾益新.肿瘤学[M].北京:人民卫生出版社,1999.174-176.
[4]Ray JM,Stetler-Stevenson WG.The role of matrix metalloproteinases and their inhibitors in tumor invasion,metastasis and angiogenesis[J].Eur Respir J,1994,7(20):2062.
[5]Bhuvarahamurthy V,Kristiansen GO,Johannsen M,et al.In situ gene expression and localization of metalloproteinases MMP1,MMP2,MMP3,MMP9,and their inhibitors TIMP1 and TIMP2 in human renal cell carcinoma[J].Oncol Rep,2006,15(5):1379-1384.
[6]Liottal A,Tryggvason K,Garbisa S,et al.Metastatic potential correlates with enzymatic degradation of bacement membrane collagen[J].Nature,1980,284(1):67-68.
[7]Talvensasri-Mattila A,Pcakkop P,Hoyhtyam M,et al.Matrix metalloproteinase-2immunoreactive protein.A marker of aggressiveness in breast carcinoma[J].Cancer,1998,83(6):1153.
[8]Ben Davidson,Iris Goldberg,Juri Kopolovic,et al.MMP-2 and TIMP-2 expression correlates with poor prognosis in cervical carcinoma[J].Gynecol Oncol,1999,73(3):372-382.
[9]Gomez DE,Alonso DF,Yoshiji H,et al.Tissue inhibitors of metalloproteinases structure,regulation and biological functions[J].Eur J Cell Biol,1997,74(2):111-122.
[10]Murphy AN,Unsworth EJ,Stetler-Stevenson WG.Tissure inhibitor of metalloproteinase-2 inhibitors bFCF-induced human microvascular endothelial cell proliferation[J].J Cell Physiol,1993,157(3):351-358.
[11]许可慰,李海刚,黄 健,等.HER-2和MMP-2在膀胱移行上皮癌组织中的表达及意义[J].中华肿瘤防治杂志,2007,14(10):769-771.
[12]班丽英,谭小新,乔京京.MMP-2和TIMP-2表达与乳腺浸润性导管癌转移及预后相关性的研究[J].医师进修杂志(外科版),2004,27(6):27-29.
[13]Igawa M.Studies on multiple mucosal biopsy in patients with bladder cancer.Evaluation of the results of multiple methylene blue staining[J].Hinyokika Kiyo,1986,32(11):1617-1631.
[14]马文香,王乃宁,顾方六,等.膀胱癌生物学特性的研究[J].中华泌尿外科学杂志,1989,10(4):217-220.

