B7-H4实时荧光定量PCR检测方法的建立及其在人胃癌组织中的初步应用
王琦,蒋敬庭,魏文祥
B7-H4实时荧光定量PCR检测方法的建立及其在人胃癌组织中的初步应用
王琦,蒋敬庭,魏文祥
215123 苏州大学医学部基础医学与生物科学学院细胞与分子生物学教研室(王琦、魏文祥);213003 常州,苏州大学附属第三医院肿瘤生物诊疗中心(蒋敬庭)
建立实时荧光定量 PCR 检测B7-H4 的方法并初步应用于人胃癌组织。
将 B7-H4 和内参 GAPDH 的 PCR 扩增产物经测序鉴定正确后克隆入载体 pMD19-T,构建重组质粒标准品,并纯化、定量及梯度稀释,分别建立 B7-H4 和 GAPDH 的标准曲线,应用实时荧光定量 PCR 检测 8 例人胃癌组织中的 B7-H4 相对于 GAPDH 的表达情况。
B7-H4 的最低检测拷贝数为 5.27 拷贝,线性范围 5.27 × 101~ 5.27 × 107拷贝,标准曲线方程 y = –3.1395 x + 41.805,直线回归相关系数= 0.994 904,批间变异系数范围 2.39% ~ 3.59%,扩增效率 108.2%;GAPDH 的最低检测拷贝数为 38.6 拷贝,线性范围 3.86 × 102~ 3.86 × 107拷贝,标准曲线方程 y = –3.2436x + 41.083,直线回归相关系数= 0.998 913,批间变异系数范围 2.26% ~ 3.86%,扩增效率 103.4%。8 例人胃癌组织的 B7-H4 相对于 GAPDH mRNA 表达水平在 0.044 ~ 0.888 之间。
荧光定量 PCR 检测 B7-H4 的方法具备较高的敏感性和特异性,且系统有良好的重复性和线性范围。
胃肿瘤; 实时荧光定量 PCR; B7-H4
B7 家族属于提供第二信号的共刺激分子免疫球蛋白超家族,通过向 T 细胞传递协同刺激信号在 T 细胞充分活化和功能发挥中起着重要的作用。目前报道发现的 B7 家族分子共有 7 种,对 B7 家族分子进行系统发育学比较,可将 B7 家族分子分为三组:I 组包括 B7-1(CD80)、B7-2(CD86)和 B7-H2[1-4](B7 homolog 2,又称 GL50、B7h、B7RP-1、ICOS-L);II 组包括 B7-H1[5-6](B7 homolog 1,又称 Programmed death-1 ligand 1 即:PD-L1)和 B7-DC[7](又称 Programmed death-1 ligand 2 即:PD-L2);III 组包括 B7-H3[8](B7 homolog 3)和 B7-H4[9](B7 homolog 4 又称 B7S1 和 B7x)。B7-H4 是 B7 家族中最新发现的成员,其通过抑制细胞因子的产生、细胞周期的进程、T 细胞的增殖分化,负性调控 T 细胞的免疫应答,在多种恶性肿瘤中有异常表达[10-11]。本课题组前期工作通过胃癌组织免疫组化实验发现 B7-H4 在胃癌组织中有表达[12],本研究建立实时荧光定量 PCR 检测 B7-H4 的方法,并在此基础上定量检测胃癌患者癌组织及对应癌旁组织中 B7-H4 的表达水平。
1 材料与方法
1.1 材料
1.1.1 标本来源 2008 年 8 月至 2009 年 3 月在苏州大学附属第三医院胃肠外科接受手术治疗的原发性胃癌患者 8 例,其中男性 6 例,女性2 例,年龄 51 ~ 74 岁,符合 1990 年《中国常见恶性肿瘤诊治规范》原发性胃癌患者诊断标准,临床病理资料完整。胃癌 TNM 分期:II 期 1 例,III 期 2 例,IV 期 5 例;其中有淋巴结转移 7 例,无淋巴结转移 1 例;术前未接受任何放射和化学治疗。手术后在胃癌组织原发灶取病理切片的同时,取癌组织置液氮罐备用。
1.1.2 试剂、引物及探针 Trizol、RT-PCR 和 PCR Master Mix(2 ×)试剂盒购自加拿大 Fermentas 公司;琼脂糖购自西班牙 Biowest 公司;EB 购自上海生工生物工程公司;DNA marker 购自加拿大 Bio Basic 公司;快速胶回收试剂盒购自美国 Invitrogen 公司;pMD19-T 载体连接试剂盒购自日本 Takara 公司;质粒抽提试剂盒购自德国 Qiagen公司;TaqMan PCR 试剂盒购自美国ABI 公司;依据 GenBank 收录的 B7-H4 mRNA 全序列 Homo NM-024626.2 与 GAPDH mRNA 全序列 Homo NM-002046,利用引物设计软件 Primer Premier 5.0 设计引物和 TaqMan 探针,均由上海生工生物工程公司合成。β-actin:上游引物:5' AGC GAG CTA CCC CCA AAG TT 3';下游引物:5' GGG CAC GAA GGC TCA TCA TT 3';扩增片段 285 bp。B7-H4(A):上游引物:5' GTT TTA GGC TTG GTC CAT GAG T 3';下游引物:5' GCC AGC ATC TGT GAG TTG C 3';扩增片段 158 bp。GAPDH:上游引物:5' GGA AGG TGA AGG TCG GAG TC 3';下游引物:5' CGT TCT CAG CCT TGA CGG T 3';TaqMan 探针:FAM-TTT GGT CGT ATT GGG CGC CTG-TAMRA;扩增片段 189 bp。B7-H4(B):上游引物:5' CAC CAG GAT AAC ATC TCT CAG TGA A 3';下游引物:5' TGG CTT GCA GGG TAG AAT GA 3';TaqMan 探针:FAM-AAG CTG AAG ATA ATC CCA TCA GGC AT-TAMRA;扩增片段120 bp。
1.2 方法
1.2.1 RT-PCR 检测 B7-H4 在胃癌组织中的表达 Trizol 法提取在液氮中保存的胃癌组织总 RNA,用 Nanodrop 2000 微量紫外分光光度计检测总 RNA 的浓度和纯度(260/280在 2.00 左右为纯 RNA)。取各组织样总 RNA 2.0 μg 为模板,按照逆转录试剂盒中的操作说明书逆转录 cDNA,以 β-actin 和 B7-H4(A) 引物 PCR,所得 PCR 产物各取 5 μl 进行 2% 琼脂糖凝胶电泳,于凝胶成像仪观察和分析电泳结果。
1.2.2 cDNA 目的片段克隆 将 PCR 产物用快速胶回收试剂盒进行割胶回收,利用 pMD19-T 载体连接试剂盒连接胶回收后的目的 DNA 片段和 pMD19-T 载体,12 ~ 16 ℃保温 8 ~ 16 h。然后将连接产物进行转化实验,涂板培养,37 ℃,12 ~16 h。观察平板挑取 4 ~ 5 个单菌落,分别于 5 ml Amp+LB 培养基中,37 ℃、225 r/min 振荡过夜培养 12 ~ 16 h。
1.2.3 重组质粒鉴定 以培养的 1 μl 菌液为模板,10 μmol/L M13 载体通用上下游引物作为 PCR 引物,进行 PCR。阴性对照为相同的反应体系中不加模板菌液。取 10 μl PCR 产物进行 2% 琼脂糖电泳,观察条带位置是否与设计的插入片段一致。条带位置正确的菌液,用质粒抽提试剂盒分别抽提质粒,取部分测序,blast 比对同源性。
1.2.4 重组质粒浓度测定及标准曲线的建立 经测序正确的重组质粒作为标准品,用 Nanodrop 2000 微量紫外分光光度计检测质粒 DNA 的浓度和纯度(260/280在 1.80 左右为纯 DNA)。将标准品原液调整至 108拷贝/ml,贮于–80 ℃。标准品原液以 10 倍梯度稀释成 107~ 101拷贝/ml7 个数量级的标准品,分别以 B7-H4(B) 和 GAPDH 引物进行实时荧光定量 PCR,各数量级的样品均重复 5 次,根据模板起始拷贝数和对应的临界循环数制作标准曲线得出标准方程。每条标准曲线分别重复 5 次。
1.2.5 胃癌组织中 B7-H4 相对 RNA 水平的检测 各胃癌组织样本提取 RNA,逆转录,利用相同的反应体系和反应条件进行实时荧光定量 PCR,得到对应的 Ct 值,根据建立好的 B7-H4 和 GAPDH 的标准曲线获得 B7-H4 和 GAPDH 的绝对含量,两数值之比即为该胃癌组织中 B7-H4 相对于内参 GAPDH 的 RNA 表达水平。
2 结果
2.1 RT-PCR 检测 B7-H4 在胃癌组织中的表达
结果显示 3 例胃癌组织内参照 β-actin 的表达基本一致,B7-H4 在 3 例胃癌组织中均有表达,但程度不同(图 1)。
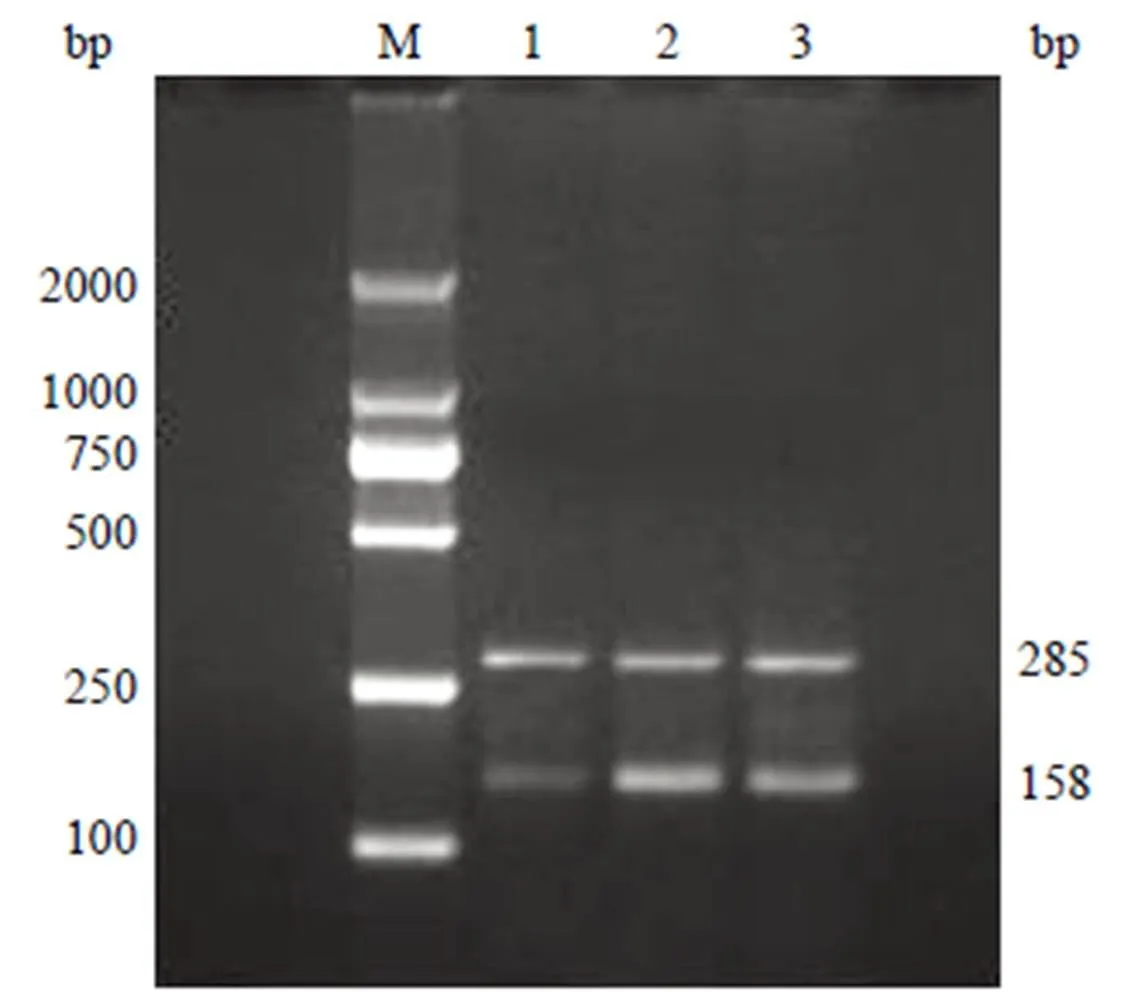
M:DNA 分子量标记;1 ~ 3:B7-H4(A) 和 β-actin 产物大小分别为 158 和 285 bp
Figure 1 Amplified electrophoretogram of B7-H4(A) and β-actin
2.2 重组质粒序列分析
在 ABI3730 全自动测序仪上对提取的重组质粒进行测序。用 Vector NTI advance 10 软件将重组质粒的测序结果和 B7-H4 和 GAPDH 的基因序列进行比对,达到 100% 的符合率。
2.3 标准曲线的建立及线性检测范围
2.3.1 B7-H4 标准曲线的建立及线性检测范围 B7-H4 质粒浓度为 15.554 ng/μl,根据公式[质粒浓度(g/μl)/(660 × 质粒长度bp)]× 6.022 × 1026(拷贝/L),换算出质粒 DNA 浓度为 5.27 × 1012拷贝/L,进行梯度稀释,依次为 5.27 × 107~ 5.27 × 101拷贝/ml。
B7-H4 标准品的扩增曲线(图 2)显示了一组间距相等的平行曲线,107个拷贝数的标准品从第 15 个循环开始出现荧光信号,10 个拷贝数的标准品从第 33 个循环开始出现荧光信号,表明实时定量 PCR 检测基因拷贝数有良好的线性范围。软件进一步分析显示,标准曲线的直线回归相关系数= 0.994 904,所有标准品的值基本在一条直线上,没有任何一个标准品出现大的偏差,表明标准品的制备成功。
B7-H4 标准品实时荧光定量 PCR 标准曲线方程为 y = –3.1395x + 41.805,2= 0.9949。其中x 代表模板量的对数值(LogC0),y 代表 Ct 值。其线性范围可达 7 个数量级,扩增效率 E =(101/3.1395-1)× 100% = 108.2%。
2.3.2 GAPDH 标准曲线的建立及线性检测范围 GAPDH 质粒浓度为 11.383 ng/μl,根据公式[质粒浓度(g/μl)/(660 × 质粒长度bp)] × 6.022 × 1026(拷贝/L)换算出质粒 DNA 浓度为 3.86 × 1012拷贝/L,进行梯度稀释,依次为 3.86 × 107~ 3.86 × 101拷贝/ml。
GAPDH 标准品的扩增曲线(图 3)显示了一组间距相等的平行曲线,107个拷贝数的标准品从第 14 个循环开始出现荧光信号,102个拷贝数的标准品从第 29 个循环开始出现荧光信号,表明实时定量 PCR 检测基因拷贝数有良好的线性范围。软件进一步分析显示,标准曲线的直线回归相关系数= 0.998 913,所有标准品的值基本在一条直线上,没有任何一个标准品出现大的偏差,表明标准品的制备成功。
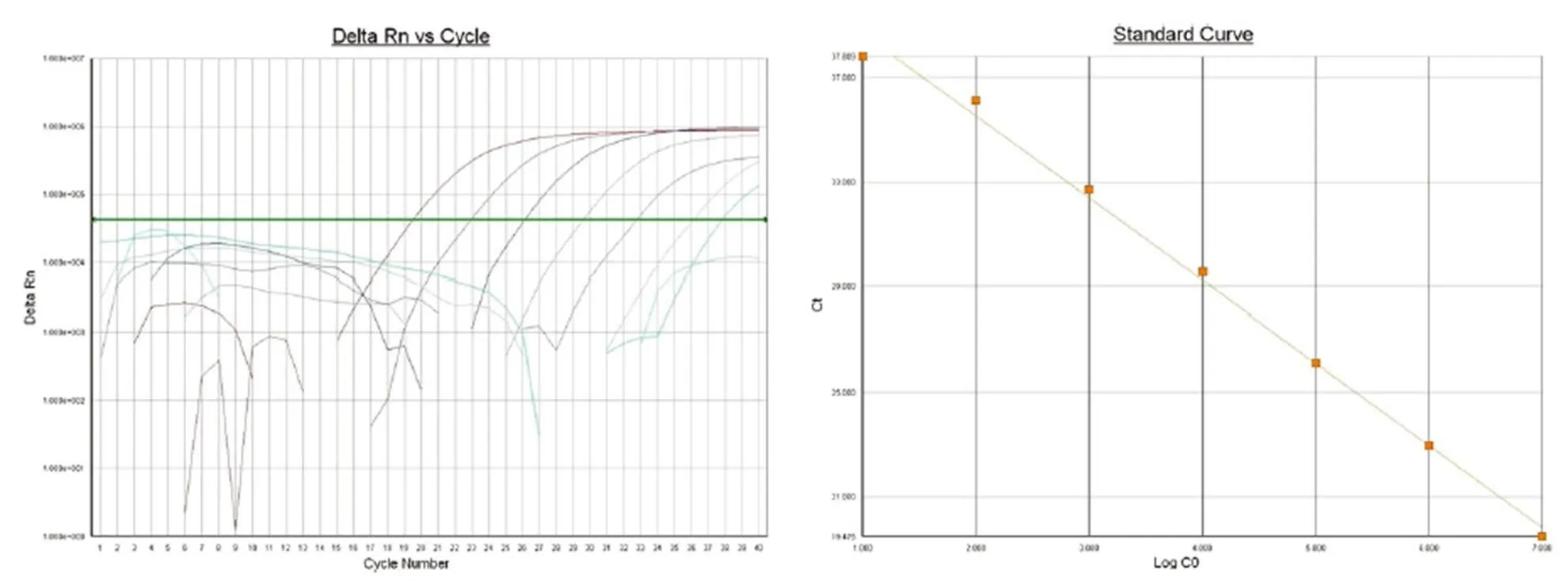
图 2 B7-H4 标准品扩增曲线及标准曲线
Figure 2 B7-H4 amplification curve and standard curve
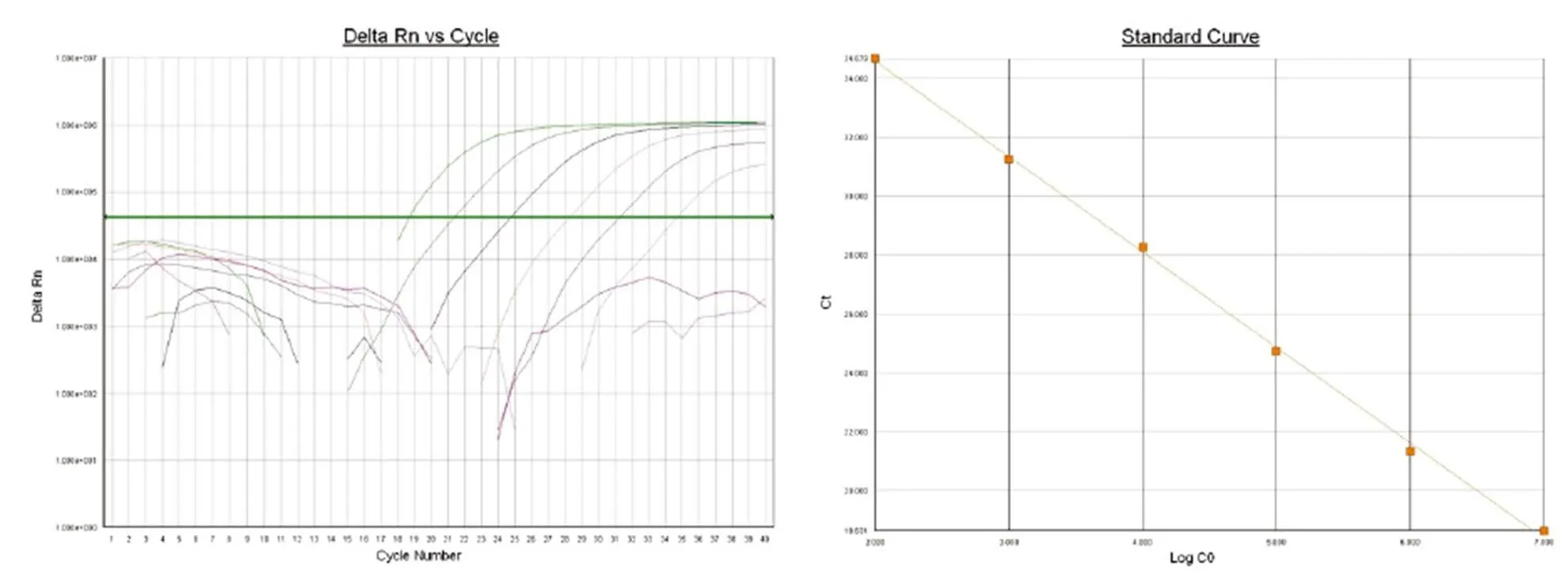
图 3 GAPDH 标准品扩增曲线及标准曲线
Figure 3 GAPDH amplification curve and standard curve
GAPDH 标准品实时荧光定量 PCR 标准曲线方程为 y = –3.2436 x + 41.083,2= 0.9989。其中x 代表模板量的对数值(LogC0),y 代表Ct 值。其线性范围可达 6 个数量级,扩增效率E =(101/3.2436-1)× 100% = 103.4%。
2.4 标准品的重复性和灵敏度
将 B7-H4 质粒标准品 5.27 × 107拷贝/ml 数量级的标准品原液依次进行 10 倍梯度稀释,实时荧光定量 PCR 检测 Ct 值,重复 5 次,变异系数范围在 2.39% ~ 3.59%;将 GAPDH 质粒标准品3.86 × 107拷贝/ml 数量级的标准品原液进行 10 倍梯度稀释,实时荧光定量 PCR 检测 Ct 值,重复5 次,变异系数范围在 2.26% ~ 3.86%(表 1)。
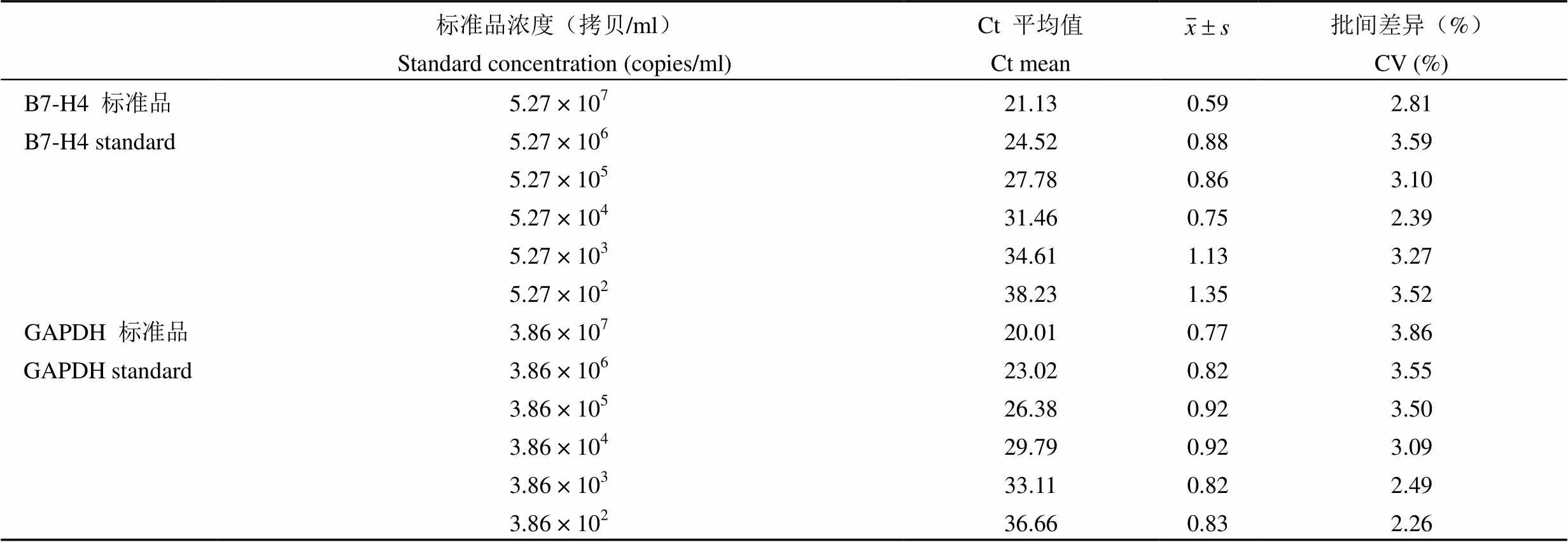
表 1 B7-H4 标准品和 GAPDH 标准品的批间重复性
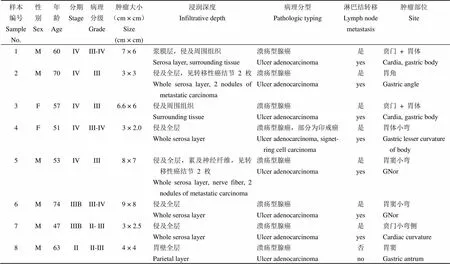
表 2 各胃癌组织标本病例资料
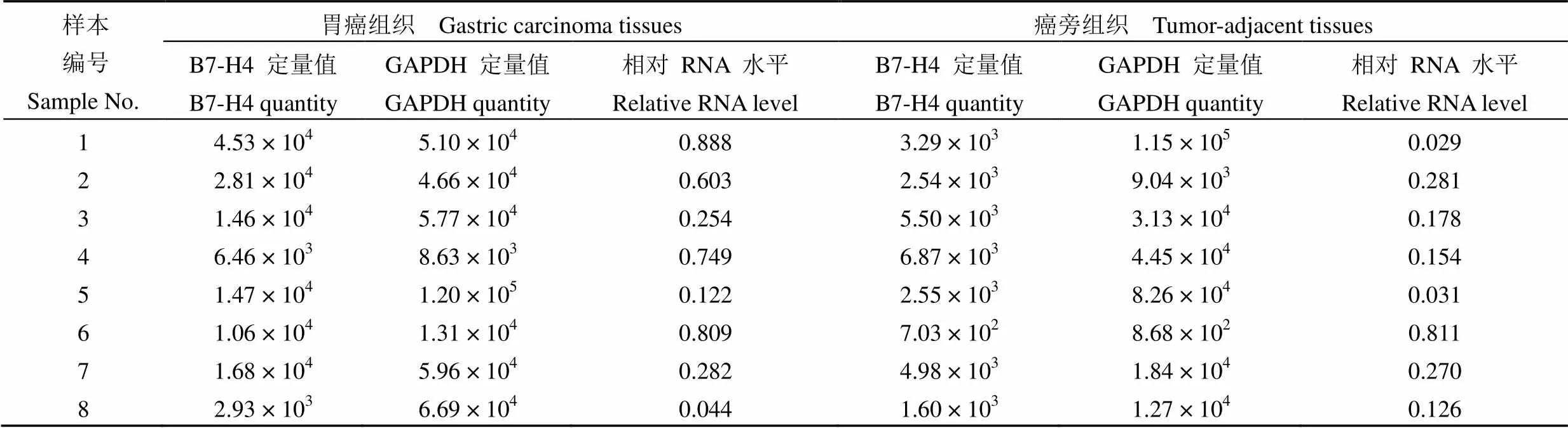
表 3 各胃癌组织及对应癌旁组织 B7-H4 相对 RNA 水平
2.5 胃癌组织中 B7-H4 相对 RNA 水平
8 例胃癌组织标本病例资料(表 2)及根据建立好的 B7-H4 和 GAPDH 的标准曲线获得胃癌组织及其相对应的癌旁组织的 B7-H4 和 GAPDH 的 Quantity值(即定量结果),两数值之比即为该胃癌组织中 B7-H4 相对于 GAPDH 的 RNA 表达水平,范围在 0.044 ~ 0.888 之间(表 3)。
3 讨论
荧光定量 PCR 技术中,应用最广泛的是 TaqMan 探针法,其核心是利用 Taq 酶的 5'-3' 外切核酸酶活性,切断探针,产生荧光信号[13]。探针法相对于染料法来说排除了引物二聚体产生的荧光信号而干扰目的基因实际所产生的总荧光信号强度。实时荧光定量 PCR 中标准曲线法是最为简单、准确的定量方法[14-15],将一系列已知浓度的标准品制成标准曲线,在相同的条件下测得的目的基因荧光信号量同标准曲线进行对比,从而得到目的基因的绝对表达量。标准曲线是以起始拷贝数的对数(LogC0)为横坐标、Ct 值为纵坐标;理论上来说,依次 10 倍稀释的标准品所得的标准曲线,斜率应该在–3.3 左右。实际上当相关系数 > 0.95,斜率在–3.0 ~ –3.9 之间的标准曲线都被认为是可靠的[16]。本研究应用重组质粒 pMD19-T-B7-H4 连续 10 倍稀释后得到的标准曲线为 Ct(B7-H4)= –3.1395 log(DNA 浓度) + 41.805,直线回归相关系数= 0.994904;pMD19-T-GAPDH连续10 倍稀释后得到的标准曲线为 Ct(GAPDH)= –3.2436 log(DNA 浓度) + 41.083,直线回归相关系数= 0.998913,都在公认的可接受范围内。本研究建立的TaqMan 实时荧光定量 PCR 检测 B7-H4 的方法,能够检测低至 5.27 个拷贝的目的基因,并最终产生可高达 7 个数量级(5.27 × 101~ 5.27 × 107)的动态检测范围;GAPDH 的最低拷贝数为 38.6,线性范围为 3.86 × 102~ 3.86 × 107拷贝,B7-H4 和 GAPDH 在各自的范围内,模板浓度与 Ct 之间的相关性均良好。另一个判断实验结果优劣的重要指标是标准曲线的重复性,主要指标之一是 CV(coefficient of variation,变异系数)。TaqMan 实时荧光定量 PCR 检测 B7-H4 和 GAPDH 批间 CV 范围分别在 2.39% ~ 3.59% 和 2.26% ~ 3.86%,均小于 5%,重复性较好。
本研究处理的胃癌组织标本的例数相对较少,检测了 8 例胃癌组织及相应癌旁组织 B7-H4 相对 RNA 水平,最主要的目的在于人协同刺激分子 B7-H4 实时荧光定量 PCR 检测方法的建立,并用建立好的体系检测胃癌组织标本以证明所建立的检测体系是特异的,成功的。关于 B7-H4 mRNA 相对于 GAPDH mRNA 的表达水平与胃癌组织相关指标(如:TNM 分期、淋巴结转移情况、浸润程度等)的关系则有待于检测大批量的胃癌组织标本并进行统计学处理后得出结论。
本研究结果表明 B7-H4 普遍表达于胃癌组织中,且表达强度相对于与管家基因 GAPDH 的范围在0.044 ~ 0.888,相应癌旁组织的表达量普遍低于或与癌组织接近,说明 B7-H4 在胃癌组织中的表达量相对还是比较高的,在胃癌的发生、发展过程中可能起到重要作用,和肿瘤的侵袭也有一定的关系。在乳腺癌中[17],正常的乳腺细胞和恶性的乳腺癌细胞的 B7-H4 表达谱有着很大的差异,过表达 B7-H4 的乳腺癌细胞可以帮助其逃避免疫系统的监测。B7-H4 的 mRNA 和蛋白在人浆液性卵巢癌和乳腺癌[18]中高表达,而在正常组织中低表达或不表达,B7-H4 的蛋白在癌细胞表面广泛糖基化,促进上皮细胞的恶性转化,保护上皮细胞的“失巢凋亡”,在人卵巢癌细胞系中过表达 B7-H4 还可以促进在裸鼠体内的成瘤能力。非小细胞肺癌[19]中高表达的 B7-H4 在有淋巴结转移的病例中普遍存在。同时表达 B7-H4 和 B7-H1 的肾细胞癌患者有着更高的死亡风险,因此可能是肾细胞癌的预后的一个重要的标志物,可以作为肿瘤细胞和肿瘤新生血管的靶标协助肿瘤的免疫治疗[20]。随着对 B7-H4 研究的深入,B7-H4 过表达被认为是胃癌预后差的一个关键因素[21],B7-H4 的激活有可能作为肿瘤的预后因素或者作为肿瘤治疗的靶分子。
[1] Wang S, Zhu G, Chapoval AI, et al. Costimulation of T cells by B7-H2, a B7-like molecule that binds ICOS. Blood, 2000, 96(8):2808-2813.
[2] Ling V, Wu PW, Finnerty HF, et al. Cutting edge: identification of GL50, a novel B7-like protein that functionally binds to ICOS receptor. J Immunol, 2000, 164(4):1653-1657.
[3] Swallow MM, Wallin JJ, Sha WC. B7h, a novel costimulatory homolog of B7.1 and B7.2, is induced by TNFalpha. Immunity, 1999, 11(4):423-432.
[4] Yoshinaga SK, Whoriskey JS, Khare SD, et al. T-cell co-stimulation through B7RP-1 and ICOS. Nature, 1999, 402(6763):827-832.
[5] Dong H, Zhu G, Tamada K, et al. B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion. Nat Med, 1999, 5(12):1365-1369.
[6] Freeman GJ, Long AJ, Iwai Y, et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med, 2000, 192(7):1027-1034.
[7] Latchman Y, Wood CR, Chernova T, et al. PD-L2 is a second ligand for PD-1 and inhibits T cell activation. Nat Immunol, 2001, 2(3): 261-268.
[8] Chapoval AI, Ni J, Lau JS, et al. B7-H3: a costimulatory molecule for T cell activation and IFN-gamma production. Nat Immunol, 2001, 2(3):269-274.
[9] Zang X, Loke P, Kim J, et al. B7x: a widely expressed B7 family member that inhibits T cell activation. Proc Natl Acad Sci U S A, 2003, 100(18):10388-10392.
[10] Li C, Jiang JT, Wu CP. Study progression of costimulatory molecule B7-H4 and tumor microenvironment. Chin Clin Oncol, 2012, 17(5): 466-469. (in Chinese)
李翀, 蒋敬庭, 吴昌平. 协同刺激分子B7-H4与肿瘤微环境的研究进展. 临床肿瘤学杂志, 2012, 17(5):466-469.
[11] Hu WW, Jiang JT, Wu CP. Experssion of B7-H4 and Its Significance in Human Maligant Tumor. Med Recapitulate, 2010, 16(1):52-54. (in Chinese)
胡文蔚, 蒋敬庭, 吴昌平. 协同刺激分子B7-H4在恶性肿瘤中的表达意义. 医学综述, 2010, 16(1):52-54.
[12] Jiang JT, Wu CP, Shen YP, et al. Experssion of costimulatory molecule B7-H4 in the gastric tissues and its correlation with prognosis. Chin
J Exp Surg, 2009, 26(9):1155-1158. (in Chinese)
蒋敬庭, 吴昌平, 沈月平, 等. 共刺激分子B7-H4在胃癌组织中表达及其与预后的关系. 中华实验外科杂志, 2009, 26(9):1155-1158.
[13] Thiery JP. Epithelial-mesenchymal transitions in tumour progression. Nat Rev Cancer, 2002, 2(6):442-454.
[14] Ke LD, Chen Z, Yung WK. A reliability test of standard-based quantitative PCR: exogenous vs endogenous standards. Mol Cell Probes, 2000, 14(2):127-135.
[15] Vandenbroucke II, Vandesompele J, Paepe AD, et al. Quantification of splice variants using real-time PCR. Nucleic Acids Res, 2001, 29(13): E68-E88.
[16] van der Velden VH, Hochhaus A, Cazzaniga G, et al. Detection of minimal residual disease in hematologic malignancies by real-time quantitative PCR: principles, approaches, and laboratory aspects. Leukemia, 2003, 17(6):1013-1034.
[17] Mugler KC, Singh M, Tringler B, et al. B7-h4 expression in a range of breast pathology: correlation with tumor T-cell infiltration. Appl Immunohistochem Mol Morphol, 2007, 15(4):363-370.
[18] Salceda S, Tang T, Kmet M, et al. The immunomodulatory protein B7-H4 is overexpressed in breast and ovarian cancers and promotes epithelial cell transformation. Exp Cell Res, 2005, 306(1):128-141.
[19] Sun Y, Wang Y, Zhao J, et al. B7-H3 and B7-H4 expression in non-small-cell lung cancer. Lung Cancer, 2006, 53(2):143-151.
[20] Krambeck AE, Thompson RH, Dong H, et al. B7-H4 expression in renal cell carcinoma and tumor vasculature: associations with cancer progression and survival. Proc Natl Acad Sci U S A, 2006, 103(27): 10391-10396.
[21] Jiang J, Zhu Y, Wu C, et al. Tumor expression of B7-H4 predicts poor survival of patients suffering from gastric cancer. Cancer Immunol Immunother, 2010, 59(11):1707-1714.
Quantification of B7-H4 with real-time fluorescent PCR and its preliminary application in gastric carcinoma
WANG Qi, JIANG Jing-ting, WEI Wen-xiang
Department of Cell Biology, School of Biology and Basic Medicine Science, Medical College, Soochow University, Suzhou 215123, China (WANG Qi, WEI Wen-xiang); Department of Tumor Biological Treatment, The Third Affiliated Hospitial of Soochow University, Changzhou 213003, China (JIANG Jing-ting)
Toestablish a real-time fluorescent polymerase chain reaction for quantifying B7-H4 and detect the expression of B7-H4 in human gastric carcinoma.
The B7-H4 and internal reference gene GAPDH fragments in correct sequence from RT-PCR were cloned into pMD19-T vector, and recombinant plasmids were purified and quantified by spectrophotometry. Standard curves was established by using a serial dilution of quantified plasmids in order to measure B7-H4 and GAPDH. Real-time fluorescent PCR was used to quantify the expression level of B7-H4 relative to GAPDH in 8 gastric carcinoma tissues.
For B7-H4, the detection of the minimum copy number was 5.27 copies. The linear range of 5.27 × 101~5.27 × 107copies of the standard curve equation (y = -3.1395 x + 41.805) was found and the correlation coefficient for 0.994 904 was obtained. The inter-assay CV ranged from 2.39% to 3.59% and the amplification efficiency was 108.2%. For GAPDH, the detection of the minimum copy number was 38.6 copies. The linear range of 3.86 × 102to 3.86 × 107copies of the standard curve equation (y = –3.2436 x + 41.083) was found and the correlation coefficient of 0.998 913 was obtained. The inter-assay CV ranged from 2.26% to 3.86% and the amplification efficiency was 103.4%. mRNA levels of B7-H4 relative to GAPDH in 8 gastric carcinoma tissues were between 0.044 and 0.888.
The real-time fluorescent quantitative PCR system established for quantifying B7-H4 is rapid, specific, sensitive and accurate. The standard system is repeatable and has a good linear range.
Stomach neoplasms; Real-time fluorescent quantitative polymerase chain reaction; B7-H4
WEI Wen-xiang, Email: wenxiangw@suda.edu.cn
10.3969/cmba.j.issn.1673-713X.2013.02.001
国家自然科学基金(81171653、30972703);江苏省自然科学基金(BK2011246、BK2011247);“六大人才高峰”第六批资金资助项目(BRA2010037);常州市科技支撑计划(社会发展)计划基金(CJ20112020、CZ20110024、CS20102020)
魏文祥,Email:wenxiangw@suda.edu.cn
2012-12-17
——一道江苏高考题的奥秘解读和拓展

