红小豆生物技术研究进展
高义平 董福双 王海波
(1. 河北省农林科学院遗传研究所 植物转基因中心,石家庄 050051;2. 保定市农业科学研究所,保定 071000)
红小豆是豆科(Leguminosae)、豇豆属(Vigna)中的一个栽培种(V.angularis),其籽粒高蛋白、中淀粉、低脂肪,营养丰富,具有食药兼用的价值,随着人们消费水平的提高,越来越受到消费者青睐。早期研究认为红小豆起源于中国。我国红小豆种植历史悠久,种质资源丰富,年种植面积和总产量一直位居世界首位。关于红小豆生物技术的研究和应用,日本起步较早,我国的研究和应用起步晚,基础薄弱,大部分工作还集中在种质资源的分子标记鉴定方面,研究的深度和广度都有待加强。本文是从分子水平和细胞水平上对红小豆生物技术方面的最新研究、应用进展进行了总结,以给红小豆遗传、育种工作者提供参考。
1 红小豆DNA水平的研究
红小豆DNA水平上的研究主要集中在利用分子标记技术对红小豆的起源、传播、进化、种质资源的遗传多样性、不同地域栽培型、半野生型、野生型小豆的变异程度及其相互之间亲缘关系的远近等方面的研究,遗传图谱构建、基因克隆与转化等工作相对较少。
1.1 种质资源鉴评和起源的研究
应用分子标记对小豆种植资源鉴定评价和起源的研究最早始于1993年,Kaga等[1]应用RAPD标记将一个豇豆品种与12个小豆栽培品种区分开,后来Yee等[2]用RAPD和AFLP标记对来自中国、日本、韩国的58个品种进行遗传多样性分析,发现小豆种间遗传多样性丰富,可以保证小豆种内遗传图谱群体的成功构建。之后国内外很多学者相继开展了分子标记技术应用于小豆遗传、育种的基础性研究,尤其是种质资源的遗传多样性研究。
1.1.1 关于小豆起源的研究 瓦维洛夫在《主要作物的世界起源中心》一书中,将中国的中部和西部山区及其比邻的洼地列为小豆的起源中心。随着分子技术的兴起,利用分子标记手段寻求小豆起源、进化的证据成为早期起源研究的课题之一。叶剑等[3]利用SSR引物对来自中国、日本、韩国、不丹、越南5国的104份栽培小豆种质资源的研究表明,中国西南地区的栽培小豆种质存在较丰富的遗传多样性,初步认为我国西南地区可能是小豆的一个起源中心和遗传多样性中心。宗绪晓等[4]用12对AFLP引物对来自6个国家的146份小豆栽培型和野生型种质进行遗传多样性分析,结果认为中国、日本群岛、喜马拉雅山西侧地区,应均为红小豆的起源中心,初步肯定了栽培小豆的多起源中心观点,向中国唯一起源中心说提出质疑。
1.1.2 关于小豆进化的研究 关于栽培小豆的进化来源目前还没有定论。Xu等[5]、金文林等[6]利用RAPD标记研究显示,遗传变异程度由高到低依次为野生小豆、半野生小豆和栽培小豆,小豆的进化是由野生到半野生到栽培型的过程,然而也有研究认为栽培小豆来源于野生小豆,除了二者染色体数目相同、杂交可行外,Xu等[7]、Mimura等[8]进一步用分子标记研究遗传多样性的结果也支持了这一观点。关于半野生小豆的来源Yamaguchi提出了3种假设,一是野生种和栽培种之间的进化产物;二是古老栽培种的退化种;三是栽培种与野生种的杂交衍生物[9]。研究结果的差异可能因研究材料的不同而引起[10]。
1.1.3 关于遗传多样性的研究 宗绪晓等[4]、粟生群等[11]、佘跃辉等[12]分别利用不同的分子标记对我国栽培型小豆种质资源遗传多性进行检测,结果均证明:我国小豆栽培型种质间存在较丰富的遗传多样性;RAPD、AFLP、RAMP等分子标记均可检测到较高的多态性,可以作为小豆遗传图谱构建、种质鉴定和分类以及新品种保护的有效工具。
1.2 遗传图谱构建
小豆的第一张分子标记遗传图谱是1996年由Kaga等[13]利用两个栽培品种的F2家系建立的。2000年,Kaga等[14]用栽培品种和饭豆品种的F2家系建立了一个相对完善的遗传图谱。2005年,Han等[15]以日本地方品种与尼泊尔野生种的BC1F1群体为作图群体,构建了一张中等饱和度的小豆遗传连锁图,这也是迄今为止饱和度最高的小豆连锁图谱。Isemura等[16]和Kaga等[17]再次分别建立了两个遗传图谱,并标记了多个数量性状基因(表1)。
Chaitieng等[18]比较了小豆和豇豆的连锁图谱,研究表明小豆和豇豆分子标记排列顺序高度保守,但在进化过程中两个种之间基因组发生了倒位、插入、缺失、重复和易位现象,第1、2、5连锁群发生倒位,小豆第1连锁群与豇豆第10连锁群部分区域一致,两个物种的SSR等分子标记可以通用。
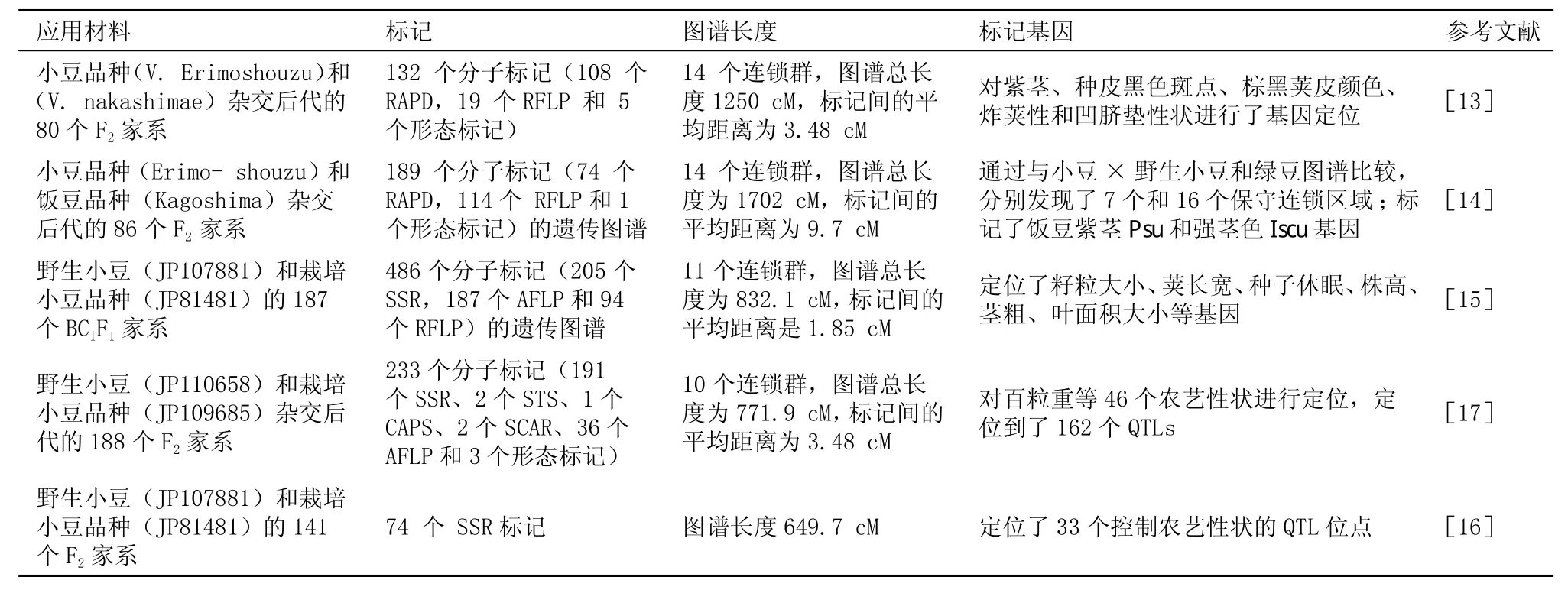
表1 红小豆遗传图谱的构建情况
1.3 基因克隆
小豆基因克隆工作多以其他作物相关基因序列来设计引物进行。Zheng等[19]根据其他作物ABA-Gpase设计兼并引物,从cDNA文库克隆,与诱导ABA-Gpase进行Northernblot杂交,从小豆的幼苗中克隆并鉴定了一个ABA-葡萄糖基转移酶基因。刘燕等[20]根据大豆、豌豆等植物的铁蛋白基因序列设计简并引物,利用RACE延伸技术获得红小豆铁蛋白基因的cDNA 全长序列,将携带该基因的表达载体通过基因枪转化法转入水稻。对转基因水稻叶片的PCR检测和铁含量测定证明,目的片段已经整合到水稻基因组中。陈新等[21]根据豇豆PR基因、四季豆PvPR1、PvPR2基因及绿豆PR10基因的保守区域设计简并引物,以小豆cDNA为模板进行PCR扩增,克隆到了PR类抗病基因VaPR3。Kouichi 等[22]通过对小豆下胚轴在不同处理时间300 G超重力时VaKTN1(剑蛋白基因)转录水平的研究显示,15 min内VaKTN1转录水平增加,45 min时转录水平达到最大值,2 h时这一水平降至正常水平范围。
1.4 遗传转化研究
小豆的遗传转化工作多围绕小豆籽粒的抗豆象工作展开。Yamada等[23]以pSG65T为基因载体、根癌农杆菌EHA105为侵染菌株、卡那霉素为抗性筛选基因、gfp为报告基因,研究了小豆的上胚轴的转化效率,得到了2%的转化率。Chen等[24]利用农杆菌介导法把绿豆品种(Vc6089A)抗豆象基因VrD1转入到当地栽培小豆中,得到了成功表达;Matusim等[25]通过pZHBG质粒携带、农杆菌EHA105介导转化小豆上胚轴,将抗豆象基因转化到日本北海道栽培小豆品种中,经Southern杂交检测到了31个转化植株,转化率14%;Nishizawa等[26]将来源于普通菜豆的α-淀粉酶抑制剂2(αAI-2)基因,通过农杆菌介导转入小豆,Southern杂交结果显示获得了3个整合方式不同的稳定品系。免疫印迹分析显示,αAI-2基因在转基因小豆种子中得到了表达。转基因小豆与普通菜豆具有相同的α-淀粉酶的抑制特异性。通过小豆象鼻虫侵害试验,3个转基因小豆品系具有了极高的抗性水平。
2 红小豆细胞水平的研究
2.1 组织培养、胚拯救及原生质体培养
20世纪80年代是红小豆组织培养研究的密集期。鲁明塾等[27]通过MS+1.0 mg/L ZT+500 mg/L LH诱导愈伤组织培养基、MS+2.0 mg/L 6-BA+1.0 mg/L KT+0.5 mg/L NAA+ 500 mg/L LH诱导愈伤分化成苗培养基、MS+500 mg/L LH诱导幼苗生根培养基将小豆子叶外植体通过愈伤途径再生成苗;许智宏[28]将小豆上胚轴在添加生长素的MS培养基上直接再生成苗;Ozaki[29]将MS培养基上诱导的致密型愈伤在MS+0.2或1.0 mg/L BA的培养基上诱导成苗;金文林[30]用小豆幼根、上胚轴、初生叶、子叶等几种外植体都诱导出了良好的愈伤组织,上胚轴在MS+6-BA培养基上不通过愈伤途径直接再生成苗。
胡英考[31]开展了小豆与饭豆的杂种幼胚胚拯救研究,其中以小豆为母本的11 d以上的幼胚,在MS和MB(MS无机+B5有机)基本培养基、添加1.0 mg/L IAA和0.2 mg/L KT的两种培养基上,获得了13个植株,但幼苗移栽后死亡,没有得到开花结实植株。
小豆原生质体再生植株成功的报道有两例。黄培铭和葛扣鳞[32]将叶肉原生质体愈伤组织分化成苗;Sato等[33]用北海道小豆栽培品种诱导原生质体,再通过原生质体培养诱导成苗,并获得了再生苗的种子。所用的培养基有:MS+2.0 mg 2,4-D固体培养基诱导上胚轴愈伤;同样培养基的液体诱导悬浮细胞系;1%纤维素酶+0.1%果胶酶+1.5%溶解酶+0.4 mol/L甘露糖醇的CPM盐溶液(即将纤维素酶、果胶酶、溶解酶、甘露糖醇全部溶解于CPM盐溶液)破壁获得原生质体;原生质体在MS+1.0 mg /L 2,4-D+1.0 mg/L BAP固体培养基上培养、在MS+1.0 mg/L BAP +0.1 mg/L IAA上诱导出芽成功。
2.2 染色体核型分析
小豆染色体在豇豆属中相对较小,不易观察,细胞遗传学的研究报道较少。郭淑华等[34]选用4个北京地方小豆种质进行了染色体核型分析,确定其染色体数目2n=22,染色体核型为2n=14M+6SM+2Sat,但参试材料间染色体组型无明显差异。金文林等[35]用60Co-γ射线处理小豆风干种子后,对小豆根尖染色体畸变率进行了观察,发现γ射线照射造成小豆根尖染色体桥和断片频率较高。
佘跃辉[36]于2005年应用改良ASG法对12个小豆种质染色体的核型进行了比较分析,并对3个小豆种质染色体进行了G-带带型的初步观察,结果表明,12份小豆种质在染色体形态特征上存在差异,其核型组成上有6种类型,分别为:2n=22=20m+2sm,2n=22=18m+4sm,2n=22=16m+6sm,2n=22=16m+6sm(2Sat),2n=22=14m+8sm,2n=22=14m+8sm(2Sat),核型类型上分为1A和2A两种类型。G-带带型分析表明,同源染色体的带纹数目、分布位置、染色深浅基本一致,可以较准确地进行染色体配对;非同源染色体的带型有明显差异,可以准确区分。不同种质间在G-带带型上存在多态性,反映了小豆各种质之间在遗传结构上的差异,揭示出小豆种在染色体结构上存在着多样性。
3 小结
在细胞水平上,首先,虽然前人有过成功的愈伤组织、原生质体再生成苗经验[27,33],但目前国际上仍没有一种快速获得组培苗材料的方法,愈伤组织再生成苗、原生质体再生成苗等技术还不成熟。把一个品种通过组培途径再生成苗需要几个月甚至1-2年的摸索,而且遇到难培养类型还往往不能成功。这使得小豆的转基因技术应用受到很大限制;其次,远缘杂交虽可为育种创造巨大的增产及抗病潜力,但胚拯救、原生质体融合等技术在小豆上仍是一道难关,这使得远缘杂交在育种上的应用也受到很大限制。
在分子水平上,还没有足够多的引物用于品种鉴定、基因克隆和分子标记辅助育种。目前应用于小豆研究的分子标记主要是RAPD和AFLP,而有关小豆SSR标记目前报道的只有几十对引物[37,38]。
小豆生物技术研究有很多工作,但急需的是以应用基础研究为主,加强细胞水平、分子水平的研究,即建立远缘杂交的支撑技术体系,建立细胞培养的再生技术体系;开发育种需求高的与抗性、适应性、品质等性状紧密连锁的分子标记;标记控制小豆重要农艺性状的基因;构建高密度的小豆分子连锁图谱,从而通过远缘杂交、遗传转化和MAS等手段使小豆的育种和遗传学研究能上一个新台阶。另外,从事小豆基础研究和育种的机构和人员相对较少,因此开展国际交流与合作十分必要。若此,将会对小豆的基础和应用研究以及在世界上更大范围生产起到很大作用。
[1] Kaga A, Hosaka K, Kimura T, et al. Application of random amplified polymorphic DNA(RAPD)analysis for adzuki bean and its related genera[R] . Science Reports of Faculty of Agriculture, Kobe University, 1993, 20(2):171-176.
[2] Yee E, Kidwell KK, Sills GR, et al. Diversity among selected vigna angularis(Azuki)accessions on the basis of RAPD and AFLP markers[J] . Crop Science, 1999, 39(1):268-275.
[3] 叶剑, 赵波, 佟星, 等. 栽培小豆种质资源遗传多样性SSR标记分析[J] . 北京农学院学报, 2008, 23(1):8-13.
[4] 宗绪晓, Vaughan D, Tomooka N, 等. AFLP 初析小豆栽培和野生变种(Vigna angularis and var. nipponensis)间演化与地理分布关系[J] . 中国农业科学, 2003, 36(4):367-374.
[5] Xu RQ, Tomooka N, Vaughan DA, et al. TheVigna angulariscomplex:Genetic variation and relationships revealed by RAPD analysis,and their implications forin situconservation and domestication[ J ] .Genet Resour Crop Evol, 2000, 47:123-134.
[6] 金文林, 文自翔, 濮绍京, 等. 应用RAPD 标记检测小豆种质资源的遗传多样性初探[J] . 作物学报, 2004, 30(6):590-595.
[7] Xu RQ, Tomooka N, Vaughan DA, et al. Plant genetic resources:AFLP markers for characterizing the adzuki bean complex [J] .Crop Science, 2000, 40(3):808- 815.
[8] Mimura M, Yasuda K, Yamaguchi H. RAPD variation in wild, weedy and cultivated azuki beans in Asia [J] .Genetic Resources and Crop Evolution, 2000, 47:603-610.
[9] Yamaguchi H. Wild and weed azuki beans in Japan [ J ] . Econ Bot,1992, 46(4):384-394.
[10] Yoon MS, Lee J, Kim CY, et al. Genetic relationships among cultivated and WildVigna angularis(Willd.)Ohwi et ohashiand relatives from Korea based on AFLP markers[J] . Genetic Resources and Crop Evolution, 2007, 54(4):875-883.
[11] 粟生群, 荣廷昭, 佘跃辉, 等. 利用 AFLP 标记鉴定小豆栽培型种质遗传多样性[J] . 四川农业大学学报, 2005, 23(2):156-162.
[12] 佘跃辉, 荣廷昭, 粟生群, 等. 应用RAMP分子标记分析小豆栽培型种质资源遗传多样性[J] . 作物学报, 2006, 32(2):217-222.
[13] Kaga A, Ohnishi M, Ishii T, et al. A genetic linkage map of azuki bean constructed with molecular and morphological markers using an interspecific population(Vigna angularis V. nakashimae)[J] .Theoretical and Applied Genetics, 1996, 93(5):658- 663.
[14] Kaga A, Ishii T, Tsukimoto K, et al. Comparative molecular mappinginCeratotropisspecies using an interspecific cross between azuki bean(Vigna angularis)and rice bean(V. umbellata)[J] .Theoretical and Applied Genetics, 2000, 100(2):207-213.
[15] Han OK, Kaga A, Isemura T, et al. A Genetic linkage map for azuki bean(Vigna angularis(Willd.)Ohwi & Ohashi)[J] . Theoretical and Applied Genetics, 2005, 111(7):1278-1287.
[16] Isemura T, Kaga A, Konishi S, et al. Genome dissection of traits related to domestication in azuki bean(Vigna angularis)and comparison with other warm season legumes [J] . Annals of Botany,2007, 100(5):1053-1071.
[17] Kaga A, Isemura T, Tomooka N, et al. The genetics of domestication of the azuki bean(Vigna angularis)[J] . Genetics, 2008, 178(2):1013-1036.
[18] Chaitieng B, Kaga A, Tomooka N, et al. Development of a black gram(Vigna mungo(L.)hepper)linkage map and its comparison with an azuki bean(Vigna angularis(Willd.)Ohwi and Ohashi)linkage map. [J] Theor Appl Genet, 2006, 113(7):1261-1269.
[19] Zheng JX, Masatoshi N, Yoshihito S, et al. Cloning and characterization of the abscisic acid-specific glucosyltransferase gene from adzuki bean seedlings[J] . Plant Physiology, 2002, 129(3):1285-1295.
[20] 刘燕. 红小豆铁蛋白基因的克隆及在水稻中的转化[D] . 北京:中国农业大学, 2005.
[21] 陈新, 陈华涛, 袁星星, 等. 小豆抗病相关基因 VaPR3 的克隆与表达分析[J] . 江苏农业学报, 2009, 25(5):1068 -1073.
[22] Soga K, Kotake T, Wakabayashi K, et al. The transcript level of katanin gene is increased transiently in response to changes in gravitational conditions in azuki bean epicotyls [J] . Biological Sciences in Space, 2009, 23(1):23-28.
[23] Yamada T, Teraishi M, Hattori K, et al. Transformation of azuki bean byAgrobacterium tumefaciens[J] . Plant Cell Tissue Organ Cult, 2001, 64(1):47-54.
[24] Chen GH, Hsu MP, Tan CH, et al. Cloning and characterization of a plant defense VrD1 from azuki bean[J] . Journal of Agricultural and Food Chemistry, 2005, 53(4):982-988.
[25] Khalafalla MM, El-Shemy HA, Mizanur RS, et al. Recovery of herbicide-resistant azuki bean(Vigna angularis(Wild.), Ohwi& Ohashi)plants viaAgrobacterium-mediated transformation [J] .African Journal of Biotechnology, 2005, 4(1):61-67
[26] Nishizawa K, Teraishi M, Utsumi S, et al. Assessment of the importance of α-amylase inhibitor in bruchid resistance of wild common bean[J] . Theoretical and Applied Genetics, 2007, 114(4):56-62.
[27] 鲁明塾, 葛扣鳞, 杨金水. 赤豆子叶愈伤组织的诱导和植株再生[J] . 上海农业学报, 1985(4):35-38.
[28] 许智宏, 杨丽君, 卫志明, 等. 四种豆科植物组织培养中植株再生[J] . 实验生物学报, 1984(4):483-486.
[29] Ozaki K. Plant regeneration from epicotyl culture of azuki bean(Vigna angularisOhwi & Ohashi). 植物组织培养, 1985, 2(2):59-62
[30] 金文林, 蓬原雄三. 小豆外植体的愈伤组织诱导及直接植物体再分化[J] . 北京农学院学报, 1993, 8(1):95-99.
[31] 胡英考. 小豆的种子蛋白变异给予饭豆可杂交性研究[D] .北京:中国农科院研究生院, 1995:27-29.
[32] 黄培铭, 葛扣鳞. 赤豆叶肉原生质体愈伤组织再生植株[J] .上海农业学报, 1989(1):31-36.
[33] Sato T, Asaka D, Harada T, et al. Plant regeneration from protoplasts of azuki bean[J] . Japanese Journal of Breeding. 1993, 43(2):183-190.
[34] 郭淑华, 金文林. 小豆(Vigna angularis)染色体组型分析的研究[J] . 北京农业科学, 1988(2):19-22.
[35] 金文林, 吕志军, 金弘, 等.60Co-γ射线不同剂量处理小豆种子的细胞遗传学效应[J] .北京农学院学报, 1996, 11(1):28-33.
[36] 佘跃辉. 小豆种质资源研究[D] . 四川:四川农业大学,2005.
[37] Wang XW, Kaga A, Tomooka N, et al. The development of SSR mar-kers by a new method in plants and their application to gene flow studies in azuki bean [Vigna angularis(Willd.)Ohwi &Ohashi] [J] . Theor Appl Genet, 2004, 109:352-360.
[38] 王丽侠, 程须珍, 王素华. 基于SSR标记分析小豆及其近缘植物的遗传关系[J] . 生物多样性, 2011, 19(1):17-23.

