根际浇灌ABA对冬小麦幼苗抗寒性的影响
苍 晶,王艳梅,王 兴,于 晶,王军虹,张 达,孙兆猛,樊立华
(东北农业大学生命科学学院,哈尔滨 150030)
植物生长在不同地域气候条件下,常因环境不利而受伤害。据统计,环境胁迫导致作物减产可达50%~80%[1]。低温是影响我国北方地区农作物产量提高的重要限制因素之一[2]。随着外源激素对植物抗逆性影响的深入研究,为植物抗逆激素诱导技术提供了理论基础。利用外源ABA处理研究植物抗逆性是一种行之有效的方法[3]。在正常情况下外施ABA可造成类似逆境的胁迫,而胁迫条件下外施ABA则可提高植物自身的防御机制。目前,关于外源ABA对抗寒性的研究在玉米[4]、高羊茅[5]、 云 杉[6]、 冬 小 麦[7]、 水 稻[8]、 番 茄[3]、 香 蕉[9]、茶树[10]、荔枝[11]、仁用杏[12]等植物上均有相关报道,但多以零上低温冷胁迫为主。
本研究以不同浓度ABA处理两种不同抗寒性的冬小麦幼苗,探讨高寒地区大田自然降温条件下ABA调控冬小麦耐受低温胁迫的生理生化机制,为寒地冬小麦栽培生产及抗寒品种选育提供科学依据。
1 材料与方法
1.1 材料
强抗寒冬小麦品种“东农冬麦1号”(在黑龙江省高寒地区返青率>85%)和弱抗寒冬小麦品种“济麦22”(在黑龙江省高寒地区返青率<2%),均由东北农业大学农学院小麦研究所提供。
1.2 方法
于2008年9月12日播种于东北农业大学香坊农场实验实习基地(东经126°22′~126°50′,北纬45°34′~45°46′),小区种植,区组试验。行长4 m,播深5 cm,株距1 cm,每行苗数约400株,坐水种植,大田常规施肥。当冬小麦长至三叶期时,分别用 0、0.1、1、10、100 μmol·L-1的 ABA在三叶期进行根际浇灌,田间自然降温条件下,分别于日最低温度达到0、-10和-25℃时取叶片和分蘖节,分装后置-80℃冰箱备用。
生理生化指标测定:采用DNS比色法测定可溶性糖含量、考马斯亮蓝G-250法测定可溶性蛋白含量、硫代巴比妥酸比色法测定丙二醛(Malonaldehyde,MDA)含量、氮蓝四唑法测定超氧化物岐化酶(Superoxide dismutase,SOD)活性、电导法测定细胞膜透性[13]。翌年,调查冬小麦返青率。
采用酶联免疫吸附(ELISA)法测定内源激素ABA和GA含量[14-15]。试剂盒由中国农业大学化控研究室提供。
根据试剂盒要求得ABA标准曲线:
y=-0.9598x+3.0201(R2=0.9985);
GA标准曲线:y=-1.923x+11.16(R2=0.9951)。
1.3 数据分析
采用DPS 7.05和Excel 2003进行数据统计与分析。
2 结果与分析
2.1 外源ABA对冬小麦膜脂过氧化的影响
2.1.1 外源ABA对冬小麦相对电导率的影响
细胞质膜是一种半透性膜,遭受低温胁迫后植物细胞质膜透性变大,电解质渗出率增大。因此,相对电导率常被用作衡量植物抗寒力强弱的生理指标。由图1可知,相同浓度ABA处理下,随着温度的降低,两种冬小麦叶片和分蘖节的相对电导率显著增加,且东农冬麦1号分蘖节和叶片的相对电导率始终低于济麦22,说明东农冬麦1号对低温适应能力强于济麦22。100 μmol·L-1ABA明显增加两种冬小麦叶片和分蘖节的相对电导率。10 μmol·L-1ABA显著降低东农冬麦1号叶片和分蘖节的相对电导率,而对济麦22影响不显著。0.1、1 μmol·L-1ABA对两种冬小麦的相对电导率无显著影响。
2.1.2 外源ABA对冬小麦SOD活性的影响
由图2可知,相同浓度ABA处理下,随着温度的降低,两种冬小麦分蘖节和叶片的SOD活性均逐渐增加。100 μmol·L-1ABA显著降低两种冬小麦叶片和分蘖节的SOD活性,高浓度ABA对冬小麦自身酶保护系统有破坏作用。10 μmol·L-1ABA处理显著增加东农冬麦1号叶片和分蘖节的SOD活性,而对济麦22影响不显著,表明不同抗寒性品种中SOD活性对外源ABA的敏感度有差异。0.1和1 μmol·L-1ABA处理对两种冬小麦品种的叶片和分蘖节SOD活性变化影响不显著。
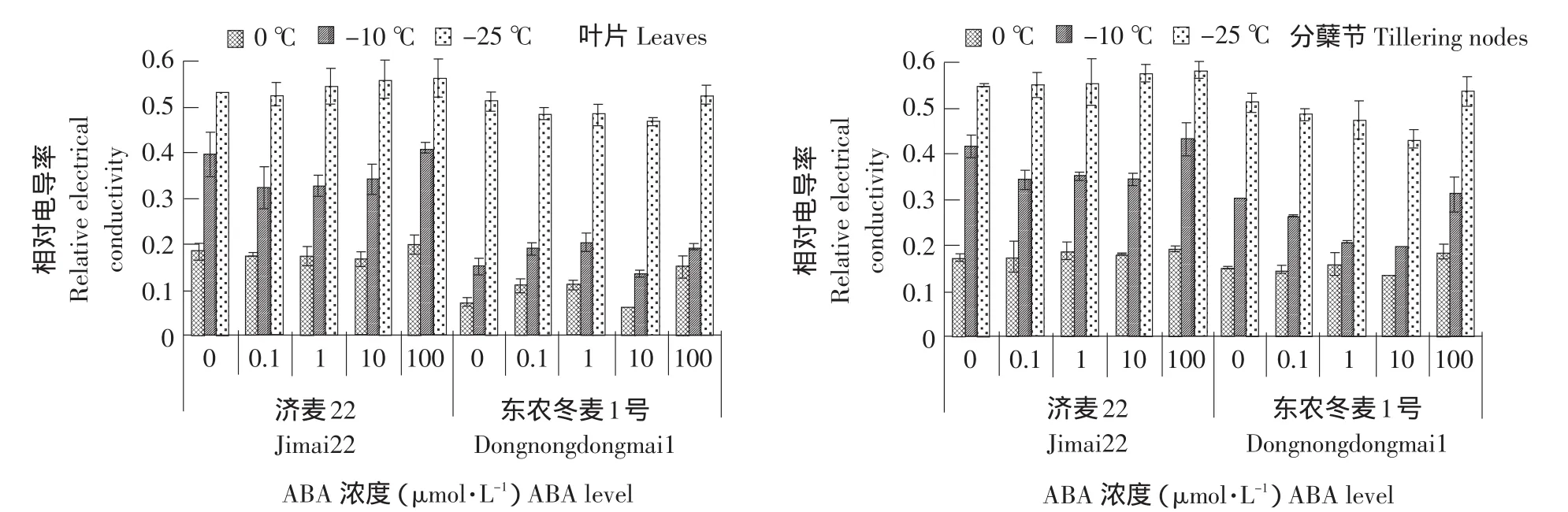
图1 外源ABA处理对冬小麦叶片和分蘖节相对电导率的影响Fig.1 Effect of exogenous ABA on relative electrial conductivity in the leaves and tillering nodes of winter wheat

图2 外源ABA处理对冬小麦叶片和分蘖节SOD活性的影响Fig.2 Effect of exogenous ABA on SOD activity in the leaves and tillering nodes of winter wheat
2.1.3 外源ABA对冬小麦MDA含量的影响
由图3可知,随着温度的降低,两种冬小麦分蘖节和叶片MDA含量逐渐积累,当温度达到-25℃时其含量达到最大值,济麦22叶片和分蘖节中MDA 含量明显高于东农冬麦 1号。100 μmol·L-1ABA增加两种冬小麦叶片和分蘖节中MDA含量,即高浓度ABA加强细胞的膜质过氧化,不利于抵抗低温。10 μmol·L-1ABA显著降低东农冬麦1号叶片和分蘖节中MDA含量,而对济麦22无显著影响。0.1和1 μmol·L-1ABA对两种冬小麦叶片和分蘖节的MDA含量变化影响不显著。
2.2 外源ABA对冬小麦渗透调节物质含量的影响
2.2.1 外源ABA对冬小麦可溶性糖含量的影响
由图4可知,两种冬小麦可溶性糖含量随着温度的降低逐渐增加,其中东农冬麦1号积累的可溶性糖更多,且叶片中可溶性糖含量高于分蘖节。经0.1、1和10 μmol·L-1ABA根际浇灌的东农冬麦1号叶片和分蘖节中可溶性糖含量都有不同程度增加,其中10 μmol·L-1ABA处理最明显,分别比未处理的东农冬麦1号叶片和分蘖节增加15.6%和10.7%。100 μmol·L-1ABA处理显著降低两种小麦叶片和分蘖节中可溶性糖含量,即高浓度ABA抑制可溶性糖的积累。0.1 μmol·L-1ABA增加济麦22叶片和分蘖节中可溶性糖含量,其他浓度ABA处理都不同程度降低可溶性糖含量。
2.2.2 外源ABA对冬小麦可溶性蛋白含量的影响
由图5可知,在田间自然降温过程中,两种冬小麦可溶性蛋白含量逐渐积累,且叶片的含量高于分蘖节。100 μmol·L-1ABA显著降低两种冬小麦叶片和分蘖节可溶性蛋白含量。10 μmol·L-1ABA明显增加东农冬麦1号叶片和分蘖节可溶性蛋白含量,对济麦 22 则无显著影响。0.1 和 1 μmol·L-1ABA对两种冬小麦叶片和分蘖节中可溶性蛋白含量无显著影响。

图3 外源ABA处理对冬小麦叶片和分蘖节MDA含量的影响Fig.3 Effect of exogenous ABA on MDA content in the leaves and tillering nodes of winter wheat

图4 外源ABA处理对冬小麦叶片和分蘖节可溶性糖含量的影响Fig.4 Effect of exogenous ABA on soluble sugar content in the leaves and tillering nodes of winter wheat
2.3 外源ABA对冬小麦内源激素含量的影响
2.3.1 外源ABA对冬小麦内源ABA含量的影响
由图6可知,两种冬小麦内源ABA含量随着温度的降低先增后减(东农冬麦1号分蘖节始终增加),且东农冬麦1号内源ABA含量始终高于济麦22。100 μmol·L-1ABA降低两种冬小麦叶片和分蘖节中ABA含量。0.1、1、10 μmol·L-1ABA增加东农冬麦1号叶片和分蘖节中ABA含量,而对济麦22叶片和分蘖节无显著影响。

图6 外源ABA处理对冬小麦叶片和分蘖节内源ABA含量的影响Fig.6 Effect of exogenous ABA on endogeny ABA in the leaves and tillering nodes of winter wheat
2.3.2 外源ABA对冬小麦内源GA含量的影响
由图7可知,东农冬麦1号叶片和分蘖节中GA含量低于济麦22。100 μmol·L-1ABA增加济麦22叶片中GA含量,而对东农冬麦1号叶片和分蘖节及济麦 22 分蘖节无影响。0.1、1、10 μmol·L-1ABA降低东农冬麦1号叶片和分蘖节中GA含量,对济麦22叶片和分蘖节中GA含量无显著影响。

图7 外源ABA处理对冬小麦叶片和分蘖节内源GA含量的影响Fig.7 Effect of exogenous ABA on endogeny GA in the leaves and tillering nodes of winter wheat
2.3.3 外源ABA对冬小麦内源ABA/GA值的影响
植物抗寒性的提高并非某一类激素的作用,而是几种激素相互协调作用的结果。相对于ABA和GA的绝对含量,ABA/GA更能体现与抗寒力的关系。由图8可知,在田间自然降温过程中,东农冬麦1号叶片和分蘖节中ABA/GA值均高于济麦22。100 μmol·L-1ABA降低两种冬小麦叶片和分蘖节中ABA/GA值,因此对抗寒性的提高具有一定抑制作用。0.1、1、10 μmol·L-1ABA增加东农冬麦1号叶片和分蘖节中ABA/GA值,对济麦22叶片和分蘖节中ABA/GA值无影响(10 μmol·L-1ABA降低分蘖节中ABA/GA值),其中10 μmol·L-1ABA最为显著。
2.4 外源ABA对冬小麦翌年返青率的影响
在小麦分蘖前期分别用不同浓度的ABA浇灌根际后,翌年春季返青率结果有很大差异(见表1)。济麦22各处理均无返青。东农冬麦1号在浇灌ABA后,随着浓度的增加返青率先增后降,经10 μmol·L-1ABA处理的返青率最高,达到93%。
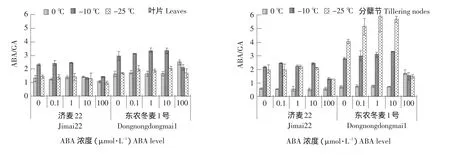
图8 外源ABA处理对冬小麦叶片和分蘖节ABA/GA值的影响Fig.8 Effect of exogenous ABA on endogeny ABA/GA in the leaves and tillering nodes of winter wheat

表1 东农冬麦1号与济麦22的返青率Table 1 Reviving rate of Dongnongdongmai1 and Jimai22 (%)
3 讨论与结论
低温胁迫下植物体内发生一系列的适应性变化,包括组织结构变化[16]和生理生化变化,其中膜脂过氧化、渗透调节物质及内源激素含量变化是最为重要的三个方面。本研究表明,在田间自然降温条件下,适宜浓度的ABA处理可提高东农冬麦1号抗寒性,其最适ABA处理浓度为10 μmol·L-1,而于晶等在水培条件下研究ABA提高东农冬麦1号抗寒性的最适浓度为 0.1 μmol·L-1,这可能是由于土壤影响外源ABA有效吸收,进而导致施用量偏大[7]。通过与对照组比较发现,外源根灌适宜浓度ABA可以提高东农冬麦1号可溶性糖、可溶性蛋白、内源ABA含量、增加SOD活性及ABA/GA值,降低相对电导率、MDA和GA的含量,而不同浓度ABA对济麦22没有产生显著影响,这与黄涛等研究结果一致[17],即外源ABA对不同抗寒性水稻品种的影响不同。高浓度ABA(100 μmol·L-1)抑制东农冬麦1号和济麦22的保护酶活性,以及可溶性糖、可溶性蛋白等保护性物质的形成和积累,增加细胞膜透性及MDA含量,降低ABA含量及ABA/GA值,而对GA含量无显著影响,说明在提高冬小麦抗寒性方面,并非某一类激素在起作用,ABA/GA值更能体现与抗寒力的关系,岳丹等也得到类似研究结果[18]。同时,Waldman等研究表明,抗寒性弱的苜蓿品种(Hairyperuvian)中GA含量明显高于抗寒性强的品种(Ranger)[19],本研究也得到类似的结果,即东农冬麦1号叶片和分蘖节中GA含量低于弱抗寒品种济麦22,说明低含量GA更有利于越冬,抗寒性强的植物GA含量一般低于抗寒性弱的植物。
经不同浓度的ABA浇灌根际后,翌年春季的返青率有明显差异,济麦22各处理均未返青,而东农冬麦1号随着外施ABA浓度的增加返青率先增后降,经100 μmol·L-1ABA处理的东农冬麦1号返青率明显低于对照20%,表明高浓度ABA降低植物抗寒力,赵春章等对云杉幼苗的研究也得到相似结果[6]。
适宜浓度的外源ABA(10 μmol·L-1)可促进东农冬麦1号抗寒性的提高,并提高返青率。外源ABA促进冬小麦抗寒性提高的主要生理基础是增加内源ABA及可溶性糖含量,提高ABA/GA值及SOD活性,降低膜质过氧化。外源ABA对不同抗寒性小麦品种的作用效果不同,抗寒性强的东农冬麦1号对外源ABA参与的低温胁迫应答反应效果强,提高抗冻性的作用明显,而ABA对弱抗寒品种济麦22则无显著影响。
[1]Bray E A,Bailey Serres J,Weretilnyk E.Responses to abiotic stresses[C]//Buchanan B,Guissem W,Jones R,eds.Biochemistry and Molecular Biology of Plants.American Society of Plant Physiologists Maryland,2000:1158-1203.
[2]王小丽,裴玉贺,郭新梅,等.低温胁迫下玉米幼苗的几种生理生化指标的变化[J].植物生理学通讯,2009,45(5):487-490.
[3]白洁,蒋卫杰,余宏军,等.外源ABA、Put和BR对亚低温条件下番茄幼苗叶片保护酶活性的影响[J].中国农学通报,2007,23(6):317-320.
[4]Aroca R,Vernieri P,Irigoyen J J,et al.Involvement of abscisic acid in leaf and root of maize(Zea mays L.)in avoiding chilling induced water stress[J].Plant Sci,2003,165(3):671-679.
[5]刘立军,陈为峰,张志华,等.叶面喷施脱落酸对高羊茅抗寒性的影响[J].中国草地学报,2010,32(6):94-99.
[6]赵春章,刘庆,姚晓芹,等.长期喷施ABA对云杉幼苗生长和生理特性的影响[J].植物学通报,2008,25(3):284-291.
[7]于晶,张林,苍晶,等.外源ABA对寒地冬小麦东农冬麦1号幼苗生长及抗冷性的影响[J].麦类作物学报,2008,28(5):883-887.
[8]蓝宗辉,詹嘉红.外源ABA对低温胁迫水稻过氧化物酶同工酶的影响[J].生物技术,2003,13(1):7-9.
[9]刘德兵,魏军亚,崔百明,等.脱落酸对香蕉幼苗抗寒性的影响[J].热带作物学报,2007,28(2):1-4.
[10]杨亚军,郑雷英,王新超.冷驯化和ABA对茶树抗寒力及其体内脯氨酸含量的影响[J].茶叶科学,2004,24(3):177-182.
[11]周碧燕,李宇彬,陈杰忠,等.低温胁迫和喷施ABA对荔枝内源激素和成花的影响[J].园艺学报,2002,29(6):577-578.
[12]魏安智,杨途熙,张睿,等.外源ABA对仁用杏花期抗寒力及相关生理指标的影响[J].西北农林科技大学学报:自然科学版,2008,36(5):79-84.
[13]郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004.
[14]张军,韩碧文,吴锜,等.植物激素酶联免疫测定基础[J].北京农业大学学报,1991,17(增刊):139-148.
[15]吴颂如,陈婉芬,周燮.酶联免疫法(ELISA)测定内源植物激素[J].植物生理学通讯,1988(5):55-59.
[16]于晶,周子珊,牟永潮,等.低温下不同抗寒性冬小麦叶片组织结构比较[J].东北农业大学学报,2010,41(4):7-11.
[17]黄涛,陈大洲,夏凯,等.抗冷与不抗冷水稻在低温期间叶片ABA与GA1水平变化的差异[J].华北农学报,1998,13(4):56-60.
[18]岳丹,王有科.杏树内源激素含量与抗寒性关系研究[J].安徽农业科学,2008,36(23):9951-9952.
[19]Waldman M,Rikin A,Dovrat A,et al.Hormonal regulation of morphogenesis and cold- resistance[J].J Exp Bot,1975,26:853-859.

