促进我国化学制药行业技术创新的政策研究
李广乾
一、我国医药工业产业结构与化学制药行业的地位
(一)我国医药行业的划分
对于医药行业,人们通常从不同角度对其进行不同的划分。从经济行业分类来看,医药行业通常被划分为化学原料药、化学制剂、中药饮片、中成药、生物化学药、卫生材料及医疗用品、医疗器械和制药机械,共8个子行业(如表1所示)1国民经济行业分类(GB/T 4754-2002、GBT 4754-2011)将医药制造业划分为七个子行业,即化学药品原药制造业、化学药品制剂制造业、中药饮片加工业、中成药制造业、兽用药品制造业、生物生化制品的制造业、卫生材料及医药用品制造业。。在这8项中,化学原料药和化学制剂统称为化学药。
从技术拥有情况来看,化学药又分为专利药、仿制药。专利药是由制药企业拥有其技术知识产权并独家生产销售的药物,而仿制药则是专利保护期限过后,其他制药企业基于药物专利技术所生产的,与专利药物在剂量、安全性、质量、适应症等方面相同的仿制品。
从用药管理角度来看,药品通常划分为处方药和非处方药(OTC)。处方药是必须由执业医师开具的处方才能获得的药物,非处方药则是患者无需执业医师处方、可以直接到药房购买的药物。处方药与非处方药的划分在广告市场投放上存在显著的差异。处方药不能在公共传媒做广告,但是可以在医学专业刊物上做广告;而非处方药则可以在大众传媒做广告。
从行业管理等方面来看,我国对于药品还有其他不同的称呼。例如,对于仿制药,我们就又有几种不同的说法,例如“原研药”(指由专利持有方所生产的专利过期药物)、首仿药(指那些首先研究申报国外已上市而在国内未上市的药品)等。再比如,对于新型药物,我们也根据其创新程度,有不同的说法。就一般新药来看,我国基于现实需要,对其有一个不断转变的发展过程。以前,我们将新药定义为“未在国内生产的药品”,后来我们将其定义为“未在国内销售的药品”。而对于那种分子结构方面单一独特的药物,我们将其称为创新药品。另外,对于那些市场前景良好、销售额很大的专利药物,人们称之为“重磅炸弹药物”,例如2008年,辉瑞公司的立普妥(阿伐他汀)、赛诺菲安万特的波利维(氯吡格雷)、葛兰素史克的施立泰(沙美特罗+氟替卡松)3种药品的全球销售额分别为137亿美元、86亿美元、77亿美元2全球原料药(API)格局因需求生变,医药经济报,2010年3月8日。。
(二)我国化学制药业的发展历程及其在医药行业中的地位
60多年以来,我国从无到有、从小到大,建立了一个门类齐全、生产研发能力都相对较强的化学制药工业,如今我国正努力从制药大国向制药强国迈进。
我们可以以1978年为界,将我国的化学制药业发展划分为两个历史阶段。第一个阶段是艰苦奋斗打基础阶段。解放初期,我国的化学制药业非常落后。1950年,我国只能生产原料药几十吨,国家几乎处于缺医少药的状态。但是,在三年恢复、“一五”计划和试办托拉斯期间,我国化学制药行业发展迅速,抗生素、磺胺、解热药、维生素、抗结核药、地方病药等从无到有,规模由小变大,为当时防治严重危害人民健康的传染病、地方病,支援抗美援朝,做出了重要贡献。文革期间,包括化学药在内的整个制药行业都受到一定影响。与此同时,我国还相应地建立了十多个医药工业研究院,并新建、扩建了制药机械厂和药用玻璃厂3新中国60年化学制药工业发展历程回顾,中国医药报,2009年9月30日。。总之,在前三十年里,我国化学制药行业的药品品种数量大幅增加,产量扩大,配套基本健全,化学制药业开始具备了一定的基础。
第二个阶段是全面、快速发展阶段。改革开放使得我国化学制药产业结构发生重大变化。国有医药企业开始转型发展,通过改组改制,国有化学制药企业不再仅仅是计划体制下的生产车间,而是成为集科研、生产、内外贸易为一体的组织,积极性和活力大大提高。与此同时,“县以下不许办药厂”、“药厂只能国家办”的框框被打破,复星、健康元、华海等一批民营企业应运而生。随着国门的打开,一批拥有世界先进生产技术和管理水平的大型跨国制药企业开始与我国合资建厂,天津大冢、上海施贵宝、西安杨森等成为第一批医药合资企业。
机制的转换使我国化学制药行业获得快速发展。1978年,我国化学制药工业产值只有63.6亿元,到2007年达到3,073亿元,增长了47.3倍,年均增长15%,高于我国的同期GDP增长率。
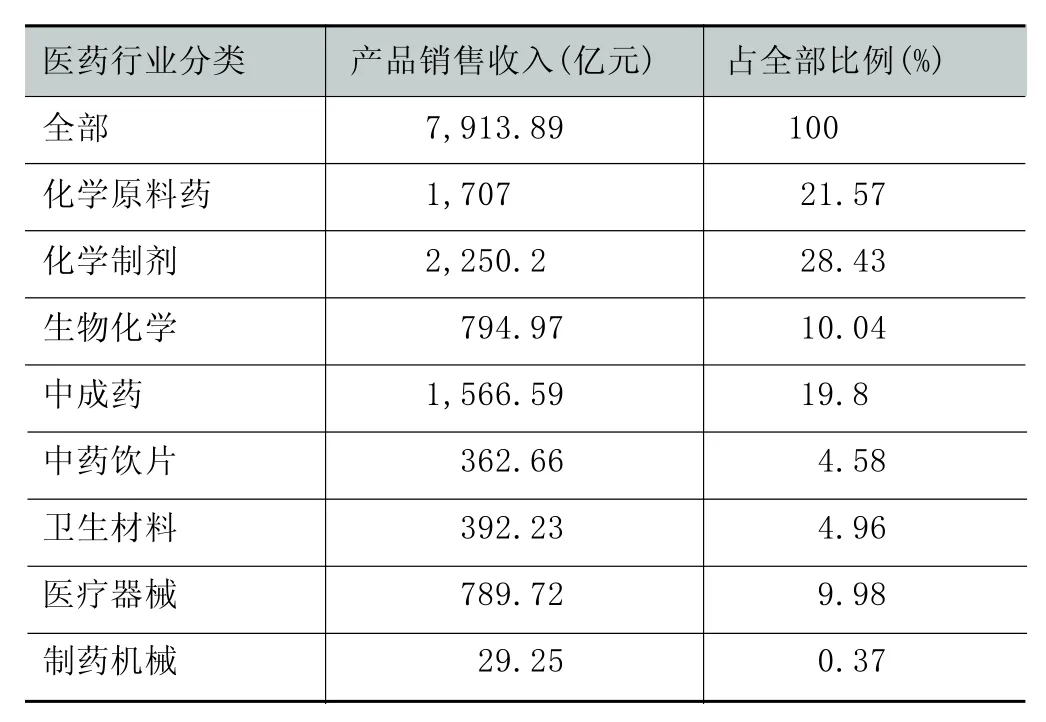
表1 2008年全国医药行业产品销售构成
根据表1,就整个医药行业来看,化学药的销售比例刚好占据我国医药行业的半壁江山,即50%(21.57%+28.43%)。如果去除非药品的医疗器械、卫生材料和制药机械三项,单从其中的制药来看,这个比例更高,达到59.2%4这个比例与所选择的评价条件有关,有的报告认为这个比例为69%。这可能与化学制药行业属于资本密集型、而中药行业的资本密集度相对较低有关。。因此,化学制药行业的创新发展对于我国整个医药行业都具有重大的意义。
(三)技术创新能力低是我国化学制药行业发展的突出特点
早在1998年,《中国化学制药行业研究报告(1998年)》将我国化学制药行业的特点概括为六个方面:产业体系完整、全面;发展速度迅速;企业基础薄弱,缺乏扩张能力;药品以仿制为主,创制极少;科技水平和管理水平低下;行业规模、企业规模小。十多年过去了,我国化学制药行业的这些特点仍然没有发生重大的变化,除了产业规模变大、原料药成为世界重要出口基地之外,其他方面仍然如故。其中尤其值得人们深思的是,这么长时间过去了,我国整个化学制药行业在国际市场竞争中的地位并没有得到任何改善,反而进一步强化了原料药供应基地的困境。我们可以从以下几个方面来认识这种困境:
(1)从出口来看,化学原料药一直占据我国药品出口的主导地位。当前我国能生产的原料药有1,500多种,产量约占全球的1/5以上,90%主要供应国际市场,占全球原料药贸易额的1/4左右。根据中国医药保健品进出口商会的统计,2009年,化学原料药占我国药品(中药+化学药)出口的80.1%。
(2)从我国药品注册情况来看,仿制药占据绝大多数比例。目前,我国97%左右的化学药是仿制药,专利药比例极低。而且即使是仿制药领域,我国化学制药企业的竞争力也很有限,相比印度落后许多。
(3)企业规模偏小,难以承担创新药品的开发。2009年,我国前十强制药企业的销售收入与世界前十强制药企业的相比,差别巨大(如表2所示)。排行第一的辉瑞公司,其年销售收入(454.48亿美元,折合人民币2,863.22亿元5假定人民币对美元汇率为6.3。)是我国前十强制药企业的销售收入总和(856.95亿元)的三倍多;即使是排行第十的礼来公司,其年销售收入(218.36亿美元,折合人民币1,375.67亿元)也比我国前十强制药企业的销售收入总和多得多。另外,我们也可通过比较市场集中度情况来认识我国制药企业规模(如表3所示)。
近些年来,新药研发成本及其对研发机构的要求不断提高。从国外化学制药行业新药创新情况来看,新药研制具有“长周期、高成本、高风险”的特点,通常表现为三个“10”:研发时间在10年以上,研发投入在10亿美元以上,成功率只有10%。对比表2,我国单个制药企业要拿出63亿人民币来搞开发,几乎是不可能的,即使是年销售收入排行第一的哈药集团,也是承担不起的。这是我国长期以来一直没有“重磅炸弹”药物的重要原因6从市场价值来看,我国的青蒿素可以被看做是这类重磅炸弹药品。不过,其研发过程比较特殊,不能看做是现在的市场化的产物。。

表2 2009年世界与中国医药领先企业规模比较

表3 国内外制药集中度比较
二、国际化学药物创新的基本经验
从上述对比分析,我们发现,我国与美欧等化学制药发达国家相比,差距实在太大,短期内难以追赶更别说超越了。从可行性上来看,印度制药业创新发展的经验倒是能够给我们带来有益的启示和借鉴。
在1991年开启市场化改革之前,印度制药行业与我国发展水平差不多,几乎完全以仿制为主,企业规模小、研发能力差,国际化水平低,但是从上世纪九十年代开始,印度制药企业积极利用本国宽松的专利保护、低成本优势和文化优势,积极开发相关专利工艺技术,进行规范市场认证,承接国际原料药转移订单,并逐步将制剂卖到发达国家,因而涌现出大量国际化的仿制药企业,如Dr Reddy's,Ranbaxy,Sun Pharma 等。它们开始在全球范围内寻找合适的收购目标,扩大市场份额,并开始在新药研发领域取得一席之地。这条从大宗原料药→特色原料药→仿制药→专利创新药的发展途径,被人们称为“印度模式”。
具体来说,“印度模式”主要包含以下若干内容:
(1)尽量减低专利保护水平,以保护国内弱势企业,促进国内企业仿制跨国企业专利药品。尽管印度是WTO创始成员国(1994年),而我国在2001年才加入WTO,但是印度对于TRIPs协议的履行则一拖再拖,一直到2005年才开始规范地实施药品专利保护。而我国对于美国等跨国药企的专利药物则提供了超国民待遇,还在加入WTO之前的1993年,就以药品行政保护的形式对其进行特定保护。
(2)严格药品生产管理,提高药品生产水平。尽管印度制药企业最初规模都比较小,技术实力不足,但是在药品生产管理方面却非常严格,药品质量得以保障。为此,印度一些企业严格向美国、欧洲看齐,根据这些发达国家的药品生产标准进行生产。2005年,印度通过美国FDA(联邦食品药品监督管理局)认证的工厂数达到70家72007年6月,浙江华海药业股份有限公司生产的抗艾滋病药物奈韦拉平通过美国FDA认证,成为中国首家制剂通过FDA认证的制药企业。,达到国际GMP(药品生产质量管理规范)水平的工厂数超过200家。2005年1~6月,印度得到美国FDA批准的原料药(DMF8DMF是美国FDA的药物管理档案(Drug Master File)的简称,是化学原料药、中间体、赋形剂、辅料和医药包材等医药原材料进入美国大门的必需资格文件。)有74个,占批准量的34.7%,居第一位。近年来,随着外资的引进,中国制药行业的技术水平和创新能力虽然有了很大的提高,但同印度相比还有一定距离。中国目前还没有制剂出口,即使是外资企业生产的产品,也主要是为了满足中国市场,很少出口欧美9中印部分产业比较分析,来自商务部网站:http://zys.mofcom.gov.cn/aarticle/d/200709/20070905081513.html。
(3)加强国际化营销。人均药品消费与一个国家的经济发展水平成正比。由于经济发展水平不够高,印度国内的药品市场比较有限,因此印度制药企业从上世纪九十年代开始,就将市场瞄准发达国家医药市场。其做法有两条:一是上述所讲的加快获得美国、欧洲国家的药品生产和临床试验质量标准要求。目前,FDA批准大约900家印度工厂出口产品和原料药到美国,大多数是近年来批准的,而中国获得批准的这类企业仅为300多家。二是加快国外市场的并购。一般而言,通过收购目标市场的企业或某种产品获得在目标市场的特许经营权,比较容易进入新的非专利药市场。为了实现化学药制剂产品向欧美发达国家市场(规范市场)的出口,印度医药企业主动出击,收购这些市场(目标市场)的中小厂家,并利用其品牌和销售渠道,整合自身的产业链条。
(4)颁布优惠的医药产业发展政策。上世纪九十年代后,印度大胆改革和调整传统的医药管理体制,把医药产业列为优先发展的重点产业之一,并颁布了若干激励医药产业发展的政策(如表4所示)。一些具体的刺激医药产业发展的关税和非关税优惠政策包括:制药业与生物技术和IT行业一样可获得免税待遇;将药品进口的最高关税从30%降低到25%之后,又降至20%,并免除4%的特别附加关税;对外国公司的特许药品收入实行免税;对于印度科学与行业研究局批准的进行科学研发的公司实行10年100%减免利润税;免除研发公司的最低出口义务以减免关税;对以临床试验为目的的所有进口药品和材料免除关税和货物税;将制药业进出口关税参考标准从25%降至5%;8种药品被列入挽救生命药品目录,其进口关税从50.8%降至5%。
上述模式让印度制药企业获得巨大成功,成为当前国际医药市场的一只重要力量,其竞争实力远在我国之上。目前,我国制药企业已经沦为印度企业的原料供应基地。根据中国海关数据统计,2011年前8个月,印度超越美国成为我国最大的西药原料药出口国,占我国化学原料药出口总额的14.45%。因此,一些业内人士甚至惊呼,中国制药行业与印度的差距在10~15年!
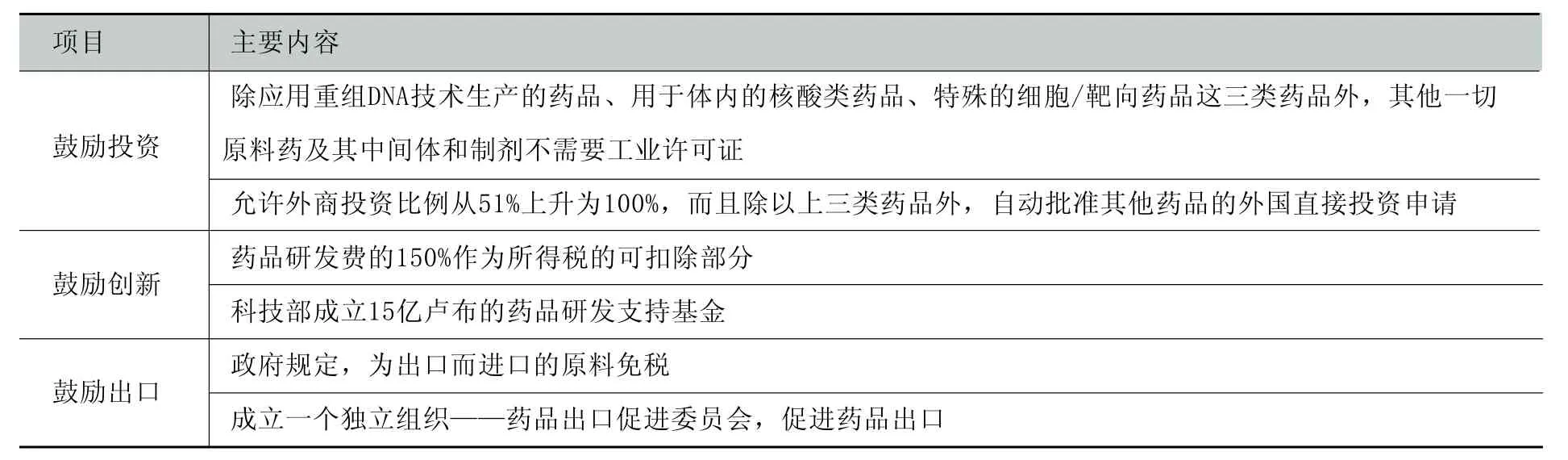
表4 印度政府促进制药行业发展的产业政策
三、促进我国化学制药行业技术创新的主要政策建议
(一)明确化学制药行业的发展战略,调整发展路径
从具体情况来看,我国化学药行业受困于“群堆困境”:由于大宗原料药行业技术门槛低、投资不大,因而吸引大量企业进入,并形成产能过剩;在产能过剩的情况下,行业竞争加剧,企业只能通过价格战寻找出路;而价格战使得企业利润大幅降低甚至亏损,难以获得、积累用于技术改造、产业升级所必须的投资资金,而沉淀成本使得这些企业只能继续呆在这个领域苟延残喘。于是,大宗原料药行业就形成了“技术水平低、竞争激烈、利润低”的“群堆陷阱”,将所有的企业都困在其中。表2、表3从一个侧面验证了“群堆陷阱”的存在。总之,“群堆陷阱”是造成当前我国化学制药行业缺乏创新的基本原因10其实,“群堆陷阱”在我国传统行业大量存在,只是在化学制药行业表现得更为明显。当前“群堆陷阱”也有向一些高技术行业(如光伏行业)蔓延的趋势。。
要摆脱“群堆困境”,必须制定有效的行业发展战略和目标。但是,目前,我们并没有明确的化学制药行业的定位和发展目标。虽然我们在许多政策文件中,都以现代医药产业作为重要的发展目标,并且将其看作是7个战略性新兴产业之一,但是这些目标通常都过于宏大,不切实际,以纯粹的创新为唯一指标,根本就没有考虑到,我国化学药行业目前的市场组织结构、产品结构以及技术能力难以支持这样宏大的发展目标,并且也没有考虑到制药行业技术积累的阶段性规律,指望一步到位。
从表2、表3可以看出,我国化学制药行业要在近中期走自我创新之路是非常困难的。这是一个现实问题,也是20年来印度明确选择仿制战略并取得成功的一个重要原因。当然,我国选择的路径应该与印度有所区别,因为我们的条件与20年前的印度明显不同,技术能力、专利保护水平都比印度有所提高,因而可选择的路径更加多样。从过程来看,当前的具体政策方向包括:
(1)压缩大宗原料药产能与加强特色原料药并举,以破解“群堆困境”。近年来,随着原材料、动力能源价格的上涨,环保压力的增加,以及人工成本逐年上升, 大宗原料药的生产成本压力陡增,压缩产能实为无奈之举。同时,对于被压缩的大宗原料药企业来说,特色原料药所需投资和技术压力不大,但是特色原料药的生产却可以为大宗原料药行业带来较高的利润,减少产能压缩所产生的不利影响,并可规避低成本的无序竞争,为企业未来进军制剂市场积累实力。
实际上,特色原料药将具有越来越大的国际市场空间。根据测算,2010~2015年间,专利到期的药物将释放1500亿美元的市场,而这些到期的仿制药将对特色原料药产生巨大的需求。这是我国依赖原料药大国地位实现进一步发展的一个历史性机遇。因此,进一步强化特色原料药企业发展创新能力,是未来化学制药行业的重要发展方向。
(2)强化仿制与促进CRO(合同研究组织,即药物研发外包)并重。仿制是当前我国化学制药的基本特征,但是目前的仿制水平却很低,连印度都比不上。为此,必须采取各种措施,提高当前我国制药企业的仿制能力和水平。另一方面,为了促进将来的新药研发,有必要从侧面加强CRO机构的发展,提高当前正蓬勃发展的CRO的能力和水平。
上述两个政策,都要求我们调整医药特别是化学制药行业的发展方向,要将部分用于创新药物的研发投入转向这两个方面来。只有这样,才能让我国化学制药行业跳出“群堆陷阱”。
(二)细化新药定义,强化药品审批政策,提高仿制药准入门槛
1. 加强新药与专利的链接
对于专利药物的仿创结合,是印度化学制药行业取得成功的重要秘诀,也是我国当前化学仿制药行业的一个重要发展方向。这就要求我国加强对于新药的审批管理,加强新药审批与专利制度的链接,为促进我国化学仿制药的发展提供制度支撑。
我国对于新药的界定是随医药发展环境而不断改变的。1985年实施的《药品管理法》和1999年国家药品监督管理局颁布的《新药审批办法》将新药定义为“我国未生产过的药品”;2002年的《药品管理法实施条例》将新药定义为“未曾在中国境内上市销售的药品”;2007年的《药品注册管理办法》对于新药进行重新界定,要求“已上市药品改变剂型、改变给药途径或增加新适应症,将不能再按照新药管理,不再视为新药注册审批”。从这个不断改变的过程,我们可以看出,我们对于新药的定义日益接近“新”的本意,对于新药的技术要求不断提高了。
但是,在新药的定义中,我们一直没有看到专利的身影。其实,在上述新药概念的演变过程中,对新技术的要求越来越明确。因此,如果从专利角度出发,新药的管理势必会面临不少问题。从国际化学制药行业的发展来看,药品生产技术与工艺的公开是其必要条件,如果没有审批制度把关,药品的创新发展几乎是不可想象的。因此,加强专利制度与药品审批制度的衔接就成为化学制药行业发展的一个基础工作。我国实际上也早已实现由药品生产工艺专利保护向药品本身的专利保护转变,但是专利制度的这种改变并没有体现在药品注册过程中,两者的衔接还存在一定的问题。虽然2007年的《药品注册管理办法》也提出,“药品注册过程中发生专利权纠纷的,按照有关专利的法律法规解决”,但是由于药品审查部门并没有将药品专利的审查要求放到注册的前置地位,新药审批过程中仍然不断发生专利纠纷的情况。
实际上,完善新药审批制度中的专利保护,对于化学仿制药发展也是非常必要的。所谓新药和仿制药的再开发,是当前化学药行业发展的一个重要方向,对于我国化学制药来说,同样非常重要。
2. 强化GMP认证,提高药品生产质量
质量一直就是药品生产的关键,是保证药品疗效最为重要的条件,也是印度制药企业成功开拓国际规范市场11所谓规范市场,是指欧美、日本等经济发达国家的药品市场。由于这些国家和地区的医疗保障制度发达,药品市场规模巨大,因而是制药企业国际化的首选。的法宝。
我国从1988年开始实施药品GMP,从引进、酝酿、到全面推行GMP,至今已有20余年,2011年2月,卫生部又颁布了《药品生产质量管理规范(2010年修订)》并于3月1日起执行。新版药品GMP规定了所有制药企业在生产和销售药品前必须达到的标准。新标准的实施将会给医药行业带来相当大的冲击,推动医药行业重新洗牌。
实现GMP的标志,并不简单地取决于证书,而在于其产品质量是否真正做到万无一失。在这方面,美国的做法值得学习。美国从上世纪六十年代开始推行GMP,至今每年都有新要求,他们崇尚动态的“现行GMP(cGMP)”,不搞标新立异的花架子,强调持续推行。这才是我国实施GMP必须追求的目标。目前,我国的GMP证书并未得到国际公认,对于制药企业走出国门、进入规范市场是一个挑战。在这种情况下,借鉴印度经验,加强与美国、欧洲药监部门的合作,采取有效措施,鼓励、支持我国部分有实力的企业参考欧美标准实施GMP、进入国际非专利药市场,不失为一个可行的策略。
3. 提高仿制药准入门槛
根据2007年的《药品注册管理办法》,我国对于仿制药的申报与审批并没有特别的要求,并不考虑企业的规模、科研能力以及市场需求,这使得大量中小企业申报并获批一些技术要求不高的仿制药。实际上,一些单品种普药的生产厂家非常多,达到几百家企业。这是造成化学制药行业出现“群堆陷阱”的制度原因。
最近两年来,国家药监部门加强了仿制药批文管理,但是批文数量仍然较多。今后,药监部门有必要加强与工业行业管理部门的协作,根据工信部、卫生部和国家食品药品监督管理局联合发布的《关于加快医药行业结构调整的指导意见》(工信部联消费[2010]483号)的要求,从多层面平衡仿制药审批数量,进一步提高仿制药审批的难度,从仿制标准到仿制品种转变,提高仿制药的生产质量。
(三)调整药品定价制度,促进国内仿制药的发展壮大
国家对药品价格问题一直非常重视,不断改革药品定价形成机制,多次调整药品价格。原国家计委先后在1996年、2000年发布实施《药品价格管理暂行办法》、《药品政府定价办法》;2009年,国家发改委、卫生部、人力资源与社会保障部联合发布《改革药品和医疗服务价格形成机制的意见》。
在当前的药品定价政策中,有关原研药以及所谓优质优价的政策并不利于当前医疗体制改革。新医改前,尽管国家发改委已经进行了20多次的药品降价,但药品价格却陷入“屡降屡高,屡高屡降”的怪圈,我国的医疗费用也不降反增。这与原研药价格过高有着密切的关系。根据有关专家的推算,目前原研药占据医院药物使用量的一半左右,是导致看病价格虚高的根本原因。而且,这种政策也不利于国内化学仿制药企业的发展。目前,原研药企业可以享受单独定价政策,而仿制药的价格均以原研药价格为定价标准,就实际情况来看,仿制药价格通常要比原研药价格低不少,有的原研药价格甚至是同品种仿制药价格的8倍。由于在我国药品市场上,原研药主要来自外商独资、中外合资企业特别是那些跨国企业,因而原研药单独定价制度将进一步加大跨国药企对于内资企业的打压,不利于我国仿制药行业的整体发展。
因此,今后应该对这种定价机制进行调整。具体方式是,根据疗效和药物经济学的对比分析,合理确定仿制药与原研药的价格。最主要的是,专利期一旦过去,原来的专利药就不应再享受单独定价的权利,原专利药即原研药就应该与仿制药放在同一个等级上进行定价,由疗效和药物经济学来确定其价格差异。
四、加强化学制药企业之间的并购
压缩原料药的一个配套措施就是要加强化学制药企业之间的并购。这种并购来自两个方面的压力和动力:一方面,一些缺乏技术竞争力的中小型大宗原料药企业将面临强大的市场竞争压力,不得不寻找合作伙伴;另一方面,仿制药行业的扩大将增加特色原料药的需求,促使一些研发实力较强的企业寻求加强与特色原料药企业的上下游合作。在这种情况下,国家应该采取有效措施加以鼓励,从财政、金融、证券、税收等多方面给予支持和帮助,为化学制药行业的产业结构转型和升级改造提供良好的市场环境。
五、若干具体政策
为了促进上述政策调整方向,可以考虑实行一些具体的配套措施:
(1)为促进实力较强的内资企业开展国内、国外的购并,可以考虑对于被购并标的金额,按照一定比例或额度,列支研发费用。
(2)调整大宗原料药和特色原料药的出口退税比例。降低前者,增加后者。
(3)对于CRO,可以考虑将其看做软件企业(高新技术企业)对待,并将软件服务优惠政策适用于内资企业的药物合同研发业务。
(4)对于获得美国、欧洲相关认证(cGMP、DMP)的国内企业,给予一定金额的补贴、奖励。
(5)对于内资企业为实施cGMP而持续增加的投入,按照研发费用记入企业生产成本。
(6)将目前国家用于新药研发的财政资金的一定比例(如三分之一),转移到仿制药升级提高工作上来。
(7)适当增加国内仿制药在基本药物和医保目录中的比重。
[1]于倩倩,许铭. 我国医药外贸形势回顾与展望[N]. 中国信息报,2010-04-27.
[2]姚立新,王迪. 印度药品出口主打美国,制药企业并购浪潮此起彼伏[N]. 医药经济报,2010-07-15,
[3]茅宁莹,张帅英. 印度制药产业创新系统演进的经验与启示[J]. 现代管理科学,2011,(6).
[4]陈利君. 印度医药产业崛起的原因与启示[J]. 云南社会科学,2006,(5).
[5]粟高超,化学原料药“薄利多销”的增长模式并非长久之计[N]. 医药经济报,2011-10-18.
[6]郭艾琳,中印制药龙象之争 中国药企落后印度10至15年[N]. 第一财经日报,2006-08-22.
[7]常峰、张子蔚. 我国药品价格管理发展进程研究[J]. 中国药物经济学,2009,(5).
[8]姜恒. 原研药首次成批降价 仿制药成长机会几多[N]. 中国医药报,2010-12-23.
[9]李梅、叶桦. 我国仿制药上市对原研药价格的影响[J]. 上海医药,2009,(6).

