兰索拉唑抑制幽门螺杆菌诱导胃上皮细胞表达COX-2
鲁君艳 张艳 伍海英 李翔 刘胜
幽门螺杆菌(helicobacter pylori,Hp)是外形呈螺旋状的一种微需氧革兰阴性杆菌。是引起慢性胃炎、消化性溃疡、胃黏膜相关淋巴组织淋巴瘤的重要病因[1-2]。环氧化酶(cyclooxygenase,COX)是催化花生四烯酸形成前列腺素的关键酶。其中,COX-2在生理状态时机体细胞很少表达或表达缺如。当细胞受到诸如炎症、损伤、激素、生长因子、细胞因子、炎症因子、肿瘤诱导剂及紫外线照射等理化因素刺激时,COX-2 迅速合成,表达增加。其产物PGE2作为一种较强的细胞免疫抑制剂,能抑制免疫系统的监管作用,有利于癌细胞的免疫逃逸。同时,PGE2本身还具有抑制胃肠道上皮细胞凋亡和促进其增生的作用。并参与了肿瘤发生、发展的病理生理过程。因此,适当抑制该酶的表达对于治疗Hp相关性胃部疾病应该是有益的[3-4]。兰索拉唑(lansoprazole,LPZ)是由日本武田公司开发的新一代质子泵抑制剂,近年研究显示,LPZ除了具有抗酸作用外,还有一定的抗炎效应[5]。如上调血红素氧合酶1的表达,抑制NF-κB的激活,最终抑制Hp诱导的IL-8产生以及中性粒细胞迁移从而降低炎症反应程度[6]。此外,LPZ也能有效降低吲哚美辛诱导的肠炎[7]。因此,本研究拟采用胃上皮细胞系AGS为研究对象,采用Hp感染后,观察LPZ对COX-2 表达及PGE2产生的影响。
1 资料与方法
1.1 主要实验试剂 COX-2鼠抗人多克隆抗体为Santa Cruz产品, 抗人HRP标记兔抗鼠多克隆抗体购自武汉博士德生物技术有限公司。兰索拉唑购自日本武田药品有限公司(Takeda Pharmaceuticals)。青霉素、链霉素、二甲基亚砜(DMSO)购自华美生物公司。Hp为本研究所保存(ATCC编号:700392);胃上皮细胞系AGS购自ATCC(编号:CRL-1739)。
1.2 HP的培养及菌液制备 取含Vancomycin(10mg/L)、Amphotericin B(10 mg/L)、Polymyxin B(2500U/L)、TMP(5 mg/L)和 7%脱纤维羊血的哥伦比亚血琼脂平板分区划线,微需氧环境(10% CO2,5% O2,85% N2)37℃,培养 48h。取单菌落进行生化反应、革兰染色和PCR扩增鉴定,确定为阳性后,用灭菌的生理盐水将Hp从血琼脂平板上洗下,然后调整菌液浓度至1×109CFU/mL。
1.3 AGS细胞培养与感染 AGS细胞用含 10%胎牛血清在RPMI-1640 培养基中于5% CO2,37℃下培养。实验分为空白对照组(仅给予0.1% DMSO为对照)、Hp感染组(用100 MOI的Hp感染24h)和不同浓度兰索拉唑组(Hp感染前加入不同浓度兰索拉唑作用3h)。Hp感染结束后,获取细胞用于以下研究
1.4 实时定量PCR检测AGS细胞中COX-2 的表达 细胞处理结束后,根据试剂盒操作说明提取总RNA(FUJIFILM)并逆转录为cDNA,产物用RNA酶处理。设计特异性引物用于检测COX-2表达的定量。其正向引物:5’-ATCTACCCGCCTCACATCCCT-3’ ;反向引物:5’-AGCTGCTCATCATCCCATTCT-3’ 。利用Light-Cycler PCR仪对COX-2 进行扩增:95℃ 10s;60℃ 40s,共35个循环。同时采用β-actin为内参。数据以COX-2/β-actin比值表示。
1.5 Western blot检测AGS细胞中COX-2 表达 6孔板中细胞经PBS漂洗后,加入细胞裂解液裂解30min,4℃ 12000g离心15min,上清即为细胞总蛋白。裂解液中的蛋白用Bradford试剂在分光光度计中测定OD 595处吸光度。50~70μg总蛋白在5%~10%聚丙烯酰胺凝胶中电泳,并转移至PVDF膜上,经5%无脂牛奶封闭后,分别用孵育一抗,二抗,ECL发光,显影。
1.6 PGE2检测 收集感染后24孔板中细胞上清液,按照ELASA 试剂盒说明书检测PGE2水平。即100μL细胞上清液加入到每个捕获抗体包被的微孔板中,室温孵育2h。洗板后,加入
100μL检测抗体,室温继续孵育2h。随后弃混合物,每孔加入
100μL streptavidin-HRP,室温避光孵育20min。最后,每孔加入100μL底物,室温避光孵育20min,然后加入50μL终止液,分光光度计检测450nm处OD值。
1.7 统计学方法 实验数据采用SPSS 13.0统计软件进行统计分析,组间比较采用t检验,计量资料以均数±标准差(±s)表示,P<0.05为差异有统计学意义。
2 结果
2.1 兰索拉唑对Hp感染AGS细胞后COX-2 mRNA表达的影响 实时定量PCR结果显示,Hp未感染前AGS细胞COX-2 表达很低。Hp感染后其mRNA水平显著增高。而AGS细胞预先经30~100μmol/L LPZ处理后,COX-2 mRNA水平有所降低,见图1。

图1 兰索拉唑对Hp感染AGS细胞后COX-2 mRNA表达的影响
2.2 兰索拉唑对Hp感染AGS细胞后COX-2 蛋白表达的影响 Western blot显示,AGS细胞中COX-2 表达很低。Hp感染能使其表达水平增加,而不同浓度LPZ处理后能抑制该效应,见图2。

图2 LPZ对Hp诱导AGS细胞表达COX-2 蛋白的影响
2.3 兰索拉唑对Hp诱导AGS细胞产生PGE2的影响 基础状态下AGS细胞几乎不产生PGE2。100 MOI Hp感染后,PGE2含量达(76±6.5)pg/μg protein。而AGS细胞若用 100μmol/L LPZ预孵育 2h,可显著降低PGE2含量,见图3。
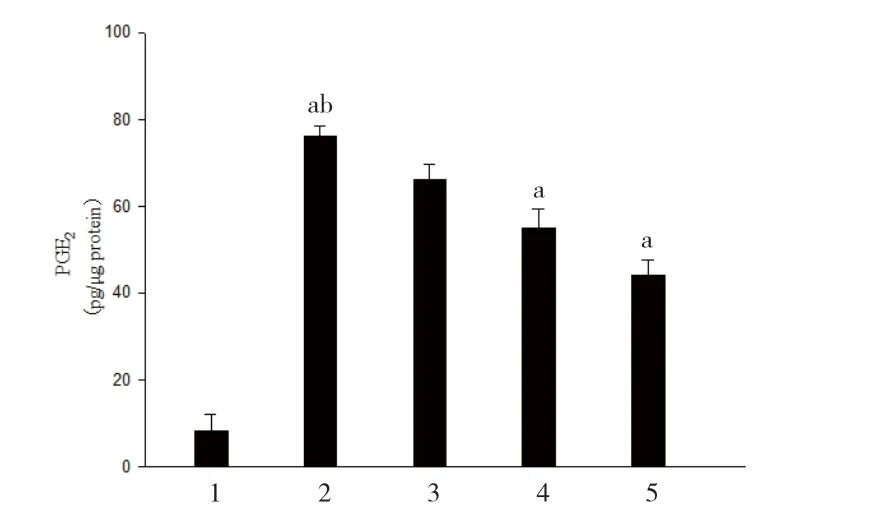
图3 兰索拉唑对Hp诱导AGS细胞产生PGE 2的影响
3 讨论
虽然机体对于Hp感染能够诱导产生较强的细胞与体液免疫应答,但对清除Hp感染依然有限,因此,一旦感染Hp,将长时间维持在持续感染状态。Hp感染引起的炎症反应是Hp的重要致病因素之一。有研究显示,有效控制Hp感染引起的炎症反应能在一定程度上降低消化系统相关疾病的发生。在炎症与癌症的发生过程中,COX-2 在其中起重要作用,COX-2 蛋白的过量表达是胃炎和粘膜损伤的重要机制,也是胃肿瘤发生的早期诊断标志。除了COX-2,PG也与各种胃肠道疾病密切相关。COX-2 在炎症部位被快速诱导表达,产生大量的炎症性PG和其它炎症介导物如细胞因子和蛋白酶类,引起炎症反应。COX-2产生的大量炎症性PG可引起胃黏膜的损伤。PGE2作为一种较强的细胞免疫抑制剂,本身还具有抑制胃肠道上皮细胞凋亡和促进其增生的作用。PGE2刺激bcl-2蛋白表达,bcl-2可抑制细胞凋亡,使细胞增殖和凋亡失衡,从而促进肿瘤发生。由于COX-2 和PG是预防癌症和各种炎性相关疾病的的重要靶点,因此,抑制其过度表达除了能减轻局部炎症反应外,对肿瘤的防治也具有重要的意义[8]。
LPZ是一种第二代质子泵抑制剂。对由组胺、胃泌素和氨甲酰甲基胆碱刺激引起的胃酸分泌均有强力抑制作用,并具有显著的胃蛋白酶分泌抑制作用。此外,LPZ抗菌活性与柠檬酸铋相似,而抗菌力为奥美拉唑的4倍。近年的研究证实,LPZ能抑制小鼠巨噬细胞分泌IL-8、IL-1 β和TNF-α,同时也能抑制ERK 1/2信号通路的活性[9-10]。这表明LPZ除了其固有的抗酸活性外,对机体的免疫系统也可能具有一定的调节作用。迄今为止,有关质子泵抑制剂对Hp感染后胃上皮细胞炎症反应方面的实验还很少,目前尚很难确定其在炎症反应中的作用地位。
本研究证明,LPZ能在蛋白和mRNA水平抑制Hp感染后胃上皮细胞表达COX-2 并产生PG。由于Hp感染诱导的COX-2 的过度表达是胃癌和各种炎性疾病发生的重要因素,因此,LPZ对治疗带来的临床益处可能远超出其抗酸作用所产生的效果,它在抗酸分泌的同时能有效改善Hp感染后的炎症反应,最终发挥胃黏膜保护作用。因此,我们可通过该效应抑制COX-2表达或减低此酶的活性来抑制大量PG的产生,从而治疗Hp相关性胃黏膜疾病。
[1]Micu G,Staniceanu F,Zurac S,et al.Carcinogenesis and infection with Helicobacter pylori[J].Rom J Intern Med, 2010,48(4):299-306.
[2]杜志刚.幽门螺杆菌阳性180例临床分析[J].当代医学,2011,17(7):97.
[3]Konturek PC,Konturek SJ,Brzozowski T.Helicobacter pylori infection in gastric cancerogenesis[J].J Physiol Pharmacol,2009,60(3):3-21.
[4]Bardou M,Barkun AN.Preventing the gastrointestinal adverse effects of nonsteroidal anti-inflammatory drugs: from risk factor ident ification to risk factor intervention[J].Joint Bone Spine,2010,77(1):6-12.
[5]Satoh H.Discovery of lansoprazole and its unique pharmacological properties independent from anti-secretory activity[J].Curr Pha rm Des,2013,19(1):67-75.
[6]Handa O,Yoshida N,Fujita N, et al.Molecular mechanisms invo lved in anti-inflammatory effects of proton pump inhibitors[J].Inflamm Res,2006,55(11):476-480.
[7]Kuroda M,Yoshida N,Ichikawa H,et al.Lansoprazole,a proton pump inhibitor,reduces the severity of indomethacin-induced rat ente ritis[J].Int J Mol Med,2006,17(1):89-93.
[8]Romano M,Ricci V,Zarrilli R.Mechanisms of disease:Helicobacter pylori-related gastric carcinogenesis-implications for chemoprevention[J].Nat Clin Pract Gastroenterol Hepatol,2006,3(11):622-632.
[9]Hahm KB,Lee KJ,Kim YS,et al.Augmented eradication rates of Helicobacter pylori by new combination therapy with lansoprazole,amoxicillin,and rebamipide[J].Dig Dis Sci,1998,43(2):235-240.
[10]Yoshida N,Kamada K,Tomatsuri N,et al.Management of recurre nce of symptoms of gastroesophageal reflux disease: synergistic effect of rebamipide with 15 mg lansoprazole[J].Dig Dis Sci,2010,55(12):3393-3398.

