丙泊酚对大鼠缺氧后海马细胞谷氨酸转运蛋白表达及其功能的影响
郑玉珍,闫 诺,张 彦,梁 禹
(1天津市环湖医院,天津300060;2天津武警医学院附属医院)
谷氨酸是中枢神经系统主要的兴奋性氨基酸递质,经突触前膜释放至突触间隙,然后作用突触后膜受体发挥生理效应。生理状态下,突触周围胶质细胞谷氨酸转运蛋白可摄取突触间隙过多的谷氨酸以补充谷氨酸循环。有研究显示在创伤、脑卒中等病理状态下,胶质细胞转运蛋白转录及表达降低[1],摄取功能障碍,造成大量谷氨酸在突触间隙聚集,频繁诱发突出后兴奋性电位,引起神经细胞兴奋性神经损伤。丙泊酚是一种静脉麻醉药,可通过多种机制发挥脑保护作用。但是,丙泊酚是否通过调节谷氨酸转运蛋白(EAAT)的表达和降低缺氧后兴奋性神经毒性损伤发挥脑保护作用,尚无文献报道。2011年8月~2013年2月,我们就丙泊酚对缺氧后EAAT表达和谷氨酸摄取的影响进行研究,以进一步探讨缺氧后丙泊酚的脑保护作用机制。
1 材料与方法
1.1 细胞培养及分组 参照Velly等[2]方法,无菌条件下取10个月龄SD大鼠的海马组织,去除脑膜和血管,用0.25%胰蛋白酶消化成细胞悬液后,接种到预先用多聚赖氨酸0.1 g/L处理24 h的培养瓶内,24 h后更换培养基,以后3 d更换1次培养基。第7天时,放入恒温摇床内,100 r/min振摇5 h;弃去培养基,用0.5%的胰蛋白酶消化吹匀后,接种于培养板中,待长成连续单层后,按试验需要分为对照组和丙泊酚组,每组6个复孔,继续培养7 d进行缺糖/缺氧模型制作。对照组:用无糖Earles培养液,置于37℃、5%CO2氮气缺氧罐中缺糖/缺氧培养6 h。丙泊酚组:换以含丙泊酚的无糖Earles培养液,置于37℃、5%CO2氮气缺氧罐中缺糖/缺氧培养6 h。然后分别收集细胞进行相关实验。
1.2 EAAT2测定 将上述各组细胞取出,用不含药物的人工脑脊液灌流10 min,Western blot方法进行EAAT2蛋白测定。然后根据厂家试剂盒指示提取细胞总RNA,参照 Su等[3]方法取总RNA 20μg进行Nothern blot测定,其值用测定蛋白/内对照灰度值表示。
1.3 NF-κB寡核苷酸(ODN)的建立及细胞核NF-κB蛋白测定 反义 ODN系列为 5'-GGGGAA CAGTTCGTCCATGGC-3',正义 ODN 序列为 5'-GCCATGGACGAACTGTTCCCC-3'。ODN均经全程硫代化修饰,上海博亚生物工程公司合成,经PAGE方法纯化,用脂质体法将反义ODN和正义ODN对各组培养细胞进行转染,然后提取细胞核蛋白,用Western blot方法进行NF-κB和EAAT2蛋白测定,其值用测定蛋白/内对照灰度值表示。
1.4 谷氨酸摄取量的测定 细胞培养基中加入3HD-L-Glu共同孵育15 min后,用冰冷的0.9%NaCl溶液终止反应并冲洗3遍,随即加入0.3 mol/L NaOH溶液裂解细胞,最后离心,收集上清液加入闪烁液,使用液闪计数仪测定3H-D-L-Glu摄取率。
1.5 统计学方法 采用SPSS12.0统计学软件,计量资料以¯x±s表示,组间比较采用t检验和方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 缺氧海马细胞EAAT2的表达 与对照组相比,丙泊酚组海马细胞EAAT2蛋白、EAAT2 mRNA表达均明显增加 (见图1)。
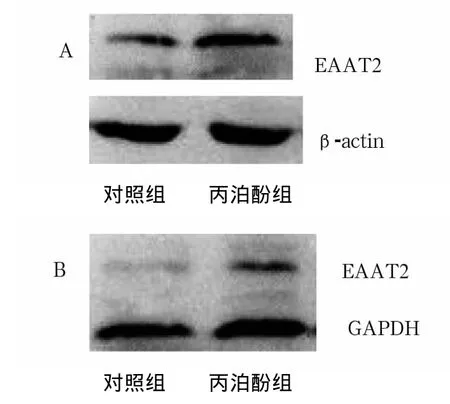
图1 丙泊酚对EAAT2表达的影响
2.2 丙泊酚对反义、正义 ODN处理后 NF-κB、EAAT2表达的影响 反义ODN处理后两组细胞核内 NF-κB 均接近于无表达(0.10 ±0.02 vs 0.28 ±0.03,P >0.05);与对照组相比,丙泊酚可明显抑制正义ODN处理后细胞核内NF-κB的表达(2.13±0.56 vs 1.02 ±0.15,P <0.05)。反义 ODN 处理后两组EAAT2表达无统计学差别(1.98±0.45 vs 2.12 ±0.59,P >0.05);与对照组相比,正义 ODN处理后丙泊酚可明显上调EAAT2蛋白表达(0.56±0.02 vs 1.29 ±0.76,P <0.05)。
2.3 丙泊酚对谷氨酸摄取率的影响 反义ODN处理后丙泊酚对谷氨酸摄取率无影响[(19.2±3.4)%vs(20.3 ±4.1)%,P >0.05],而正义 ODN处理后丙泊酚可明显增强谷氨酸摄取率[(8.2±1.6)%vs(17.8 ±5.1)%,P <0.01]。
3 讨论
研究表明,丙泊酚可上调细胞膜 EAAT3表达[4],通过抗脂质过氧化发挥脑保护作用;然而体外实验证实,临床相关剂量丙泊酚并不能抑制缺血再灌注后脂质过氧化。Ansley等[5]观察到大剂量丙泊酚仅可抑制50%的脂质过氧化程度,因此,临床剂量丙泊酚通过EAAT3发挥脑保护作用受到了质疑。
谷氨酸介导的兴奋性神经毒性损伤于缺血后可迅速发生,过去尝试用各种方法减低谷氨酸兴奋性毒性损伤。临床实验中首先应用的是NMDA拮抗剂,结果显示该方法拮抗病理突触过度兴奋传递的同时阻碍了生理突触传导通路,反而加速神经元细胞死亡。另一重要方法是通过EAAT摄取突触间隙过多的谷氨酸,降低细胞外谷氨酸浓度从而减小神经毒性损伤。因此,EAAT表达及功能研究成为近些年来研究的热点。本文就丙泊酚处理对缺氧后海马细胞谷氨酸毒性损伤的影响是否与EAAT2的双向调节有关,进行了研究,结果显示缺氧后丙泊酚处理可上调EAAT2基因和蛋白的表达,提高谷氨酸摄取率,因此丙泊酚缺血后处理可能通过正向调节EAAT2表达及增强其功能发挥脑保护作用。
已有研究证实,基因转录[6]或翻译过程调节[7]可增强EAAT2蛋白表达。本研究结果显示,丙泊酚可通过基因转录调节EAAT2的表达。低氧环境下HIF是细胞核内主要的调节因子。Dallas等[8]研究发现,HIF活性抑制剂topotecan、FG4496和DFO不能上调EAAT2表达,而NF-κB活性抑制剂可逆转缺氧对EAAT2表达的抑制,增强谷氨酸摄取率。NF-κB是p65和p50组成的异质二聚体,静态下与NF-κB抑制剂(IκB)结合存在于细胞质内,缺血再灌注损伤或缺氧应激等刺激可促进IκB磷酸化同时解除对NF-κB的抑制,NF-κB可从细胞质转移至细胞核调节与炎症反应,细胞存活、分化、增殖、血管形成等有关的基因转录。NF-κB在缺血脑损伤中发挥重要调节作用。Wang等[9]制作大鼠缺血再灌注模型,将IκB突变重组腺病毒(AdIκBaM)和野生型重组腺病毒转染皮层组织,结果发现AdIκBaM可明显抑制缺血后脑损伤。也有研究表明,NF-κB作为促死因子加重缺氧后的神经细胞死亡[10]。然而Sitcheran等[11]提出缺血再灌注损伤后 NF-κB也可作用于EAAT2启动子,正向或反向调节细胞外谷氨酸浓度,促进缺血后细胞存活或加重神经毒性损伤[12]。为了观察NF-κB是否参与丙泊酚处理后的EAAT调节,我们将NF-κB反义ODN和正义ODN分别加入各组培养细胞培养24 h后观察EAAT2的表达。结果显示反义ODN处理后两组NF-κB均无表达,正义ODN处理后对照组NF-κB表达明显增强,丙泊酚可抑制NF-κB的表达,与反义ODN相比,正义ODN处理可使EAAT2的表达明显减弱,说明NF-κB可负向调节EAAT2的表达,而缺氧后丙泊酚处理可逆转NF-κB的负向调节,从而促进EAAT2上调。此研究结果与Lee等[13]的结果相反,可能与本研究选用的是无氧培养细胞有关。
综上所述,缺氧后丙泊酚处理可通过NF-κB通路上调海马细胞EAAT2的表达,提高谷氨酸摄取率,降低兴奋性神经毒性损伤,这可能是丙泊酚发挥脑保护的主要机制。
[1]Barreto G,White RE,Ouyang Y,et al.Astrocytes:targets for neuroprotection in stroke[J].Cent Nerv Syst Agents Med Chem,2011,11(2):164-173.
[2] Velly LJ,Guillet BA,Masmejean FM,et al.Neuroprotective effects of propofol in a model of ischemic cortical cell cultures:role of glutamate and its transporters[J].Anesthesiology,2003,99(2):368-375.
[3]Su ZZ,Leszczyniecka M,Kang DC,et al.Insights into glutamate transport regulation in human astrocytes:cloning of the promoter for excitatory amino acid transporter 2(EAAT2)[J].Proc Natl Acad Sci USA,2003,100(4):1955-1960.
[4]Yun JY,Park KS,Kim JH,et al.Propofol reverses oxidative stress-attenuated glutamate transporter EAAT3 activity:evidence of protein kinase C involvement[J].Eur JPharmacol,2007,22(1-3):83-88.
[5]Ansley DM,Lee J,Godin DV,et al.Propofol enhances red cell antioxidant capacity in swine and humans[J].Can J Anaesth,1998,45(3):233-239.
[6]Kim K,Lee SG,Kegelman TP,et al.Role of excitatory amino acid transporter-2(EAAT2)and glutamate in neurodegeneration:opportunities for developing novel therapeutics[J].JCell Physiol,2011,226(10):2484-2493.
[7]Colton CK,Kong Q,Lai L,et al.Identification of translational activators of glial glutamate transporter EAAT2 through cell-based high-throughput screening:an approach to prevent excitotoxicity[J].J Biomol Screen,2010,15(6):653-662.
[8]Dallas M,Boycott HE,Atkinson L,et al.Hypoxia suppresses glutamate transport in astrocytes[J].J Neurosci,2007,27(15):3946-3955.
[9]Wang R,Liang S,Yue H,et al.Using a novel in vivo model to study the function of nuclear factor kappa B in cerebral ischemic injury[J].Med Sci Monit,2012,18(11):BR461-467.
[10]Nijboer CH,Heijnen CJ,Groenendaal F,et al.A dual role of the NF-kappaB pathway in neonatal hypoxic-ischemic brain damage[J].Stroke,2008,39(9):2578-2586.
[11]Nurmi A,Lindsberg PJ,Koistinaho M,et al.Nuclear factor-kappaB contributes to infarction after permanent focal ischemia[J].Stroke,2004,35(4):987-991.
[12]Vaibhav K,Shrivastava P,Javed H,et al.Piperine suppresses cerebral ischemia-reperfusion-induced inflammation through the repression of COX-2,NOS-2,and NF-κB in middle cerebral artery occlusion rat model[J].Mol Cell Biochem,2012,367(1-2):73-84.
[13]Lee SG,Su ZZ,Emdad L,et al.Mechanism of ceftriaxone induction of excitatory amino acid transporter-2 expression and glutamate uptake in primary human astrocytes[J].J Biol Chem,2008,283(19):13116-13123.

