C1QBP在单核细胞THP-1趋化运动中的作用
岳 丹,苑 博,齐 灿,冯香梅,刘运德,王 勇,
(1天津医科大学医学检验学院,天津300203;2天津医科大学第二医院)
趋化运动是指细胞能够感受到环境中化学分子的浓度梯度,并沿着浓度梯度的方向所做的定向运动[1],它与机体的免疫应答及肿瘤转移等密切相关。C1QBP是一种多功能伴侣蛋白,广泛分布于线粒体、细胞核、细胞质、高尔基体及细胞膜上,并能够被分泌到细胞外基质中,其生理功能可能包括参与细胞内分子运输、连接不同细胞器以及细胞器和细胞膜之间的信号传导[2]。为探讨炎症性疾病的发病机制和肿瘤治疗的理论依据,2011年3月~2013年6月,我们对C1QBP在单核细胞中的表达及对细胞趋化运动的影响进行了研究。
1 材料与方法
1.1 材料
1.1.1 细胞株 人急性单核白血病细胞(THP-1),小鼠白血病巨噬细胞(RAW264.7)和人乳腺癌细胞(MDA-MB-231)均购自美国ATCC细胞库;THP-1细胞用RPMI-1640培养基,RAW264.7和MDA-MB-231细胞用DMEM培养基。
1.1.2 试剂及抗体 Lipofectamine2000购自 Invitrogen公司,CSF-1购自美国BD公司,趋化小室、聚碳酸脂膜购自Neuro Probe公司,纤连蛋白(Fibronectin)购自Sigma公司,BCA测定试剂盒购自Pierce公司,C1QBP抗体、PKCζ抗体、β-actin抗体、辣根过氧化物酶标记的IgG二抗均购自美国Santa Cruz公司,鬼笔环肽(phalloidin)购自 Molecular Probe公司,蛋白A琼脂糖(Protein A Agarose)和蛋白G琼脂糖(Protein G Agarose)购自Invitrogen公司,其他试剂均为国产分析纯产品。
1.2 方法
1.2.1 C1QBP、PKCζ在细胞中的表达检测 预冷的1×SDSlysis buffer(或RIPA裂解液)裂解细胞,提取总蛋白,BCA法测定总蛋白浓度。取30μg蛋白进行SDS-PAGE电泳,半干转印法将凝胶上的蛋白转印至PVDF膜上。用含5%脱脂奶粉的TBST溶液室温封闭1 h,兔源抗C1QBP、PKCζ、鼠源抗βactin一抗4℃孵育过夜。辣根过氧化物酶标记的IgG二抗室温孵育1 h,ECL化学发光法显影。
1.2.2 siRNA有效序列筛选 人 C1QBP特异性Stealth-TM RNAi由Invitrogen公司设计合成。将细胞铺于6孔板中,待细胞30% ~50%融合时,换成无双抗无血清培养液。将 5μL(100 pmol)的StealthTM RNAi加入250μL的Opti-MEM无血清培养基中,轻轻混匀;将5μL的Lipofectamine 2000加入250μL的Opti-MEM无血清培养基中,轻轻混匀;室温静置孵育5 min。将上述液体混匀,室温静置孵育20 min;将6孔盘中的培养液弃去,加入1.5 mL的无双抗含血清培养基;将上述混合液加入培养板中,放入37℃、5%CO2培养箱中培养。
1.2.3 C1QBP表达对细胞趋化运动能力影响的检测 集落刺激因子(CSF-1)用0.1%BM稀释浓度至1、10、50、100 ng/mL,置于趋化小室的下室,30 μL/孔,只加0.1%BM的孔作为阴性对照;调整细胞浓度为5×105/mL,50μL/孔,加于趋化小室的上室;将10μg/mL Fibronectin包被的5μm孔径的聚碳酸酯膜置于趋化小室的上下室之间。趋化小室在37℃、5%CO2的孵化箱中孵育3 h;聚碳酸酯膜用PBS清洗,将没穿过膜的细胞刮除洗掉,穿过膜的细胞固定、染色,在倒置显微镜下计数穿过膜的细胞数,每孔至少随机选取3个视野。
1.2.4 C1QBP表达对细胞聚合能力影响的检测细胞提前饥饿3 h,将细胞提前铺于6孔板中,3×105/孔,用50 ng/mL的CSF-1刺激细胞。冰PBS终止反应,用3.7%多聚甲醛固定10 min。用含0.2%Triton X-100的F-buffer作用20 min,F-buffer快速洗涤。室温下用FITC-conjugated phalloidin避光孵育细胞1 h,用F-buffer洗涤,加入甲醇萃取phalloidin,4℃萃取1 h。将甲醇吸入96孔板中,细胞用F-buffer洗涤,提取蛋白,BCA法在562 nm波长下测定蛋白浓度。
1.2.5 C1QBP与PKCζ的相互作用检测 培养的细胞用冰PBS洗3次,加入预冷的细胞裂解液在冰上晃动30 min,用细胞刮刮取,收集细胞裂解液,12 000 r/min、4℃、离心15 min。每管吸取上清液50~100μL作为Input。将剩余的上清液吸入细胞裂解液预洗过的Protein A或Protein G Agarose中做预清除,以去除非特异结合的蛋白。在4℃摇床上反应1 h,快速离心20~30 s,吸取上清,加入相应的抗体及同源的对照抗体IgG,4℃摇床上反应2 h;加入新的预处理过的Protein A或Protein G Agarose在4℃摇床上反应1 h;快速离心,弃上清,用裂解液洗涤Protein A或Protein G Agarose。加入1×loading buffer 50~100μL,同时将 Input加入5×loading buffer,95°C煮10 min使蛋白变性;将上清液吸入新的EP管中,进行Western blot检测。
1.2.6 统计学方法 采用SPSS11.0统计软件,选用方差分析或t检验对数据行统计学处理。P≤0.05为差异有统计学意义。
2 结果
2.1 C1QBP及 PKCζ在细胞中的表达 C1QBP、PKCζ在 THP-1、RAW264.7、MDA-MB-231 三种细胞系中均有较高表达(图1)。
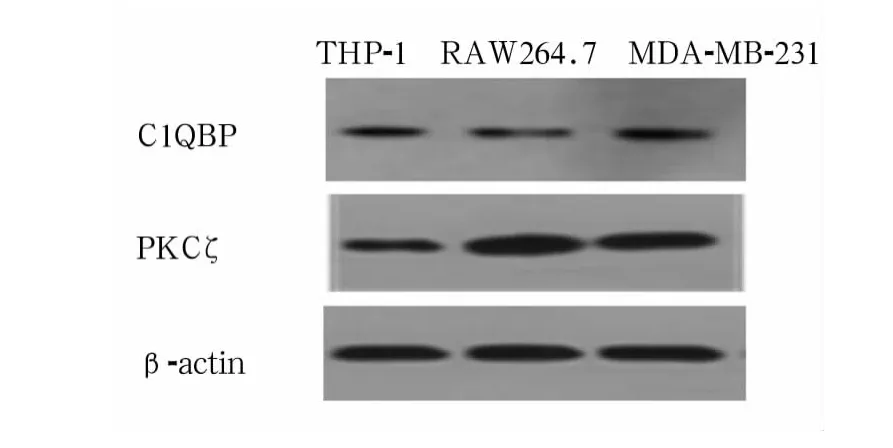
图1 C1QBP 及 PKCζ在 THP-1、RAW264.7、MDA-MB-231细胞中的表达
2.2 C1QBP表达对THP-1细胞趋化运动的影响采用siRNA技术降低THP-1细胞中C1QBP蛋白的表达,筛选该蛋白表达量降低的有效序列为1和3(图2)。显示C1QBP表达下调可以明显抑制THP-1细胞的趋化运动(P<0.01)(图3)。
2.3 C1QBP表达对THP-1细胞聚合能力的影响C1QBP表达降低导致CSF-1诱导的F-actin聚合能力降低(图4)。
2.4 C1QBP与PKCζ的相互作用 经CSF-1刺激THP-1细胞后提取总蛋白,免疫共沉淀实验发现C1QBP与PKCζ可以相互作用(图5)。
3 讨论
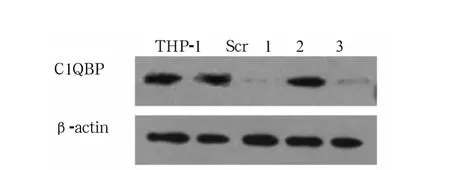
图2 C1QBP蛋白表达量降低的有效序列
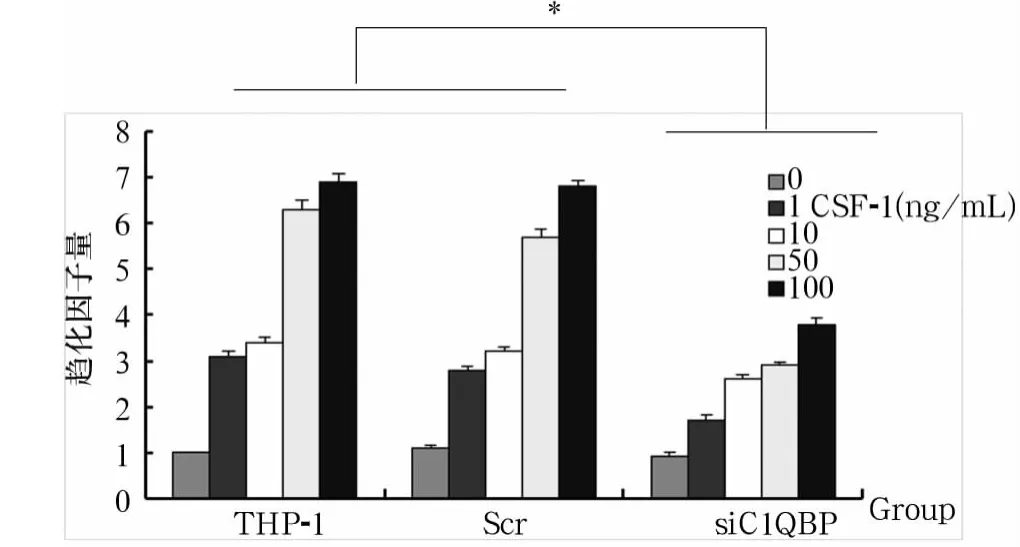
图3 C1QBP表达下降对THP-1趋化运动的影响
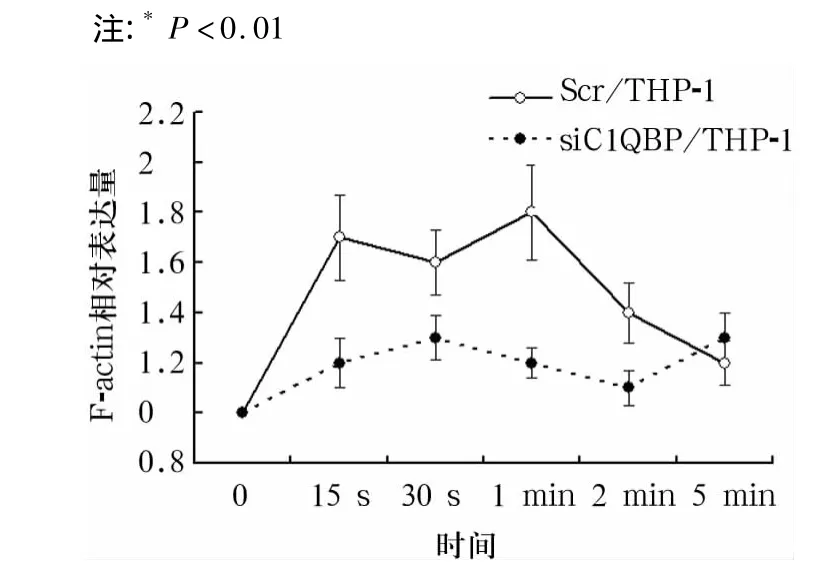
图4 THP-1中C1QBP表达下降对CSF-1诱导的F-actin聚合能力的影响
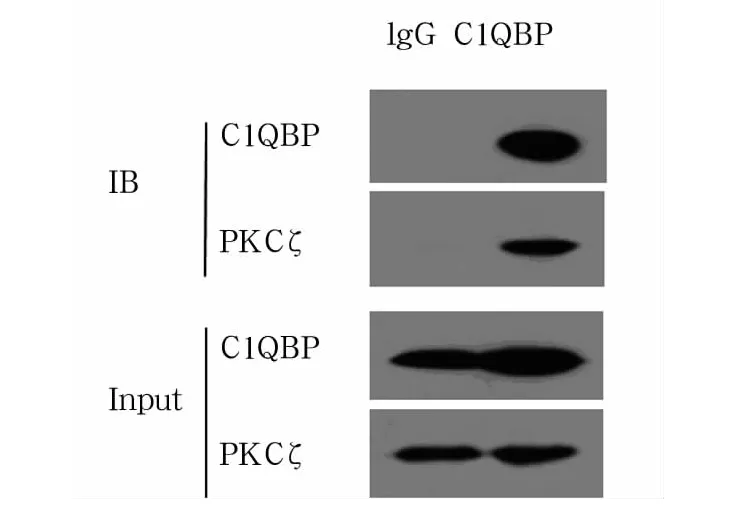
图5 C1QBP与PKCζ在THP-1中的相互作用
机体在病毒、细菌脂多糖等外源性或白细胞介素、肿瘤坏死因子、干扰素等内源性炎症因子刺激下产生大量的趋化因子,趋化单核/巨噬细胞到达炎性部位并活化,因此单核/巨噬细胞趋化运动在抵御病原体感染过程中发挥着关键作用[3]。巨噬细胞入侵对肿瘤的发展和转移起着重要的作用。在肿瘤形成之前常有大量的巨噬细胞和其他炎症细胞在肿瘤原位聚集,慢性炎症可加重病灶部位的巨噬细胞聚集,这些炎症细胞可被反复激活并释放活性氧,造成组织细胞损伤、转化以致癌变[4]。肿瘤中表达的CSF-1能加快单核/巨噬细胞向肿瘤组织的趋化[5],动物实验也证实抑制巨噬细胞向肿瘤聚集可以明显抑制肿瘤的生长和转移[4,6]。目前,细胞趋化运动的调控机制尚待完善,阐明单核细胞趋化运动的分子机制,对炎性疾病及肿瘤治疗具有重要意义。细胞的趋化运动需要很多蛋白分子参与,它们分布于细胞的不同位置,发挥各自不同的作用。如果抑制某一个或几个分子的活化过程,势必会直接或间接影响细胞的趋化运动能力。C1QBP是一种多功能伴侣蛋白,其详细的生理功能还不是很清楚。C1QBP与透明质酸相互作用,促使细胞间黏附和去黏附的产生,并参与了染色体的组建[7];与Clq结合调节淋巴细胞增殖[8];与 ASF/SF2结合,调节前mRNA的剪接[9]。最近的研究表明,线粒体中的p32还参与了ARF诱导的细胞凋亡以及维持肿瘤细胞的氧化磷酸化[10,11]。本研究利用小RNA干扰技术降低 THP-1细胞 C1QBP的表达,首次发现C1QBP表达沉默可抑制THP-1细胞的趋化运动,降低F-actin聚合能力。因此我们认为C1QBP在调节THP-1细胞的趋化运动中起重要作用。
PKCζ的12种亚型构成了一个丝氨酸/苏氨酸激酶超家族,是细胞内重要的信号传导分子,参与调节细胞的增殖、生长及凋亡。此外,PKCζ还参与了细胞骨架重排、细胞的极化、分化、运动和肿瘤转移等[12]。研究发现,PKCζ在调节肿瘤及单核/巨噬细胞的趋化运动中起重要的作用;PKCζ通过调节肌动蛋白的聚合参与了巨噬细胞的趋化运动,PKCζ降表达可以抑制CSF-1诱导的巨噬细胞趋化运动,同时也抑制MCP-1诱导的巨噬细胞趋化运动[13~15]。因此,PKCζ是G蛋白偶联受体和酪氨酸激酶受体所诱导的信号通路中一个共用的信号分子,同时也是细胞趋化运动途径中的关键分子。
研究发现,活化的PKCζ与p32在体外结合明显增强,p32可能在PKCζ转位及功能的调节方面起重要作用[16]。近期有研究证实,p32参与调节PKCζ从细胞质向细胞膜转位后,p32、PKCζ和mL-gl2蛋白结合形成暂时的三元络合物,PKCζ被激活,进一步磷酸化 mLgl2蛋白,继而调节细胞的极性[17]。在单核/巨噬细胞中,C1QBP与 PKCζ的相互作用尚无报道。本研究利用免疫共沉淀实验发现C1QBP与PKCζ之间存在相互作用。进一步探讨二者之间的相互作用机制,可能对揭示单核/巨噬细胞趋化运动中的调节机制有重要意义。
[1]Devreotes PN,Zigmond SH.Chemotaxis in eukaryotic cells:a focus on leukocytes and Dictyostelium[J].Annu Rev Cell Biol,1998,4:649-686.
[2]Ghosh I,Chattopadhaya R,Kumar V,et al.Hyaluronan binding protein-1:a modulator of spermoocyte interaction[J].Soc Reprod Fertil Suppl,2007,63:539-543.
[3]Hamilton JA,Tak PP.The dynamics of macrophage lineage populations in inflammatory and autoimmune diseases[J].Arthritis Rheum,2009,60(5):1210-1221.
[4]Qian BZ,Pollard JW.Macrophage diversity enhances tumor progression and metastasis[J].Cell,2010,141(1):39-51.
[5]Porta C,Riboldi E,Sica A.Mechanisms linking pathogens-associated inflammation and cancer[J].Cancer Lett,2011,305(2):250-262.
[6]Qian B,Deng Y,Im JH,et al.A distinct macrophage population mediates metastatic breast cancer cell extravasation,establishment and growth[J].PLoSOne,2009,4(8):e6562.
[7]Sengupta A,Banerjee B,Tyagi RK,et al.Golgi localization and dynamics of hyaluronan bindingprotein 1(HABP1/p32/C1QBP)during the cell cycle[J].Cell Res,2005,15(3):183-186.
[8]Ghebrehiwet B,Peerschke EI.cC1q-R(calreticulin)and gC1q-R/p33:ubiquitously expressed multi-ligand binding cellular proteins involved in inflammation and infection[J].Mol Immunol,2004,41(2/3):173-183.
[9]Petersen-Mahrt SK,Estmer C,Ohrmalm C,et al.The splicing factor-associated protein,p32,regulates RNA splicing by inhibiting ASF/SF2 RNA binding and phosphorylation[J].EMBO J,1999,18(4):1014-1024.
[10] Fogal V,Richardson AD,Karmali PP,et al.Mitochondrial p32 protein is a critical regulator of tumor metabolism via maintenance of oxidative phosphorylation[J].Mol Cell Biol,2010,30(6):1303-1318.
[11]Itahana K,Zhang Y.Mitochondrial p32 is a critical mediator of ARF-induced apoptosis[J].Cancer Cell,2008,13(6):542-553.
[12]Sheinerman FB,Giraud E,Laoui A.High affinity targets of protein kinase inhibitors have similar residues at the positions energetically important for binding[J].JMol Biol,2005,352(5):1134-1156.
[13]Guo H,Gu F,Li W,et al.Reduction of protein kinase Czeta inhibitsmigration and invasion of human glioblastoma cells[J].J Neurochem,2009,109(1):203-213.
[14]Guo H,Ma Y,Zhang B,et al.Pivotal Advance:PKCzeta is required for migration of macrophages[J].J Leukoc Biol,2009,85(6):911-918.
[15]Zhang B,Ma Y,Guo H,et al.Akt2 is required for macrophage chemotaxis[J].Eur J Immunol,2009,39(3):894-901.
[16] Robles-Flores M,Rendon-Huerta E,Gonzalez-Aguilar H,et al.p32(gC1qBP)is a general protein kinase C(PKC)-binding protein;interaction and cellular localization of P32-PKCζcomplexes in ray hepatocytes[J].JBiol Chem,2002,277(7):5247-5255.
[17]Bialucha CU,Ferber EC,Pichaud F,et al.p32 is a novel mammalian Lgl binding protein that enhances the activity of protein kinase Czeta and regulates cell polarity[J].J Cell Biol,2007,178(4):575-581.

